鐵死亡在腫瘤中的研究進展
胡善林, 莫欽國, 羅建芳, 聶云鳳
(1. 廣西醫科大學腫瘤醫學院,廣西 南寧 530021;2. 廣西壯族自治區腫瘤醫院乳腺外科,廣西 南寧 530021;3. 南寧市第一人民醫院甲狀腺乳腺外科,廣西 南寧 530022)
鐵死亡(ferroptosis)于2008年由斯托克博士首次報道,它是一種鐵依賴性的非凋亡形式調節細胞死亡的過程[1]。鐵死亡有獨特的形態學和生物化學特征,其線粒體體積縮小,線粒體膜密度增加,線粒體嵴減少或消失,但細胞膜完整,細胞核大小正常,染色質無濃縮[2];細胞內谷胱甘肽消耗,谷胱甘肽過氧化物酶4(glutathione peroxidase 4,GPX4)活性下降,NADPH依賴性脂質過氧化以及鐵依賴性活性氧生成[2-4]。鐵死亡發生與半胱氨酸代謝、脂質代謝和鐵循環密切相關:半胱氨酸生成受抑制和谷胱甘肽減少是鐵死亡的關鍵環節[5];多不飽和脂肪酸易發生脂質過氧化直接誘導鐵死亡[6];鐵離子的吸收、排除、存儲和含量可影響細胞對鐵死亡的敏感性[7]。鐵死亡還受其他分子直接或間接地調節,包括電壓依賴性陰離子通道(voltage dependent anion channel, VDAC)、核因子紅細胞2相關因子2、腫瘤抑制基因p53以及NADPH氧化酶等[5,8]。人與小鼠的多種生理和病理過程都可發生鐵死亡[9-12]。研究表明,誘導鐵死亡可以抑制腫瘤細胞增殖,影響動物體內腫瘤的生長和轉移。如抑制半胱氨酸脫硫酶可在體外誘發細胞鐵死亡,減緩肺癌細胞增殖[13];下調視網膜母細胞瘤蛋白表達可以誘發細胞鐵死亡,致肝細胞癌異種移植小鼠體內腫瘤明顯消退[14];醉茄素A通過抑制GPX4活性誘發神經母細胞瘤細胞鐵死亡,抑制腫瘤生長并減少動物體內的腫瘤復發[15]。本文對近年來有關細胞鐵死亡的主要機制以及鐵死亡在腫瘤方面的研究進展作一綜述。
1 鐵死亡的主要機制
腫瘤細胞鐵死亡的誘導機制大體上分為經典和非經典途徑。經典途徑通過抑制胱氨酸/谷氨酸反向轉運系統(system Xc-)-谷胱甘肽-GPX4軸,導致脂質活性氧積累引發細胞鐵死亡,主要包括system Xc-、GPX4、轉硫通路、甲羥戊酸通路等[2-5]。非經典途徑是圍繞鐵代謝和線粒體直接或間接誘導鐵死亡。例如,與鐵代謝相關的核因子紅細胞2相關因子2和熱休克蛋白β調控通路[7],與線粒體相關的VDAC通路[5]。此外,p53既可通過經典途徑抑制system Xc-間接誘導,又可通過非經典途徑抑制二肽基肽酶4直接導致細胞鐵死亡[5,8]。見圖1。
1.1 直接抑制GPX4活性
GPX4是一種將H2O2和有機H2O2分解成水或相應醇的酶[16]。細胞內GPX4活性下降或GPX4直接降解會引發鐵依賴性活性氧增加,進而誘發鐵死亡[4]。RSL3可以直接與GPX4共價鍵結合并抑制其活性, 造成細胞內活性氧積累誘發鐵死亡[1,5]。FIN56通過誘導GPX4功能退化,增加GPX4降解來誘導鐵死亡[17],但其具體機制尚不清楚。此外,siRNA可以使GPX4 mRNA表達水平降低20倍,足以引起細胞活性氧積累和鐵死亡[5]。目前認為GPX4是多種鐵死亡誘導物誘導鐵死亡的關鍵靶點[18]。見圖1。
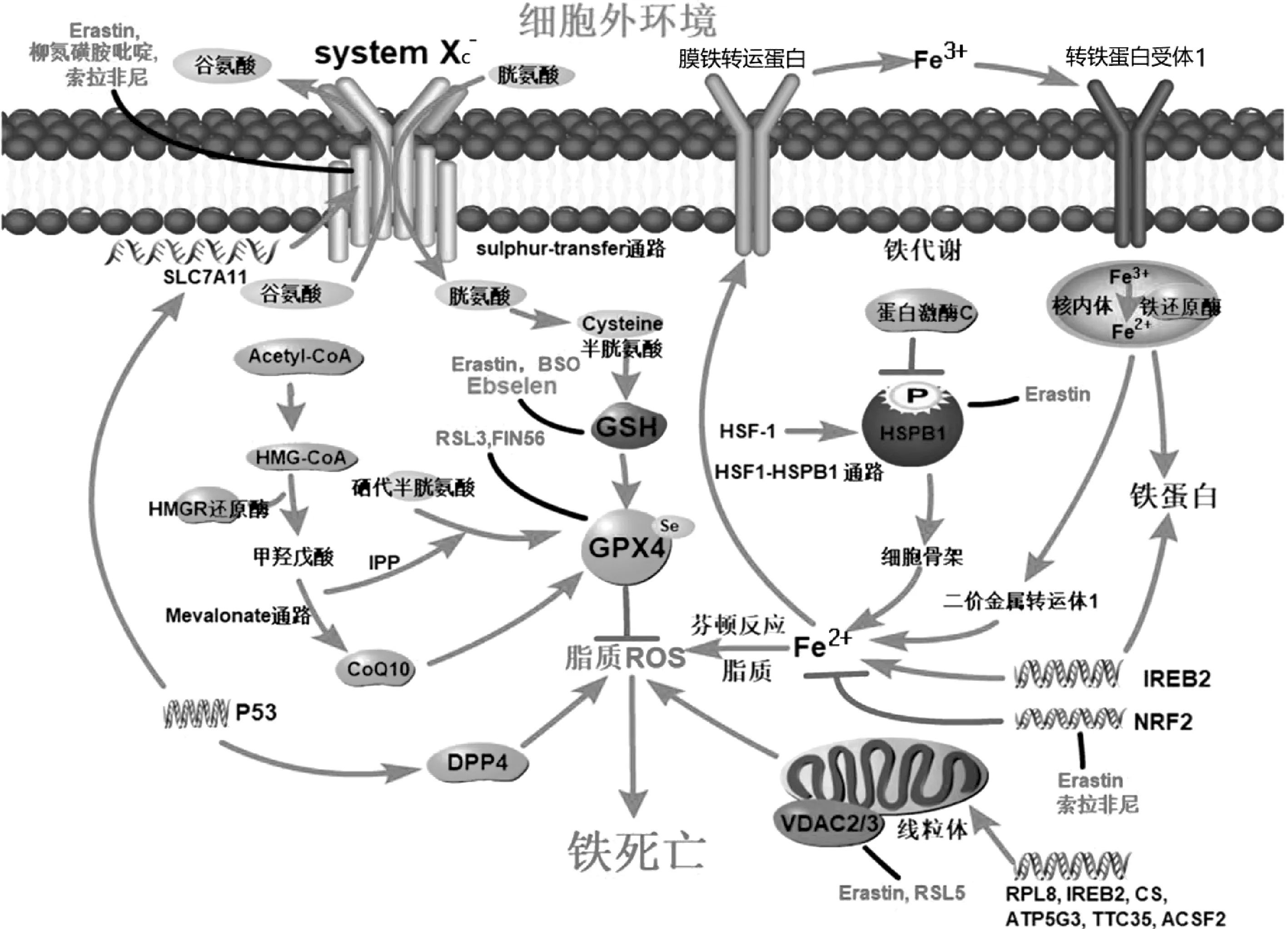
圖1 鐵死亡的分子機制及其信號轉導通路
1.2 抑制system Xc-活性
另一種機制是抑制system Xc-從而達到對GPX4的間接抑制。system Xc-是膜Na+依賴的胱氨酸-谷氨酸反向轉運體,是由輕鏈亞基SLC7A11和重鏈亞基SLC3A2組成的二硫鍵異二聚體[19]。system Xc-將細胞內谷氨酸轉運至胞外的同時,將胞外胱氨酸轉運至胞內,半胱氨酸在轉硫通路中合成谷胱甘肽[20]。谷胱甘肽是GPX4激活的必要輔因子,其產生和維持是保護細胞免受氧化應激的關鍵[21]。因此,細胞對胱氨酸的攝取不僅是谷胱甘肽合成的關鍵步驟,更是鐵死亡的核心。例如,Erastin通過抑制system Xc-阻止胞外胱氨酸進入細胞,減少半胱氨酸生成,降低細胞內谷胱甘肽水平,增加細胞內活性氧含量,最終導致鐵死亡[2,5]。見圖1。
1.3 其他機制
野生型p53對細胞的脂質合成和糖酵解起負調控作用,對氧化磷酸化和脂質分解起正調控作用,并通過調控活性氧直接參與鐵死亡[22]。野生型p53表達增加可抑制system Xc-的關鍵成分SLC7A11表達,抑制胱氨酸攝取,減少谷胱甘肽生成,從而降低GPX4活性,誘導骨肉瘤U2OS細胞和乳腺癌MCF7細胞發生鐵死亡[23]。另一項研究報道,野生型p53缺失或敲除時,二肽基肽酶4的積累明顯減少,導致與質膜相關的脂質過氧化,使結直腸癌HCT116和SW48細胞對鐵死亡敏感;并且,野生型p53表達增加可降低二肽基肽酶4活性,抑制由Erastin引起的鐵死亡[24]。此外,突變型p53蛋白增多可結合主抗氧化的轉錄因子——核因子紅細胞2相關因子2,抑制SLC7A11表達,谷胱甘肽合成減少,致食管癌細胞和肺癌細胞對鐵死亡更敏感[25]。上述發現揭示p53在誘導不同腫瘤細胞的鐵死亡過程中作用不同。大量的膜孔蛋白分布于線粒體外膜,其亦稱為VDAC,是真核細胞中離子和代謝物運輸的跨膜通道[26]。Erastin可與VDAC家族中的VDAC2和VDAC3結合,改變膜的通透性和離子選擇性,只允許陽離子進入線粒體,導致線粒體功能障礙和氧化劑釋放,可以直接導致鐵死亡[3]。見圖1。
2 鐵死亡和腫瘤的關系
越來越多研究發現,鐵死亡與卵巢癌、頭頸部腫瘤、肝癌、宮頸癌、胰腺癌以及腎癌等多種腫瘤細胞的生長調節密切相關[8,27-30]。見圖2。文獻報道,多種化合物和抗癌藥物通過誘導鐵死亡導致癌細胞死亡和抑制腫瘤生長[6,8]。Erastin與順鉑、阿糖胞苷、多柔比星聯合應用,可提高化療療效,誘導腫瘤細胞死亡[2,31-33];青蒿素衍生物誘導耐藥的腫瘤細胞發生鐵死亡并限制其轉移[33-35];小鼠異種移植模型中,鐵死亡誘導劑與磺胺嘧啶或丁硫氨酸亞砜亞胺聯合治療可降低肺腫瘤的生長[13]。以上為細胞鐵死亡的潛在機制,幾種特殊類型癌細胞中鐵死亡誘導的具體機制綜述如下。

圖2 鐵死亡參與的多種腫瘤
2.1 卵巢癌
青蒿琥酯是青蒿素的半合成衍生物,是一種抗瘧疾藥物,同時具有良好的抗癌活性[36]。研究表明,青蒿琥酯通過增加細胞中活性氧水平,導致細胞DNA損傷和G2/M期阻滯,誘導卵巢癌HEY1和HEY2細胞鐵死亡[35]。在培養基中加入鐵死亡抑制劑進行預處理,則能減少青蒿琥酯造成的細胞毒性[35]。由此提示,青蒿琥酯可能通過誘導鐵死亡來治療卵巢癌。此外,鐵代謝與卵巢癌細胞生長、擴散轉移潛在相關[37]。在體外實驗中,卵巢癌細胞內鐵含量增多可抑制其增殖;在動物體內實驗中,則表現出腫瘤生長抑制和腹腔內播散減少[37]。其機制可能是當鐵代謝受到干擾時,轉鐵蛋白受體1表達增加引起鐵攝取增多,膜鐵轉運蛋白表達抑制導致鐵存儲增加,最終細胞內鐵過度積累誘發鐵死亡[37]。
2.2 頭頸部腫瘤
研究表明,鐵死亡可以降低頭頸部腫瘤細胞對順鉑治療的耐藥性[33]。Roh等[33]發現,無論是基因工具沉默system Xc-轉錄,還是Erastin和磺胺嘧啶等藥物都可以抑制system Xc-活性。system Xc-抑制后引起GPX4抑制和谷胱甘肽消耗,并誘導細胞活性氧水平升高,最終誘發鐵死亡,使對順鉑耐藥的腫瘤細胞對順鉑更加敏感[33]。有文獻報道,通過誘導細胞鐵死亡,雙氫青蒿素在治療頭頸部鱗癌方面有潛在作用[34]。具體機制是雙氫青蒿素通過調控細胞周期調節蛋白的表達,在S期和G2/M期抑制腫瘤細胞有絲分裂并誘導鐵死亡[34]。研究還發現,在含有去鐵胺的細胞系中,去鐵胺通過減少細胞內Fe2+對抗雙氫青蒿素誘發的鐵死亡。由此可見,在雙氫青蒿素誘導腫瘤細胞死亡中,Fe2+參與是該過程所必需[34]。這些研究表明,誘導細胞鐵死亡可能是頭頸癌治療的有效策略。
2.3 肝細胞癌
肝細胞癌細胞鐵死亡分為兩類,一類與鐵代謝相關,另一類與脂質代謝相關。吡格列酮通過穩定鐵硫結構域1,抑制線粒體對鐵的吸收,可以減少由Erastin引起的脂質過氧化和肝癌細胞鐵死亡[38]。去鐵胺能影響肝癌細胞的鐵代謝,抑制索拉非尼誘導的細胞氧化應激反應,從而對抗索拉非尼對肝癌細胞的細胞毒性作用[39]。此外,在索拉非尼誘導細胞死亡的過程中,氟哌啶醇可以顯著增加細胞中Fe2+和谷胱甘肽含量,以及活性氧水平,增強索拉非尼對肝癌細胞的毒性作用[40]。除鐵代謝外,脂代謝也在肝細胞癌的鐵死亡中起重要作用。在大鼠肝癌模型、小鼠肝癌細胞系中,低密度脂蛋白二十二碳六烯酸通過直接降解GPX4、消耗谷胱甘肽和促進脂質過氧化誘導肝癌細胞鐵死亡[41]。金屬硫蛋白1作為一種負調控因子,其下調可增加谷胱甘肽消耗和脂質過氧化物生成,加速索拉非尼誘導癌細胞死亡,增強皮下移植瘤模型中索拉非尼抗癌活性[42]。類似的鐵死亡負調控因子還有視網膜母細胞瘤蛋白、核因子紅細胞2相關因子2、p53,通過抑制其表達可增加索拉非尼藥效并降低肝癌細胞耐藥性[14,24,43]。這些分子可能是克服人肝細胞癌細胞對索拉非尼耐藥的潛在治療靶點。
2.4 其他腫瘤
在K-Ras基因突變型胰腺癌細胞中,青蒿琥酯不僅可以直接誘導脂質過氧化和活性氧水平升高,還能通過調控鐵代謝來促進細胞鐵死亡發生[44]。此外,在胰腺癌細胞中,system Xc-中SLC7A11蛋白表達上調,增加胱氨酸攝取,導致谷胱甘肽水平升高[45]。細胞內谷胱甘肽增多促進胰腺癌生長,并減少吉西他濱誘發的氧化應激和細胞死亡[45]。抑制SLC7A11蛋白表達誘發細胞鐵死亡,可能是解決胰腺癌對吉西他濱耐藥的潛在方法[45]。在橫紋肌肉瘤細胞培養基中添加Erastin和RSL3,可以抑制system Xc-、減少谷胱甘肽生成并誘導細胞鐵死亡[46]。另有文獻報道,在彌漫性大B細胞淋巴瘤和腎細胞癌中,Erastin作用于GPX4,以積累脂質活性氧的方式誘導細胞鐵死亡[5]。總之,已發現多種與鐵死亡相關的調節分子和藥物可直接或間接影響腫瘤細胞發生鐵死亡;但是,在不同腫瘤細胞中鐵死亡的作用機制以及調節因子不盡相同。
3 問題和展望
鐵死亡是一種新發現的細胞死亡形式,它主要由活性氧積累和脂質過氧化誘發。抑制GPX4和system Xc-活性、調控p53以及線粒體功能障礙是鐵死亡的潛在機制。半胱氨酸、脂質和鐵代謝參與多種腫瘤細胞的鐵死亡。青蒿琥酯、Erastin、氟哌啶醇、RSL3等藥物通過鐵死亡作用誘導癌細胞死亡并發揮治療作用。在頭頸部腫瘤、卵巢癌、肝細胞癌、胰腺癌等腫瘤中,p53、SLC7A11、視網膜母細胞瘤蛋白、鐵硫結構域1、金屬硫蛋白1等分子參與鐵死亡。然而鐵死亡詳細的信號通路和關鍵的轉錄調控因子仍然未知。此外,鐵死亡在腫瘤細胞的轉移、自噬和耐藥等方面的作用有待進一步研究。

