基于網絡藥理學探析參桃軟肝丸治療肝細胞癌的機制*
何燦封 ,李穗暉
(1. 廣州中醫藥大學第一臨床醫學院 廣州 510405;2. 廣州中醫藥大學第一附屬醫院 廣州 510405)
原發性肝癌(primary hepatocellular carcinoma)是臨床中最常見且惡性程度最高的腫瘤之一,其發生率和死亡率在我國腫瘤疾病中分別位列第4 位及第3位,肝細胞癌(hepatocellular carcinoma,HCC)是其中最主要的病理類型,約占85%-90%以上[1]。肝細胞癌起病隱匿,早期臨床癥狀不明顯,多數患者確診時已屬局部晚期或伴有遠處轉移,且多數合并肝炎、肝功能及凝血功能異常而無法進行手術,即使允許行手術治療,術后5 年復發及轉移率仍有40%-70%[1],后續治療效果不佳,預后極差。
參桃軟肝丸是國醫大師周岱翰治療肝癌的經驗方,主要由人參、桃仁、當歸、仙鶴草、丹參、大黃、冬蟲夏草、人工牛黃組成,具有健脾養肝、軟堅消癥之功效,臨床上廣泛用于治療肝細胞癌,特別是乙肝病毒相關性肝細胞癌。臨床研究表明,參桃軟肝丸對于中晚期肝癌患者具有穩定瘤體、提高生存質量的作用,并且在改善患者肝區疼痛、腹脹、納呆、乏力癥狀有較好療效[2]。目前在參桃軟肝丸原方組成的基礎上開發出參桃軟肝膠囊[3],藥理研究表明參桃軟肝膠囊或通過抑制癌細胞生長、誘導凋亡、抑制腫瘤新生血管形成及改善機體免疫等方面發揮抗肝癌作用[4]。
為了探析參桃軟肝丸治療HCC 的機制,本文將基于網絡藥理學技術,構建參桃軟肝丸治療HCC 的“多成分-多靶點”網絡,通過基因功能和通路富集分析確定參桃軟肝丸的藥理活性,并使用分子對接技術進一步研究參桃軟肝丸關鍵成分與關鍵靶標之間的相互作用,以期為參桃軟肝丸的臨床應用提供依據,并為今后深入的實驗研究提供方向。
1 資料與方法
1.1 收集參桃軟肝丸的活性成分及靶點
從中藥系統藥理學分析平臺(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP,http://www.tcmspw.com/tcmsp.php)中收集人參、桃仁、當歸、仙鶴草、丹參、大黃、冬蟲夏草、人工牛黃的成分,根據口服生物利用度(oral bioavailability,OB)≥ 30% 和類藥性(drug-likeness,DL)≥0.18 進一步篩選出活性候選成分,并獲取其相應的靶點,同時刪除不含有靶點的活性成分。然后通過通用蛋白質數據庫(universal protein,Uniprot,http://www.uniprot.org)將收集到的靶點轉化為對應的基因名稱(gene symbol),其中物種來源限制為人(“Homo sapiens”),刪除物種來源不符合人的靶點。
1.2 篩選參桃軟肝丸治療HCC的潛在靶點
使用“hepatocellular carcinoma”作為關鍵詞檢索人類基因數據庫GeneCards(https://www.genecards.org),獲取與HCC 相關的疾病靶點后,與“1.1”中獲得的靶點取交集,最終獲得參桃軟肝丸活性候選成分治療HCC的潛在靶點。
1.3 成分-靶點網絡構建
使用Cytoscape 軟件(版本3.7.1)構建參桃軟肝丸治療HCC 的“中藥-活性成分-靶點”網絡,同時采用CytoHubba 插件對該網絡進行關鍵成分分析。連接度(degree,是體現節點重要程度的參數,即節點間相連的路徑數目),degree值高的活性成分被認為是參桃軟肝丸治療HCC的關鍵成分。
1.4 基因本體Gene Ontology, GO 分子功能和京都基因與基因組百科全書(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析
clusterProfiler 是R 語言中用于基因集合功能及通路途徑富集分析和可視化的軟件包。在R 語言(版本3.6.1)中調用clusterProfiler 包對“1.2”獲取的靶點進行GO分子功能和KEGG通路富集分析,其中篩選條件為P< 0.001。
1.5 構建蛋白質互作網絡及分析關鍵靶點
將“1.2”篩選獲得的靶點導入蛋白互作網絡分析平臺 STRING 數據庫(http://string-db.org/),其中物種來源限制為人(“Homo sapiens”),構建蛋白質互作(protein-protein interaction,PPI)網絡,保存為“tsv”格式文件導出后,導入至Cytoscape軟件,采用CytoHubba插件對該網絡進行關鍵靶點分析,degree 值排名前5的靶點被認為是參桃軟肝丸的活性候選成分治療HCC的關鍵靶點。
1.6 分子對接
使用分子對接技術研究參桃軟肝丸關鍵成分與關鍵靶點之間的相互作用,具體為分別從蛋白質結構數據庫PDB(http://www.rcsb.org/)和有機小分子生物活性數據庫PubChem(https://pubchem.ncbi.nlm.nih.gov/)下載靶蛋白結構及關鍵成分結構后,上傳至CB-Dock在線分子對接網站(http://cao.labshare.cn/cb-dock/),CB-Dock 可自動識別蛋白潛在結合位點,計算中心和大小后自定義對接口袋大小,并使用內置的AutoDock Vina 軟件進行分子對接,以及對對接后結構打分。完成上述操作后,使用R 語言的pheatmap 包繪制熱圖,并使用Maestro 11.9 軟件對上述對接結果中Vina 對接分值最佳的受體-配體結構進行繪圖。
2 結果
2.1 參桃軟肝丸候選活性成分
從TCMSP中檢索人參、桃仁、當歸、仙鶴草、丹參、大黃、冬蟲夏草、人工牛黃的成分,根據閾值OB ≥30%和DL ≥0.18 進一步篩選,并去除重復成分后,共篩選出符合條件的候選成分113個(表1)。
2.2 參桃軟肝丸治療HCC的候選靶點
匯總候選成分在TCMSP 中相應的靶點后,通過Uniprot數據庫將靶點名稱轉換為相應的基因名稱,并剔除重復及非人類靶點后,共獲得271 個潛在靶點。檢索GeneCards 數據庫得到與HCC 相關的靶點共758個,前后兩者取交集,最終獲得參桃軟肝丸候選活性成分的潛在治療靶點共73個(表2、圖1)。
2.3 構建中藥-活性成分-靶點
使用Cytoscape 軟件繪制參桃軟肝丸治療HCC 的“中藥-活性成分-靶點”網絡圖,詳見圖2。該圖直觀反映了參桃軟肝丸多成分、多靶點治療HCC 的作用機制。CytoHubba 插件分析表明,quercetin(槲皮素)、luteolin(木犀草素)、kaempferol(山奈酚)是degree 值排名前三的活性成分,可認為是參桃軟肝丸治療HCC 的關鍵成分。
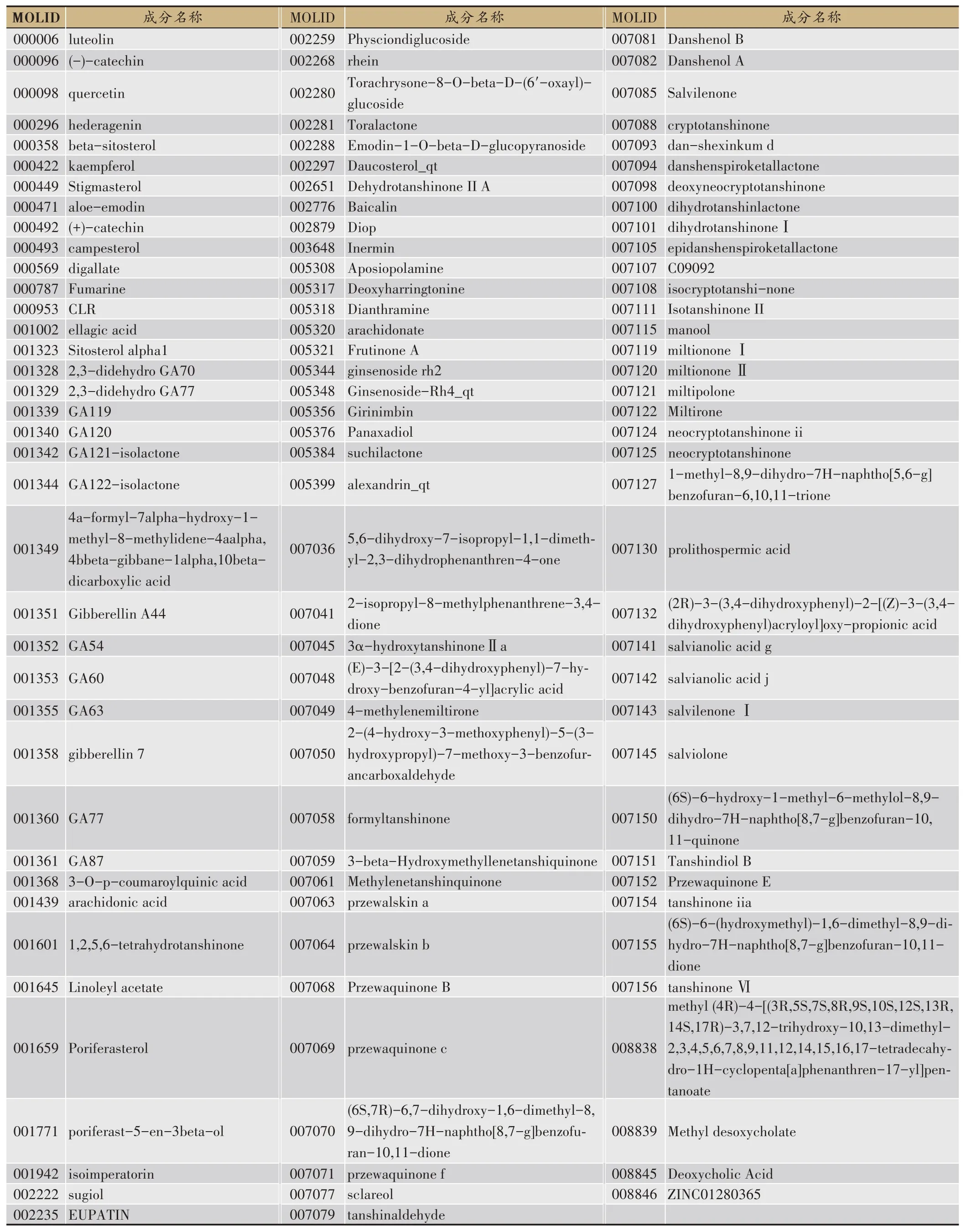
表1 參桃軟肝丸候選成分的具體信息
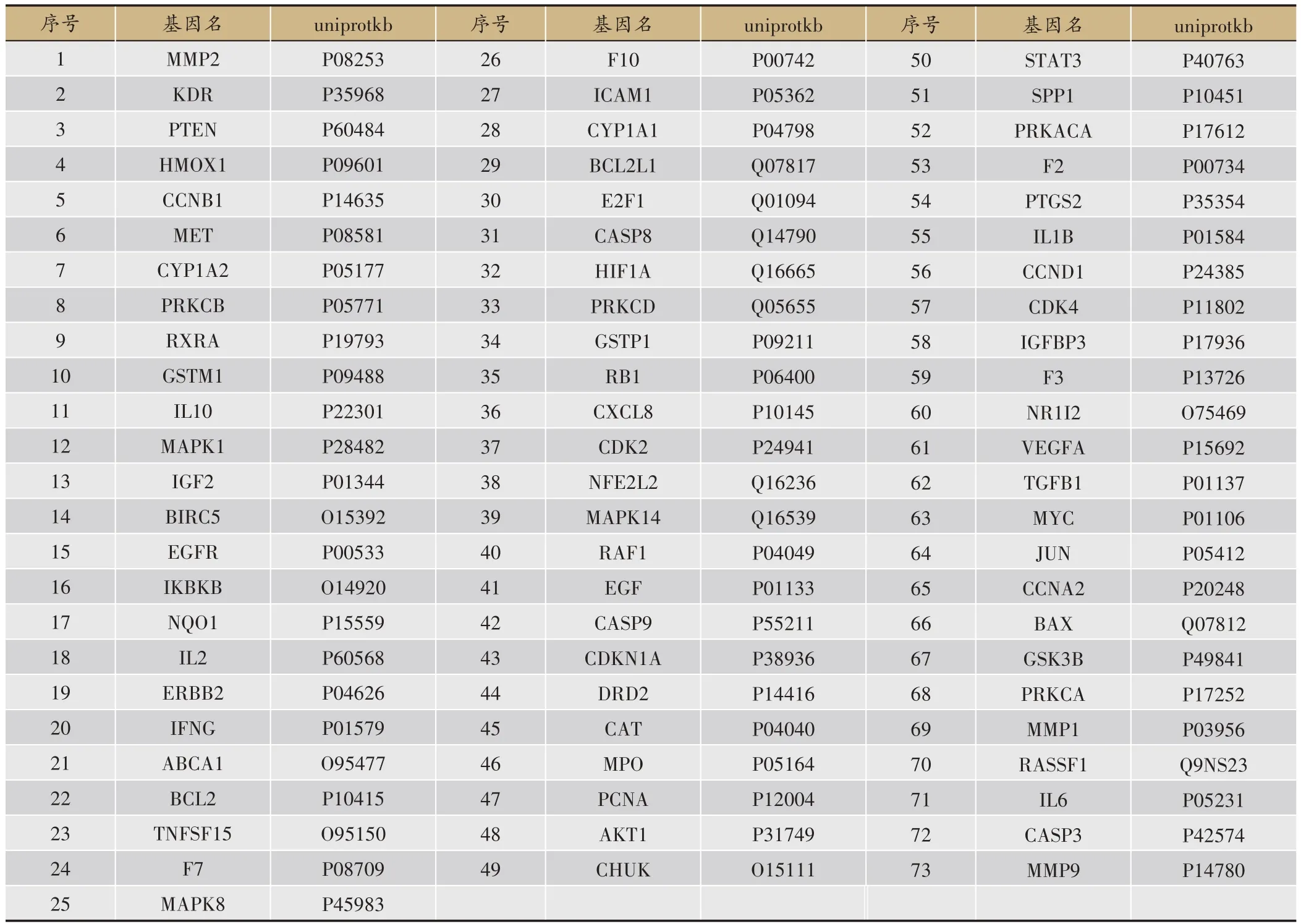
表2 參桃軟肝丸治療HCC的潛在靶點
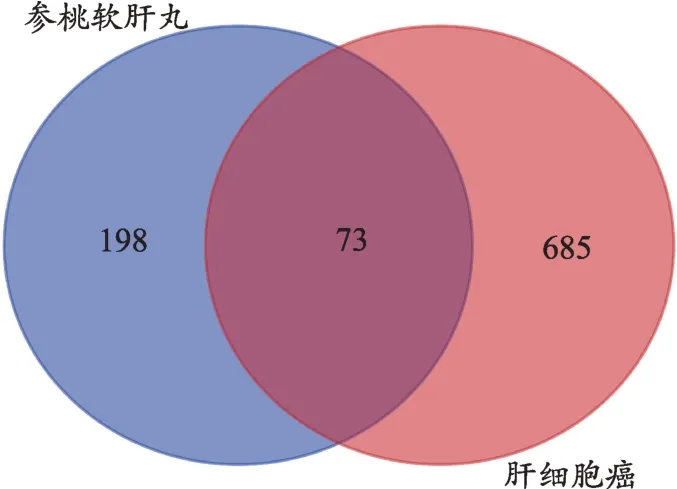
圖1 參桃軟肝丸治療HCC靶點的篩選
2.4 GO分子功能富集結果
clusterProfiler 包對上述73 個潛在靶點基因的GO分子功能聚類結果表明,排名前30的富集結果涉及了細胞生長、細胞周期、細胞凋亡、抗氧化和多種蛋白激酶調節等多個分子功能的調節(圖3)。
2.5 KEGG通路富集結果
clusterProfiler 包對上述73 個潛在靶點基因的KEGG 通路富集分析表明,P值排名前50 條通路主要有乙型肝炎、糖尿病并發癥中的晚期糖基化終產物-晚期糖基化終產物受體(advanced glycation end products-receptor for advanced glycation end product,AGE-RAGE)信號通路、膀胱癌、胰腺癌、卡波西氏肉瘤相關皰疹病毒感染、人巨細胞病毒感染、肝細胞癌、非小細胞肺癌、表皮生長因子受體(epidermal growth factor receptor,EGFR)酪氨酸激酶抑制劑耐藥以及丙型肝炎等(圖4)。
2.6 PPI網絡圖
通過STRING網站和Cytoscape軟件對參桃軟肝丸中治療HCC 的73 個靶點進行PPI 分析并作圖,CytoHubba 插件分析顯示degree 值排名前5 的靶點依次為:蛋白激酶B(protein kinase B,PKB or AKT1)、半胱氨酸天冬氨酸蛋白酶3(caspase-3,CASP3)、血管內皮生長因子A(vascular endothelial growth factor A,VEGFA)、V-Jun 肉瘤病毒癌基因同源物(V-Jun sarcoma virus 17 oncogene homolog,JUN)、V-MYC 骨髓細胞瘤病毒癌基因同源物(V-Myc Myelocytomatosis Viral Oncogene Homolog,MYC),這些可認為是參桃軟肝丸治療HCC的靶點互作網絡中的關鍵靶點(圖5)。
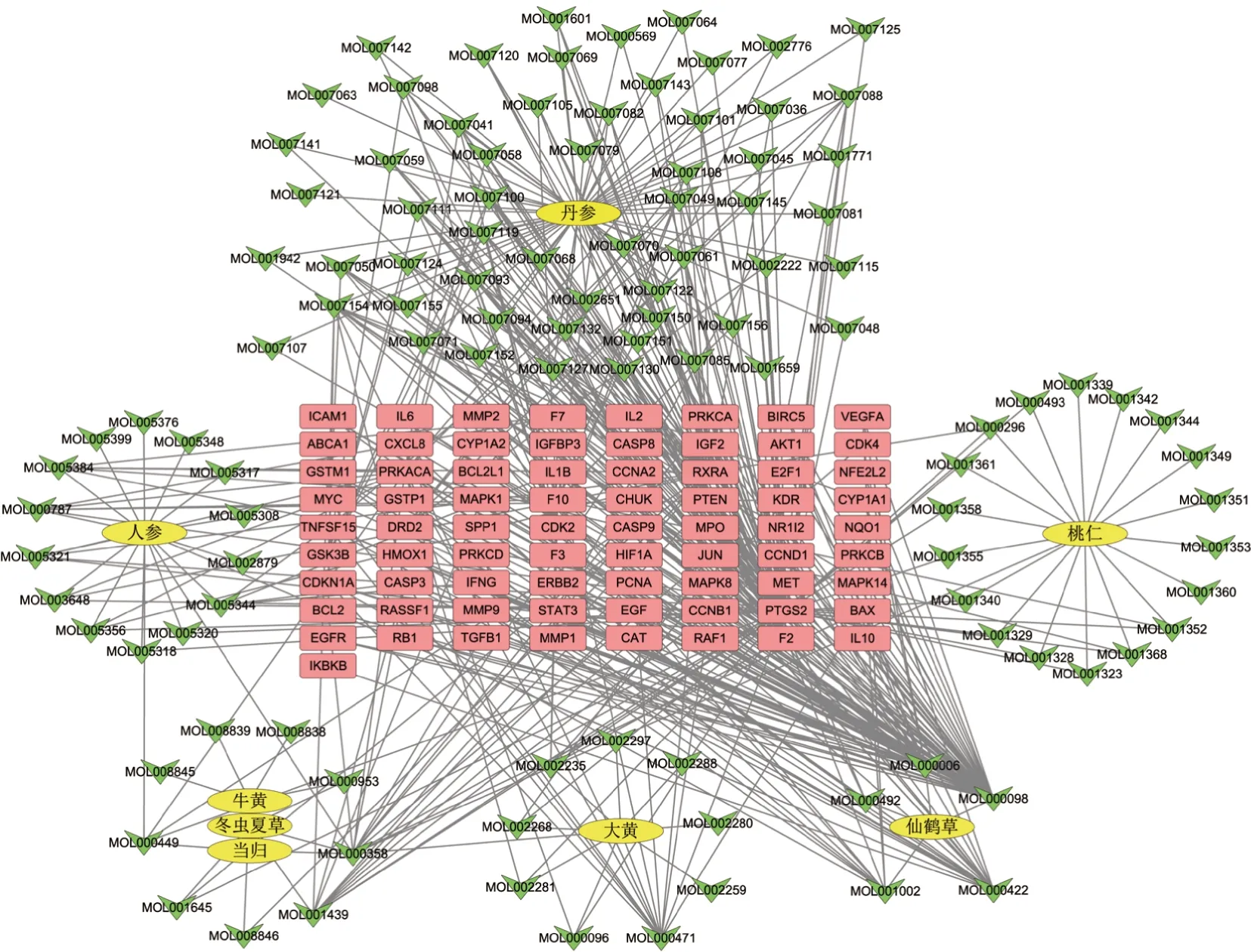
圖2 參桃軟肝丸治療HCC的中藥-活性成分-靶點網絡
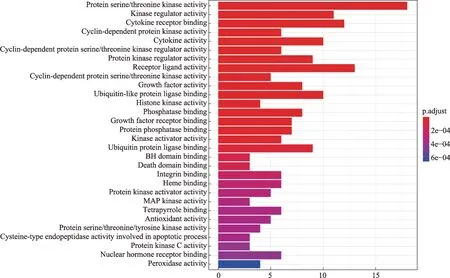
圖3 參桃軟肝丸中治療HCC靶點的GO富集條形圖
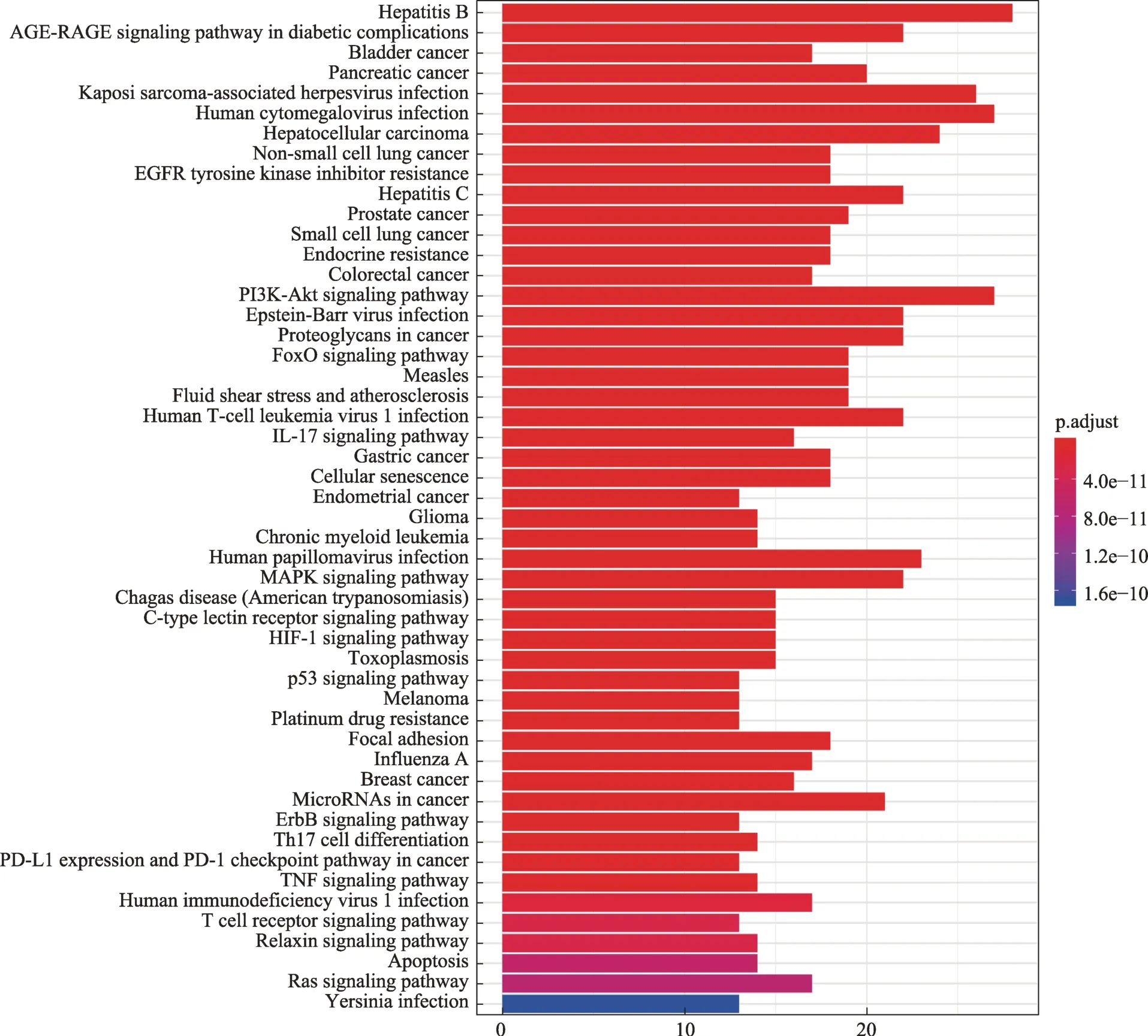
圖4 參桃軟肝丸中治療HCC靶點的KEGG通路富集條形圖
2.7 分子對接
分子對接結果顯示,槲皮素、木犀草素、山奈酚等3 個關鍵成分與AKT1、CASP3、VEGFA、JUN、MYC 等5個關鍵靶點對接的Vina 分值<-7.0 的有13 對,其中Vina 分值<-9.0 有3 對,表明大部分關鍵靶點與關鍵成分的結合能力較強,而AKT1 蛋白與木犀草素相互作用的Vina分值(即結合能)最佳,為-9.80 kcal·mol-1,具體對接結果(圖6)。結合圖7可以看出,木犀草素與AKT1 蛋白之間通過 3 個 π-π 鍵和 1 個氫鍵形成較為穩定結構。
3 討論
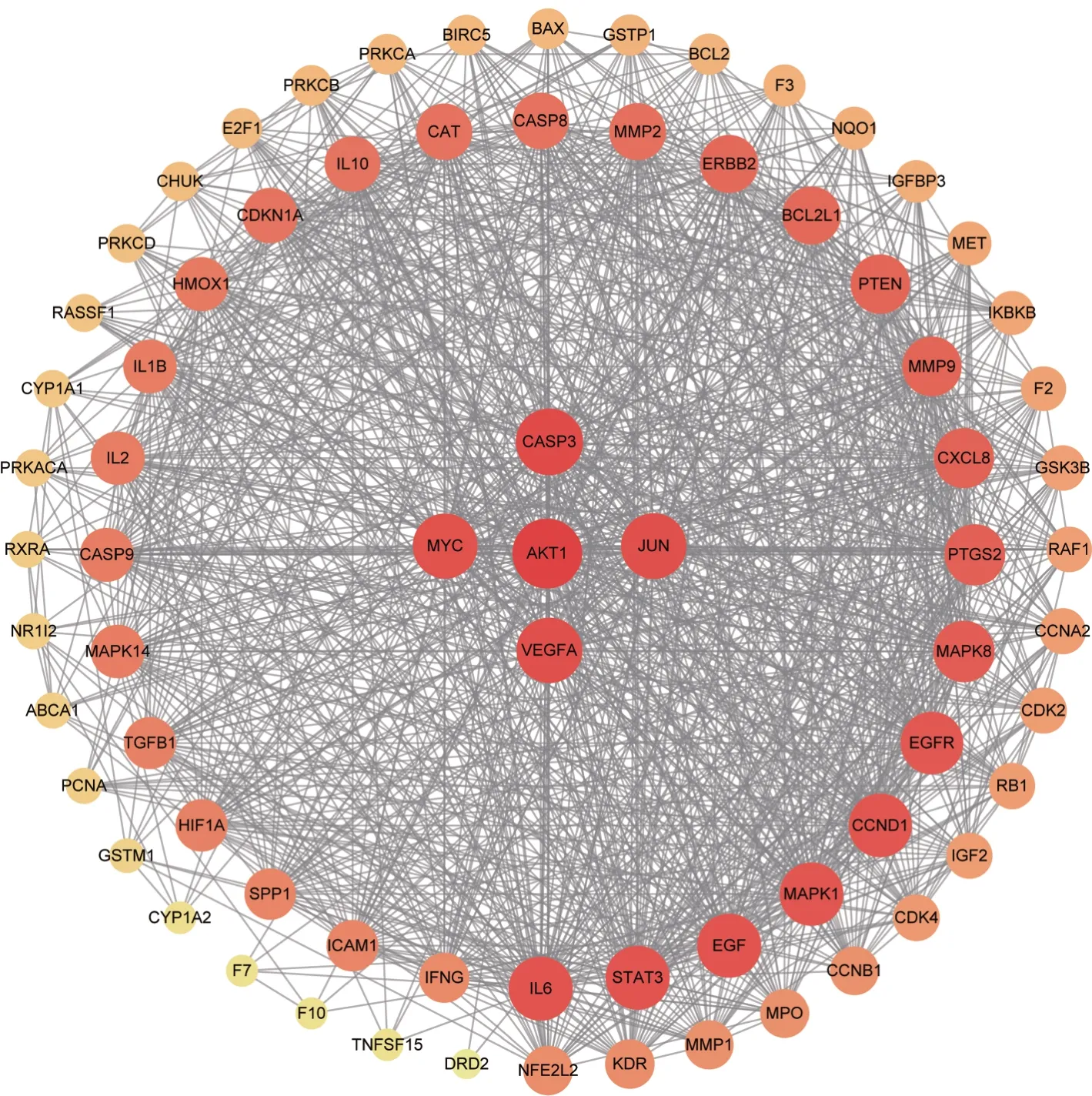
圖5 參桃軟肝丸中治療HCC靶點的互作網絡
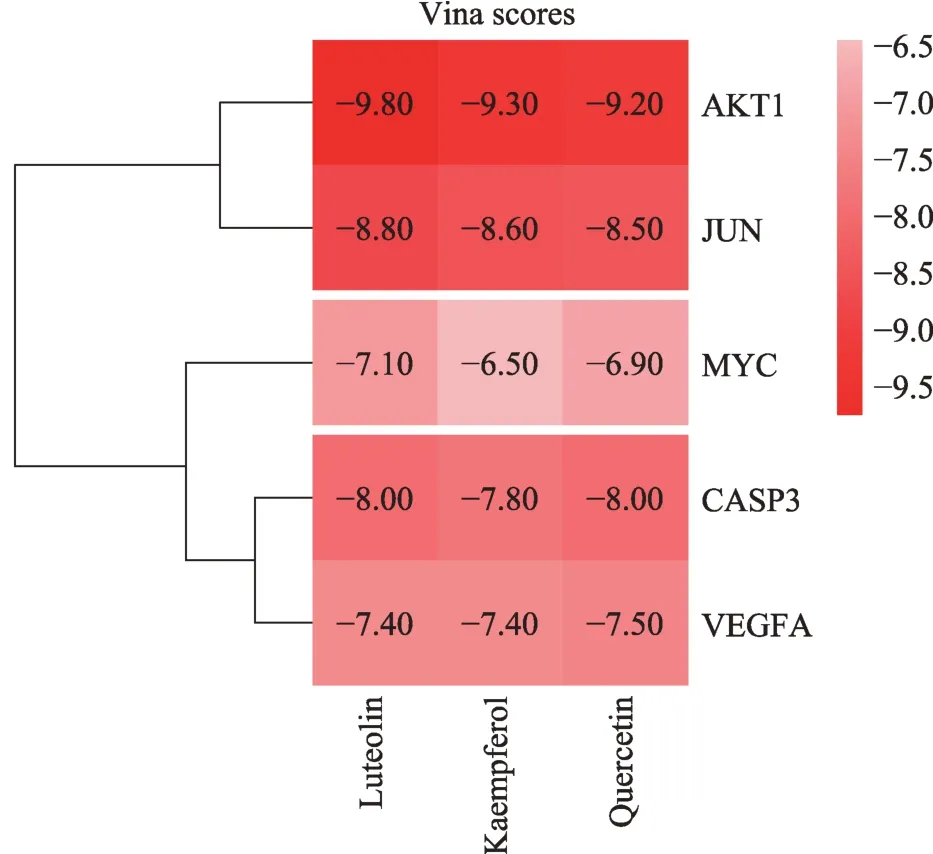
圖6 分子對接結果
本研究采用網絡藥理學方法,構建了中藥-活性成分-靶點網絡,該網絡表明了參桃軟肝丸具有多成分、多靶點綜合作用的特點,其中關鍵成分可能為槲皮素、木犀草素、山奈酚。槲皮素、木犀草素和山奈酚均屬于植物來源類黃酮化合物,藥理研究發現,它們對于HCC 具有抑制增殖、誘導凋亡以及抑制其侵襲、轉移等方面的作用[5-8]。參桃軟肝丸活性成分治療HCC 所調控的靶點互作網絡表明,該網絡的關鍵靶點很可能為AKT1、CASP3、VEGFA、JUN、MYC。GO 分子功能和KEGG 通路分析闡明了參桃軟肝丸多功能、多通路治療HCC 的機制,相關的通路有乙型肝炎、丙型肝炎 、磷脂酰肌醇 3 激酶/蛋白激酶 B(phosphatidylinositol 3-kinase/protein kinase B,PI3K/PKB or PI3K/Akt)信號通路、p53 信號通路、癌癥中微小 RNA(MicroRNAs)、細胞程序性死亡配體 1(programmed cell death ligand 1,PD-L1)表達和細胞程序性死亡蛋白1(programmed cell death protein 1,PD-1)檢查點途徑、細胞凋亡、低氧誘導因子-1(hypoxia inducible factor-1,HIF-1)信號通路 、白介素 -17(interleukin-17,IL-17)信號通路、叉頭框轉錄因子O(Forkhead box O,FoxO)信號通路等。
結合本文網絡藥理學預測結果以及相關文獻回顧,參桃軟肝丸治療HCC 的潛在機制可進一步歸納為以下幾個方面:
3.1 抑制細胞增殖和誘導細胞凋亡
3.1.1 抑制AKT1蛋白激活
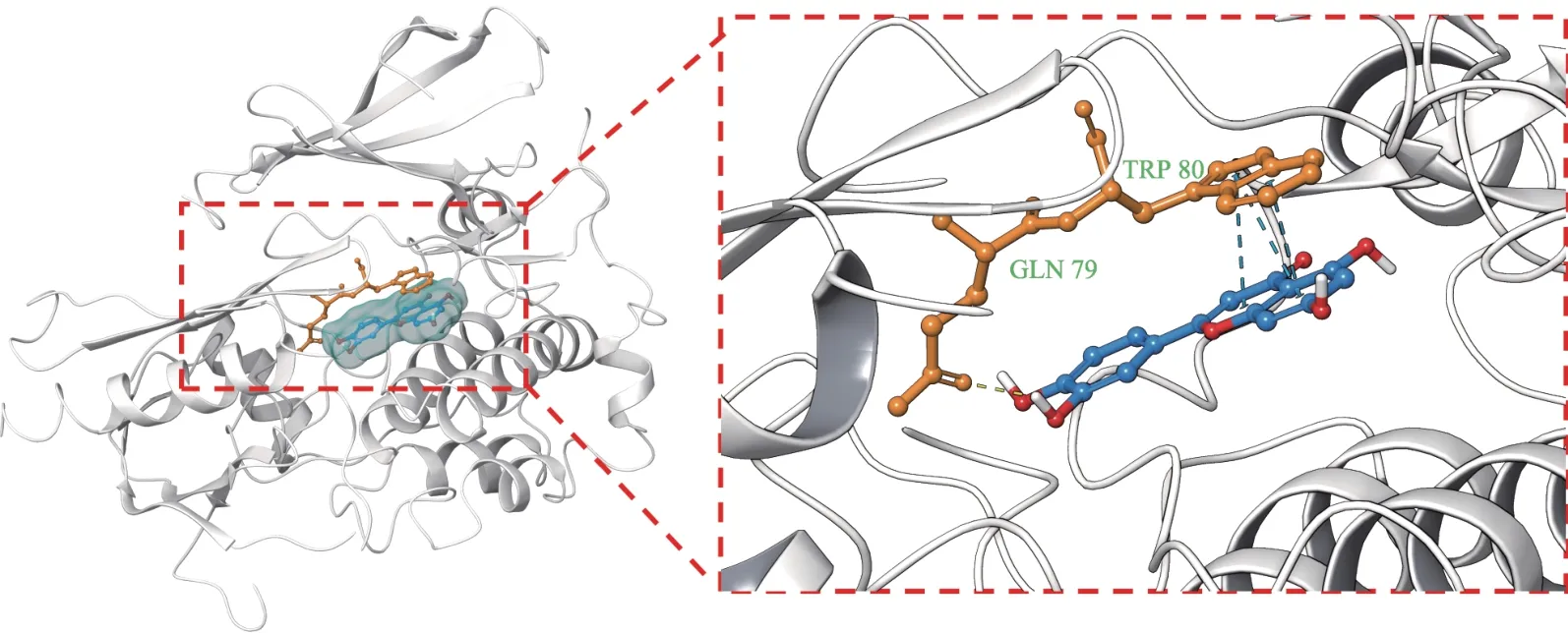
圖7 AKT1蛋白與木犀草素之間相互作用的3D示意圖
AKT1(即AKT)是PI3K/AKT信號通路中重要的下游靶標,屬于絲氨酸/蘇氨酸激酶家族,該家族蛋白參與生長因子、細胞因子等激活下游靶標的細胞信號的轉導[9]。AKT1 可通過抑制細胞凋亡而促使細胞存活[10]。AKT1的異常激活存在于多種癌癥中,可促進癌細胞的代謝、生長、增殖、存活以及血管生成[11]。AKT1的磷酸化激活被認為是HCC 侵襲性和預后不良的危險因素[12]。研究表明,參桃軟肝丸可通過抑制AKT1的磷酸化激活而發揮治療HCC 作用[13]。分子對接結果表明,AKT1 蛋白與槲皮素、木犀草素和山奈酚對接的結合能均小于-9.0 kcal·mol-1,提示 AKT1 蛋白很可能是槲皮素、木犀草素和山奈酚的潛在靶標。目前槲皮素、木犀草素、山奈酚被發現均可抑制人肝癌細胞中AKT 蛋白的磷酸化激活,誘導細胞凋亡以及抑制腫瘤細胞的侵襲[14-16]。因此,參桃軟肝丸治療HCC 的機制之一很可能為槲皮素、木犀草素、山奈酚與AKT1蛋白結合后,抑制了其磷酸化激活,部分阻斷了PI3K/AKT信號通路,從而抑制HCC細胞的增殖。
3.1.2 抑制c-Jun蛋白表達
JUN 是細胞增殖過程中重要的轉錄因子,在HCC中可通過拮抗抑癌基因p53 的活性,協助HCC 細胞逃避細胞凋亡[17]。JUN 蛋白家族包括了 c-Jun、Jun-B 以及Jun-D。體外實驗表明,槲皮素和山奈酚可分別抑制胃癌、前列腺癌細胞[18,19]與肺癌、腎癌細胞[20,21]的c-Jun 蛋白表達而誘導腫瘤細胞凋亡,抑制其增殖和侵襲。
3.1.3 激活CASP3蛋白
CASP3 是細胞凋亡級聯反應中位于下游的半胱氨酸蛋白酶,被激活的CASP3 通過裂解和破壞細胞結構以及斷裂DNA 執行細胞凋亡過程[22]。研究發現,槲皮素、木犀草素及山奈酚可通過多種機制激活CASP3蛋白,進而誘導人肝癌細胞的凋亡[8,23,24]。
3.1.4 抑制Myc蛋白表達
Myc 屬核蛋白類的原癌基因,編碼的轉錄因子與核DNA 結合后促進細胞增殖[25],c-Myc 是該家族的重要成員,多數HCC 存在c-Myc 過表達,其異常激活可促使肝細胞癌的發展[26]。研究發現,槲皮素、木犀草素及山奈酚可降低c-Myc 蛋白水平而促進多種腫瘤細胞凋亡[27-28]。此外,槲皮素被報道能與c-Myc 基因啟動子區域相互作用而形成穩定結構,或為潛在的抗腫瘤候選藥物[29]。
3.1.5 調控miRNA
miRNA 屬于非編碼RNA,可調節基因表達。HCC中常有miRNA的失調,miRNA可通過靶向大量關鍵蛋白的編碼基因,促進HCC 細胞增殖和轉移,同時逃避細胞凋亡[30]。木犀草素目前被發現可調控多種miRNA而發揮抗腫瘤作用[31,32]。
3.2 抑制肝炎病毒基因表達
乙型肝炎、丙型肝炎以及肝硬化是肝癌發展的主要危險因素[33],其中引起乙型肝炎和丙型肝炎的乙型肝炎病毒(hepatitis B virus,HBV)和丙型肝炎病毒(hepatitis C virus,HCV)同時也是引起HCC 的重要致癌因素。在全球范圍內,78%的HCC 歸因于HBV(53%)或HCV(25%)[34]。KEGG 結果表明,參桃軟肝丸治療HCC 的靶點的通路富集結果包括了乙型肝炎和丙型肝炎。研究發現,乙型肝炎病毒X 基因(Hepatitis B Virus X gene,HBx)是HBV 上最小的開放讀碼框,可影響HBV 的復制以及導致肝癌的發生和發展[35],參桃軟肝丸在HBV 相關的HCC 患者中可通過促進HBx 啟動子的甲基化抑制HBx的表達,從而發揮抑瘤功效[36]。
3.3 抑制腫瘤新生血管生成
在缺氧情況下,HCC 組織中上調的HIF-1 會誘使VEGF 產生,而VEGF 是促進HCC 新生血管生成的主要因素[37]。研究表明,參桃軟肝丸治療HCC 的作用機制之一是通過抑制肝癌組織VEGF 的表達,減少腫瘤新生血管的生成,延緩腫瘤的侵襲、轉移[4,13]。
綜上,本研究初步表明,參桃軟肝丸具有多成分、多靶點和多通路治療HCC 的作用模式,其潛在機制涉及了抑制細胞增殖和誘導細胞凋亡、抑制肝炎病毒基因表達和抑制腫瘤新生血管生成等方面,目前仍有部分通路和機制尚未得到實驗驗證,但這可為今后闡明參桃軟肝丸治療HCC 的具體機制提供思路,也可為參桃軟肝丸臨床治療HCC提供更多依據。同時,槲皮素、木犀草素和山奈酚與AKT 蛋白均有較好的親和性,這可為篩選新型治療HCC的靶向藥物提供一定參考。

