胃腸胰神經內分泌瘤超聲內鏡下特點及診療
陶文鵬,郭長青,曹新廣,張芳賓,李冠華,劉虹彥,王文佳,段義龍
鄭州大學第一附屬醫院消化內科 鄭州 450052
神經內分泌腫瘤(neuroendocrine tumors,NETs)是起源于神經內分泌細胞的腫瘤;神經內分泌細胞是機體內具有神經內分泌表型,可以產生多種激素的一大類細胞[1]。神經內分泌細胞遍布全身各處,因此NETs可以發生在體內任何部位,但最常見的是胃、腸、胰腺等消化系統臟器[2],約占所有NETs的2/3。胃腸胰神經內分泌腫瘤(gastroenteropancreatic neuroendocrine tumors,GEP-NETs)雖然具有共同的病理特征,但由于解剖部位及腫瘤類型的不同,臨床表現千差萬別,其術前確診困難,極易被誤診。因此,加強對GEP-NETs的認識顯得尤為重要。近年來,隨著人們對GEP-NETs認識和診療手段的提高,尤其隨著超聲內鏡(endoscopic ultrasonography,EUS)及超聲內鏡引導下細針穿刺吸取術(endoscopic ultrasonography guided fine needle aspiration,EUS-FNA)等多種診療技術的發展[3],GEP-NETs的確診率在過去30年內增加了5倍[4]。有研究[5]報道,一旦腫瘤出現分化,發生遠處轉移,GEP-NETs患者的5 a生存率明顯降低,因此其早期診斷顯得尤為重要。本研究通過對198例GEP-NETs患者的臨床資料、EUS特點及EUS指導下的內鏡治療及手術治療的情況進行回顧性總結,旨在探討EUS在GEP-NETs診治過程中的應用價值。
1 對象與方法
1.1臨床資料回顧性分析2017年5月至2019年5月鄭州大學第一附屬醫院消化內科確診為GEP-NETs 198例患者的信息。所有病例根據2019年第5版WHO NETs命名及分類標準分為G1(核分裂數<2/10HPF、Ki-67增殖指數≤2%)、G2(核分裂數2~20/10HPF、Ki-67增殖指數3%~20%)、G3(核分裂數>20/10HPF、Ki-67增殖指數>20%)和混合型腺神經內分泌癌[6](每種成分不少于30%)。據此,GEP-NETs被分類為神經內分泌瘤(NET G1和G2)、神經內分泌癌(NEC G3)和混合型腺神經內分泌癌(該研究中未見此型)。
1.2診治方法采用EUS及EUS-FNA觀察病灶的聲像圖特征,包括其部位、形態、大小、起源層次、邊界等,獲得病灶處組織并行病理學診斷,探及病灶是否存在肌層及周圍血管和淋巴結浸潤,根據病灶分期分級選擇EUS指導下內鏡治療、手術治療、藥物治療及放化療。
2 結果
2.1GEP-NETs患者性別、發病部位及分級見表1。
2.2患者EUS下病灶的特征表現見圖1。198例患者中,EUS下病灶直徑<1 cm、1~2 cm及>2 cm的分別有68例、72例和58例。其中,胃腸神經內分泌瘤(gastrointestinal neuroendocrine tumors,GI-NETs)共161例,其EUS下表現見表2;胰腺神經內分泌瘤(pancreatic neuroendocrine tumors, p-NETs)
EUS下病灶直徑<1 cm、1~2 cm及>2 cm的分別有21例、8例和8例,因其解剖結構特殊性,其EUS下形態層次與GI-NETs差異較大,多結合其他影像學及EUS-FNA取得病理學結果后得以診斷,在此處不計入表2中描述。
表1 198例GEP-NETs患者性別、發病部位及分級例
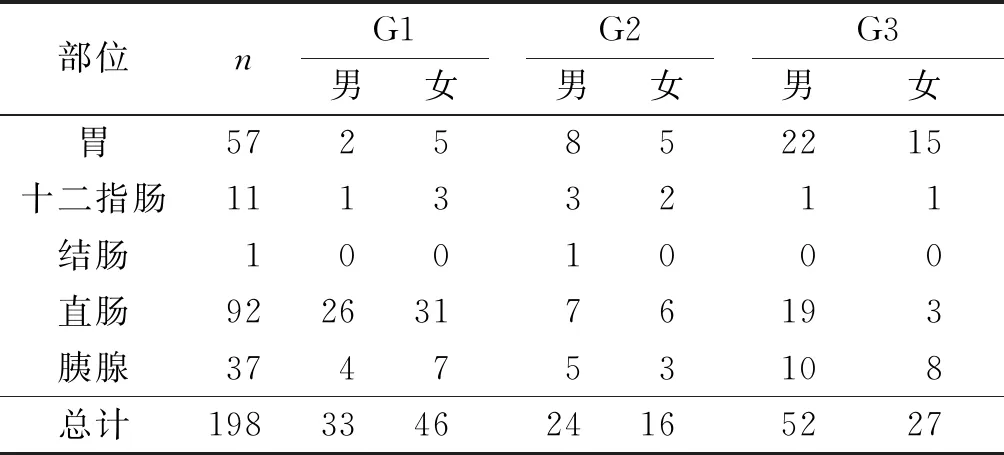
部位nG1男女G2男女G3男女胃5725852215十二指腸11133211結腸1001000直腸92263176193胰腺374753108總計198334624165227
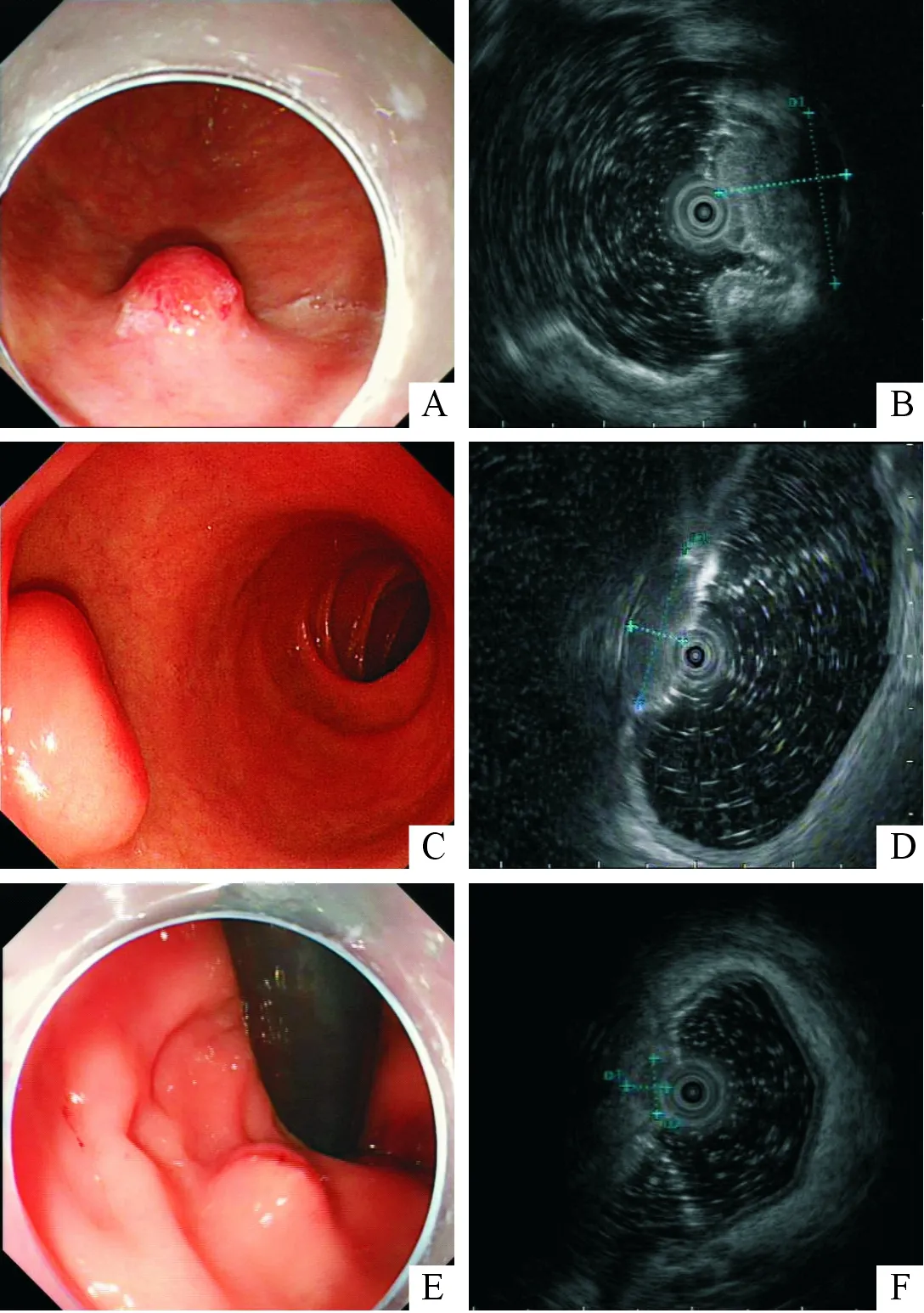
A:胃底NET(G2期)內鏡圖;B:胃底NET(G2期)超聲內鏡,全層病變,低回聲,邊界不清;C:十二指腸球部NET (G2期)內鏡圖;D:十二指腸球部NET (G2期)超聲內鏡圖,黏膜下層,偏高回聲,回聲欠均勻;E:直腸NET(G1期)內鏡圖;F:直腸NET(G1期)超聲內鏡圖,固有肌層,低回聲,回聲均勻
圖1胃腸胰神經內分泌瘤內鏡及超聲內鏡圖
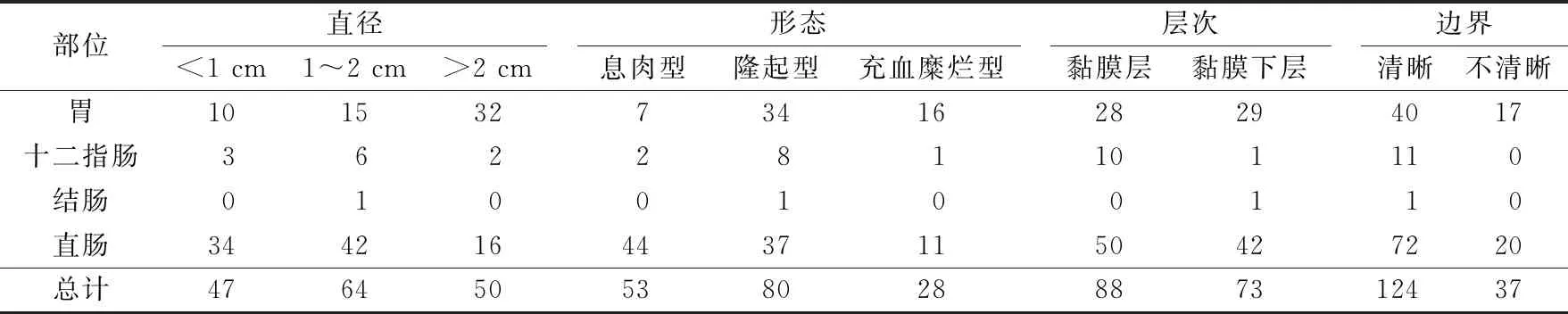
表2 162例GI-NETs患者超聲內鏡下表現 例
2.3EUS下評估病灶侵犯情況及治療方案198例患者中共有37例p-NETs患者,由于病灶侵犯范圍多累計周圍淋巴結及遠端臟器,因此較難利用EUS對其進行病灶侵犯情況的評估及進行內鏡下治療。對于p-NETs患者,多為因其并發癥而偶然發現,發現時大多已伴有周圍組織臟器侵及,共26(70.3%)例;對未侵及的11例患者來說,手術是其主要治療手段,該研究中有9例選擇根治性手術,2例選擇藥物治療。對侵及的患者來說,根治性手術效果雖然較差,但仍可減輕癥狀(共3例);余多采用介入栓塞手術、藥物治療和放化療治療(分別為20例、2例和1例)。在余下的161例GI-NETs患者中,未侵及的患者多采用內鏡下治療,僅有4(3.8%)例腫物直徑較大的患者采用根治性手術治療、1例要求藥物治療;而在存在周圍組織臟器侵及的患者中,有部分患者選擇內鏡下治療,大多數患者選擇根治性手術治療或行介入栓塞化療,少數患者選擇放化療或生長抑素類似物、多肽受體放射性核素等藥物保守治療(此類患者惡性程度較高,預后較差)。詳見表3。

表3 EUS下評估GI-NETs患者病灶侵犯情況及治療方案選擇 例
3 討論
GEP-NETs是一組神經內分泌表型腫瘤,常分布于胃腸道,也可見于全身多處器官,分為功能性和非功能性。對于GEP-NETs而言,其功能性腫瘤通常為有顯著癥狀的胃泌素瘤或胰島素瘤等,而非功能性腫瘤經常會是偶然發現或癥狀相關腫瘤及其轉移的結果[7]。近年來,NETs的確診率有所上升,這通常被認為是由于檢測方法的改進所導致[8]。
本文回顧性分析在鄭州大學第一附屬醫院確診為NETs患者的EUS表現及治療方法等特點,旨在幫助其診斷及治療方式的選擇。本研究中共有男性患者109(55.1%)例,女性患者89(44.9%)例,其性別差異可能與機體激素代謝水平及生活方式有關[9]。其中,發病率最高的部位是直腸,其次為胃,再次是胰腺、十二指腸,結腸均只發生1例,這與Dasari等[4]的關于GEP-NETs大規模研究結果相符。
隨著內窺鏡檢查技術的進展,胃、十二指腸和直腸中的GI-NETs在內窺鏡檢查中偶然檢出的頻率越來越高[10],包括EUS-FNA對胰腺NETs的診斷,EUS內鏡探頭可進入體腔對胰腺進行近距離探查,在胰腺占位性病變評估方面具有較高的準確性,特別適合于胰腺微小病變的識別,可以檢測到小至2~5 mm的病變[11]。EUS尤其能夠定位胃泌素瘤和胰島素瘤,其對胰頭部的靈敏度較高,胰尾部的靈敏度較低[12]。在198例病例中,直腸NETs在EUS下大多表現為息肉型或隆起型,其中62.0%為G1級,82.6%的腫瘤直徑小于2 cm,且大多不伴有淋巴結轉移。而對于胃NETs,有64.9%為G3級,有56.1%的腫瘤直徑大于2 cm。由此看出,直腸NETs大多為低度惡性腫瘤,而胃NETs可見潛在惡性或轉移可能[13]。多項研究表明,腫瘤是否存在周圍臟器侵犯及淋巴結轉移與瘤體大小密切相關,隨著瘤體增大,其轉移率不斷增高,直徑小于1 cm的GEP-NETs很少發生臟器侵犯和轉移(<5%),而直徑大于2 cm的GEP-NETs時常伴有臟器侵犯(45%)和淋巴結轉移(64%)[14]。隨著內鏡治療技術(EMR、ESD、EFTR)的不斷發展與完善,GI-NETs的治療也趨向于多元化選擇,但盲目的內鏡下腫瘤切除不能保證病灶切除完整性,因此,在內鏡下切除前,內鏡醫生經常進行EUS分期以確定內鏡切除的可行性,尤其是在GI-NETs的治療上體現的更為明顯[15]。
內鏡下治療,本研究主要指內鏡下黏膜下剝離術(endoscopic submucosal dissection,ESD),其被認為是早期消化道腫瘤內鏡治療的一種方法,同時也被認為是GI-NETs內鏡下切除的主要方式。研究[16]表明,在GI-NETs中,EUS對病灶深度的評估趨近于100%準確,而對于內鏡下合適的切除對象,有過9成的病灶能夠完全切除。雖然ESD在技術上比EMR更難實施,但其可以提供一個更完整的治療,該手術所增加的實際效用還需在進一步的研究中進行評估。對于本研究中的GI-NETs而言,共有114例(70.8%)患者選擇了內鏡下治療,其中大部分為未侵及周圍組織臟器病例,而在21例根治性手術患者中,有81.0%存在侵犯及轉移,而對于此類患者,因其手術治療創傷大、預后差、復發風險高,手術收益有限,建議其配合藥物(生長抑素類似物、多肽受體放射性核素等)治療或放化療輔助治療[17-19]。總的來說,在內鏡下治療前對病灶進行EUS檢查以評估,對于其術前分期及治療方式選擇,是十分必要且不可或缺的[20]。
綜上所述,隨著超聲內鏡的普及,GEP-NETs的診斷和治療逐漸成熟,同時,EUS是對GEP-NETs具有極高價值的檢查手段,其治療方案有賴于術前EUS的評估判斷,識別GEP-NETs在其下的特征性表現,對于治療方案的選擇尤為重要。
總之,EUS是評估和治療GEP-NETs的有效工具,進一步發展EUS并聯合其他影像學檢查,對其局限性進行改善,將有利于提高GEP-NETs的規范化診療與個體化治療水平,改善患者預后生活質量。

