組蛋白去乙酰化酶3對恒定型自然殺傷性T細胞發育和功能的調控作用
鄭全輝,雷 冰,袁鴻儒,馬劍楠,劉兆基,張 郡,劉倚博,張 冰,張愛紅,鄭愛華,張 穎,李會婷,田 楓
(1.河北省慢性疾病重點實驗室 河北省唐山市慢性病基礎研究重點實驗室 華北理工大學基礎醫學院免疫學系,河北 唐山 063210; 2.河北醫科大學第三醫院骨外科,河北 石家莊 050051; 3.河北省唐山市工人醫院ICU,河北 唐山 063000; 4.北京大學醫學部實驗動物科學部,北京 100191)
恒定型自然殺傷性T細胞(invarient nature killer T cells, iNKT)產生于胸腺, 是一群既表達有限T細胞受體α鏈和β鏈,同時也表達NK細胞受體(NK1.1)的固有淋巴細胞亞群[1]。根據其細胞表面分子CD44和NK1.1的表達差異,iNKT在胸腺的發育和成熟可分為3個階段:最初階段非成熟iNKT細胞表現為CD44-NK1.1-;隨iNKT細胞成熟程度的增加,CD44表達首先增加,表現為CD44+NK1.1-;成熟階段iNKT細胞NK1.1表達明顯增加,表現為CD44+NK1.1+[2]。由于iNKT細胞在活化后能夠產生大量Th1和Th2型細胞因子,如干擾素γ(interferon-γ,IFN-γ)和白細胞介素4(interleukin-4, IL-4)等,因此在感染和腫瘤等多種疾病中發揮作用[3-5]。已有研究[6-9]發現:組蛋白去乙酰化酶3(histone deacetylase 3, HDAC3)在傳統T細胞、B細胞、巨噬細胞和樹突狀細胞的發育和功能調控中發揮促進或抑制作用,而HDAC3對iNKT細胞發育和功能的影響目前尚不完全清楚。本研究采用T細胞特異的hdac3基因敲除小鼠,探討HDAC3對iNKT細胞發育和功能的影響。
1 材料與方法
1.1 實驗動物、主要試劑和儀器C57BL/6背景的hdac3floxP轉基因小鼠(Stock No:024119)和CD4啟動子/增強子/沉默子-Cre轉基因小鼠(Stock No:022071)購自美國Jackson實驗室,并在華北理工大學SPF級小鼠房飼養、繁殖,動物合格證號:SCSK(京)2014-0004。hdac3floxP小鼠和CD4啟動子/增強子/沉默子-Cre小鼠交配、繁殖子代后經細胞基因組PCR檢測鑒定可獲得T細胞特異的hdac3基因敲除小鼠(hdac3floxP+CD4Cre+,HDAC3KO),將hdac3基因正常小鼠作為野生型正常對照(hdac3floxP+CD4Cre-,WT)。實驗選取4~8周齡及性別匹配的HDAC3KO和WT小鼠進行研究。實驗操作按華北理工大學實驗動物管理委員會規定進行。細胞DNA提取試劑盒購自天根生物科技(北京)有限公司,熒光素標記的抗小鼠TCRβ(H57-597)、NK1.1(PK136)、CD44(IM7), CD122(5H4)、CD69 (H1.2F3)、DX5(HMα2)、CD4(RM4-5)、CD8(53-6.7)、IL-4(11B11)、IFN-γ(XMG1.2)、生物素標記抗小鼠CD3(17A2)抗體及淋巴細胞固定/打孔試劑盒購自美國BD或eBioscience公司,抗生物素磁珠購自德國美天旎生物技術有限公司,半乳糖神經酰胺(α-Galcer)及熒光素標記的CD1d-α-Galcer四聚體購自日本麒麟公司,大鼠抗小鼠FcR單克隆抗體(2.4G2)取自2.4G2雜交瘤細胞培養上清,RPMI1640培養液、胎牛血清、HEPES、青-鏈霉素、谷氨酰胺、莫能菌素、紅細胞裂解液及小鼠IFN-γ和IL-4 ELISA檢測試劑盒購自北京達科為生物技術公司,引物由生工生物工程(上海)股份有限公司合成。低溫冷凍離心機購自德國Beckan公司,FACSAria Ⅱ流式細胞儀購自美國BD公司。
1.2 小鼠基因型鑒定采用FACSAriaⅡ流式細胞儀分別分選HDAC3KO和WT小鼠胸腺CD4+CD8+雙陽性T細胞(DP)、CD4單陽性T細胞(CD4SP)、CD8單陽性T細胞(CD8SP)以及脾臟CD4+T細胞(CD4)和CD8+T細胞(CD8)。各取1×106個細胞,按試劑盒操作說明書提取DNA并進行PCR擴增。所用上游引物:5′-CCCAGGTTAGCTTTGAACTCT-3′,下游引物:5′-CCACTGGCTTCTCCTAAGTTC-3′。HDAC3KO小鼠PCR擴增生成211 bp DNA片段,WT小鼠PCR擴增生成935 bp DNA片段。
1.3 流式細胞術分析HDAC3KO小鼠iNKT 細胞數量和發育表型分別分離HDAC3KO和WT小鼠(每組3~5只)胸腺、脾、肝臟和淋巴結并制成單細胞懸液,采用含2%胎牛血清的PBS染色緩沖液洗滌2次,加入2.4G2封閉,4℃孵育30 min。然后直接加入10 μL (1∶10~1∶100稀釋)熒光素標記的單克隆抗體,4℃避光孵育30 min,用PBS染色緩沖液洗滌2次,采用FACSAriaⅡ流式細胞儀收集標本,采用FlowJo software或CELLQuest Pro(BD Biosciences) 軟件進行數據分析。實驗至少重復3次。
1.4 骨髓混合嵌合體小鼠制備采用6~8周齡CD45.1+的B6.SJL小鼠作為受體,以劑量為900 Gy的γ射線照射殺死受體鼠骨髓細胞。在無菌條件下分別提取周齡和性別相同B6.SJL和CD45.2+的HDAC3KO小鼠(每組每種小鼠各取4~6只)骨髓細胞,裂解紅細胞后采用生物素標記抗CD3抗體和抗生物素磁珠分選、剔除骨髓中存在的成熟CD3+T細胞。采用無菌PBS緩沖液洗滌并重懸剩余B6.SJL和HDAC3KO骨髓細胞,調整細胞濃度為1×107mL-1。 按1∶1比例混合后經尾靜脈注射γ射線照射的B6.SJL小鼠(每只100 μL)。細胞注射8周后采用流式細胞術檢測不同骨髓來源iNKT細胞在受體B6.SJL小鼠胸腺的產生和發育情況。實驗重復3次。
1.5 iNKT細胞活化和細胞內染色分析將α-Galcer用二甲基亞砜溶解,濃度為100 mg·L-1,取2 μg α-Galcer溶于100 μL無菌PBS中,經尾靜脈分別注入HDAC3KO和WT小鼠(每組每種小鼠各取3~5只)體內。4 h后分離小鼠脾細胞,紅細胞裂解液處理去除紅細胞后每種樣本各取2×106個細胞重懸于RPMI 1640培養液(含10%胎牛血清、2 mmol·L-1谷氨酰胺和10 mmol·L-1HEPES),同時加入GolgiStop(1 mg·L-1),于37℃、5%CO2條件下培養2 h。收集培養細胞首先經細胞表面染色,然后經冷PBS洗滌后用新鮮配置的固定/打孔液重懸細胞,加入2.4G2,4℃封閉10 min,直接加入抗小鼠IFN-γ和IL-4抗體進行細胞內染色,4℃避光孵育30 min,用固定/打孔液洗滌細胞2次,流式細胞儀分析iNKT細胞內IFN-γ和IL-4水平。實驗至少重復3次。
1.6 酶聯免疫吸附實驗(ELISA) 檢測HDAC3KO小鼠血清細胞因子水平采用結合緩沖液(0.1 mol·L-1Na2HPO4,pH 9.0)稀釋抗小鼠IFN-γ和IL-4抗體至2 mg·L-1,按每孔100 μL加入至相應ELISA板,4℃包被過夜。移除包被液,加入封閉緩沖液(1% BSA),每孔200 μL,室溫孵育2 h,采用PBS/Tween20洗滌3次后加入1∶50稀釋α-Galcer處理的HDAC3KO和WT小鼠(每種小鼠各取3~5只)血清以及倍比稀釋的標準血清,每孔100 μL,室溫孵育4 h。采用PBS/Tween20洗滌3次后加入底物顯色,在450 nm處測量吸光度(A)值,并根據標準曲線計算血清中IFN-γ和IL-4水平(μg·L-1)。實驗至少重復3次。
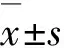
2 結 果
2.1 HDAC3敲除小鼠基因型鑒定對流式細胞術分選的HDAC3KO和WT小鼠胸腺和脾臟T細胞亞群進行基因型鑒定,來自WT小鼠的胸腺DP和CD4SP細胞產生935 bp的 DNA 片段, 而來自HDAC3KO小鼠的胸腺DP、CD4SP、CD8SP細胞和脾臟CD4、CD8 T細胞均產生211 bp 的DNA 片段,說明HDAC3KO小鼠基因型鑒定正確。見圖1。

圖1 PCR技術鑒定HDAC3KO和WT小鼠胸腺和脾臟T細胞亞群基因型
Fig.1 Identification of genetypes of T cell subtypes of HDAC3KO and WT mice by PCR
2.2 HDAC3敲除小鼠胸腺、脾臟、肝臟和淋巴結中iNKT細胞數量采用抗TCR-β抗體和荷載糖脂抗原α-Galcer的CD1d四聚體(CD1d-Tetramer)染色,流式細胞術分析各組織器官中iNKT細胞比例和數量。結果顯示:與WT小鼠比較,HDAC3KO小鼠胸腺、脾臟、肝臟和淋巴結中iNKT細胞比例和數量均明顯降低(P<0.05)。見圖2、表1和表2。

圖2 流式細胞術檢測HDAC3KO和WT小鼠胸腺、脾臟、肝臟和淋巴結中iNKT細胞水平
2.3 HDAC3敲除小鼠胸腺中iNKT細胞發育的變化采用抗CD44、NK1.1、 CD122、CD69和DX5抗體染色,流式細胞術檢測iNKT細胞發育表型的結果顯示:與WT小鼠比較,HDAC3KO小鼠處于非成熟階段CD44-NK1.1-和CD44+NK1.1-iNKT細胞比例明顯增加(P<0.05),而成熟階段CD44+NK1.1+細胞比例明顯降低(P<0.05)。見圖3和圖4。與WT小鼠比較,HDAC3KO小鼠iNKT細胞中CD122、CD69和DX5表達水平明顯降低(P<0.05)。見圖5和圖6。
表1 HDAC3KO和WT小鼠胸腺、脾臟、肝臟和淋巴結中iNKT細胞比例


GroupRatio of iNKT cellsThymusSpleenLiverLymph nodesWTmice0.28±0.081.07±0.5514.92±6.380.14±0.04HDAC3KOmice 0.02±0.01?0.01±0.01?0.08±0.04?0.01±0.01?
*P<0.05 compared with WT mice.
表2 HDAC3KO和WT小鼠胸腺、脾臟、肝臟和淋巴結中iNKT細胞數量


GroupNumber of iNKT cellsThymus(×105)Spleen(×105)Liver(×104) Lymph nodes(×104)WT mice3.79±1.0611.98±4.8824.25±10.371.16±0.28HDAC3KO mice0.21±0.06?0.15±0.07?0.22±0.10?0.06±0.04?
*P<0.05 compared with WT mice.

圖3 流式細胞術檢測HDAC3KO和WT小鼠胸腺iNKT細胞中CD44和NK1.1的表達
Fig.3 Expressions of CD44 and NK1.1 in thymus iNKT cells of HDAC3KO and WT mice detected by flow cytometry

*P<0.05 compared with WT mice.
圖4 HDAC3KO和WT小鼠胸腺不同發育階段iNKT細胞比例
Fig.4 Ratios of iNKT cells in thymus in different development stages of WT and HDAC3KO mice

圖5 流式細胞術檢測HDAC3KO和WT小鼠胸腺iNKT細胞中CD122、CD69和DX5表達
Fig.5 Expressions of CD122,CD69 and DX5 in thymus iNKT cells of HDAC3KO and WT mice
2.4 HDAC3通過內源性途徑對iNKT細胞發育和成熟的調控作用流式細胞術檢測HDAC3KO小鼠DP細胞中CD1d表達結果顯示:與WT小鼠比較,HDAC3KO小鼠DP細胞中CD1d表達無明顯變化。見圖7。采用骨髓混合嵌合體方法檢測受者小鼠胸腺iNKT細胞的產生和發育結果顯示:與來源于正常小鼠的骨髓細胞比較,來源于HDAC3KO小鼠的骨髓細胞產生的iNKT細胞數量明顯減少(P<0.05)。發育表型檢測結果顯示:與來源于正常小鼠的骨髓細胞比較,來源于HDAC3KO小鼠骨髓的iNKT細胞主要表現為非成熟CD44-NK1.1-和CD44+NK1.1-表型,而成熟CD44+NK1.1+表型細胞比例明顯降低(P<0.05)。見圖8~11。
2.5 HDAC3敲除小鼠iNKT細胞和血清中IFN-γ和IL-4水平細胞內染色結果顯示:α-Galcer體內刺激4 h后,與WT小鼠比較,HDAC3KO小鼠iNKT細胞中IFN-γ和IL-4水平明顯降低(P<0.05)。見圖12和圖13。ELISA法檢測顯示:與WT小鼠比較,HDAC3KO小鼠血清中IFN-γ和IL-4水平明顯降低(P<0.05)。見圖14。

*P<0.05 compared with WT mice.
圖6 HDAC3KO小鼠胸腺iNKT細胞中CD122、CD69和DX5表達水平
Fig.6 Expression levels of CD122, CD69 and DX5 in thymus iNKT cells of HDAC3KO mice

圖7 流式細胞術檢測HDAC3KO和WT小鼠DP細胞中CD1d的表達

圖8 流式細胞術檢測來源于HDAC3KO和B6.SJL小鼠骨髓細胞的iNKT細胞的產生
Fig.8 Production of iNKT cells from bone marrow cells of HDAC3KO and B6.SJL mice detected by flow cytometry
3 討 論
本研究結果顯示: HDAC3對于iNKT細胞的發育和細胞因子的產生發揮關鍵作用。HDAC3敲除導致中樞和外周免疫器官中iNKT細胞數量明顯減少,iNKT細胞在胸腺的發育受阻,同時iNKT細胞因子水平也明顯降低。

*P<0.05 compared with B6.SJL mice.
圖9 來源于HDAC3KO和B6.SJL小鼠骨髓細胞的iNKT細胞比例
Fig.9 Ratios of iNKT cells from bone marrow cells of HDAC3KO and B6.SJL mice
本文作者以往研究[10]顯示:CD4Cre酶介導的HDAC3敲除不影響傳統T細胞在胸腺的發育和成熟,但導致外周CD4+T細胞和CD8+T細胞出現活化誘導的細胞凋亡,表現為細胞核DNA復制加快但同時伴隨著細胞凋亡的明顯增加。另外,增殖能力旺盛的造血干細胞缺失HDAC3引起多能淋巴祖細胞凋亡增加,淋巴細胞生成明顯減少[11]。鑒于HDAC3在T淋巴細胞活化增殖中的重要性,HDAC3已被作為靶點用于T細胞淋巴瘤的臨床治療[12]。另外,iNKT細胞由胸腺DP細胞識別鄰近細胞CD1d提呈的糖脂類抗原后經陽性選擇產生,在其發育和成熟過程中,iNKT細胞中CD44和CD69等T細胞活化分子表達水平明顯升高,增殖活性也明顯增強。本研究結果顯示:HDAC3敲除主要導致CD44+NK1.1+成熟iNKT細胞比例明顯降低,而非成熟CD44-NK1.1-和CD44+NK1.1-iNKT細胞比例升高,提示T細胞活化增殖越明顯,其活性對HDAC3的依賴性越強。另外,THAPA等[13]采用PLZFCre酶介導的基因敲除方法,在iNKT細胞發生陽性選擇后敲除HDAC3,也觀察到iNKT細胞數量在胸腺、脾臟和肝臟中明顯減少。然而,CD4Cre酶介導的hdac3基因敲除導致iNKT細胞數量在胸腺和外周免疫器官中明顯降低,表明HDAC3對于iNKT細胞的陽性選擇以及整個發育和成熟過程必不可少。

圖10 流式細胞術檢測來源于HDAC3KO和B6.SJL小鼠骨髓細胞的iNKT細胞中CD44和NK1.1的表達
Fig.10 Expressions of CD44 and NK1.1 in iNKT cells from bone marrow cells of HDAC3KO and B6.SJL mice detected by flow cytometry

*P<0.05 compared with B6.SJL mice.
圖11 來源于HDAC3KO和B6.SJL小鼠骨髓細胞的不同表型iNKT細胞比例
Fig.11 Ratios of iNKT cells with different phenotypes from bone marrow cells of HDAC3KO and B6.SJL mice

圖12 細胞內染色檢測HDAC3KO和WT小鼠iNKT細胞中IFN-γ和IL-4表達
Fig.12 Expressions of IFN-γ and IL-4 in iNKT cells of HDAC3KO and WT mice detected by intracellular staining

*P<0.05 compared with WT mice.
圖13 HDAC3KO和WT小鼠iNKT細胞中IFN-γ和IL-4表達水平
Fig.13 Expression levels of IFN-γ and IL-4 in iNKT cells of HDAC3KO and WT mice

*P<0.05 compared with WT mice.
圖14 ELISA法檢測HDAC3KO和WT小鼠血清中IFN-γ和IL-4表達水平
Fig.14 Expression levels of IFN-γ and IL-4 in serum of HDAC3KO and WT mice detected by ELISA method
iNKT細胞在胸腺的產生和發育既依賴于胸腺微環境,也依賴于其細胞自身。胸腺DP細胞表面CD1d對糖脂類抗原的有效提呈在iNKT細胞陽性選擇過程中發揮重要作用,CD1d敲除小鼠iNKT細胞幾乎完全缺失[14]。然而,本研究結果顯示:HDAC3敲除并不影響胸腺DP細胞表面CD1d的表達,提示HDAC3主要通過內源性途徑調控iNKT細胞在胸腺的產生、發育和成熟,這也被骨髓混合嵌合體實驗結果進一步證實。這一結果表明:以HDAC3為靶點的干預措施可直接對iNKT細胞發育和功能發揮調控作用,進而可以調節iNKT相關疾病的發生發展。
目前對HDAC3調控iNKT細胞產生、發育的信號通路仍不完全明確。CD122是IL-15受體β亞單位,本研究結果顯示:CD122在HDAC3敲除小鼠iNKT細胞中表達水平明顯降低,表明HDAC3敲除引起的iNKT細胞產生和發育缺陷與IL-15信號通路受阻有關[15]。ZHU等[16]報道IL-15信號途徑缺陷導致iNKT細胞自噬功能下降,細胞生存能力明顯降低。THAPA等[17]研究顯示:與正常iNKT細胞比較,HDAC3缺失iNKT細胞自噬標記物Cyto-ID染色陽性率和LC3A/B表達降低,進一步證實HDAC3可通過細胞自噬途徑調控iNKT的生存和發育。另外,HDAC3與NKAP和Runx1均可發生細胞內相互作用,而NKAP和Runx1缺失同樣導致iNKT細胞生成明顯減少,提示HDAC3也可通過NKAP和Runx1相關信號途徑調控iNKT的產生和發育[18-19]。
在受到TCR信號刺激時,iNKT細胞能在短時間內產生大量Th1和Th2型細胞因子,進而發揮強大的免疫調節功能[20]。研究[21]顯示:非成熟CD44-NK1.1-和CD44+NK1.1-iNKT細胞主要產生IL-4,而成熟CD44+NK 1.1+ iNKT細胞主要產生IFN-γ。本研究結果顯示:HDAC3敲除導致iNKT細胞和機體IL-4和IFN-γ的產生均明顯降低,表明HDAC3可總體影響iNKT細胞的功能。一方面,HDAC3缺失引起的iNKT及外周CD4+和CD8+T細胞數量的明顯減少可導致α-Galcer活化iNKT細胞和機體細胞因子產生明顯減少;另一方面,HDAC3也可能通過對IL-4和IFN-γ及其轉錄因子如GATA-3和T-bet的直接或間接表達調控作用影響以上細胞因子的產生[8]。
綜上所述, HDAC3內源性地調控iNKT細胞的發育和成熟,HDAC3缺失導致iNKT細胞數量明顯減少、細胞成熟障礙和細胞因子產生功能的明顯降低。而對于HDAC3調控iNKT細胞產生、發育和功能發揮的信號通路目前仍不明確,需要在后續實驗中進一步探討。

