LincRNA-p21敲減對胃癌細胞生長和轉移的影響及其作用機制
徐建國, 曹洪濤, 張子龍, 冀保妍, 王春秋, 李生棟, 劉國慶
(1.青海省人民醫院腫瘤外科,青海 西寧 810001; 2.青海省人民醫院腫瘤內科,青海 西寧 810001; 3.青海省人民醫院消化內科,青海 西寧 810001)
胃癌是亞洲最常見的消化道腫瘤之一,在導致死亡的癌癥類型中位居第3位[1],其死亡率在國內也有增高趨勢[2-3]。因此,確定新的分子標志物以診斷早期胃癌是一個迫切需要解決的問題,且尋找的生物標志物不僅能診斷早期胃癌,也能作為治療胃癌的分子靶點。
長鏈非編碼RNA(long noncoding RNA,LncRNA)是一種長度超過200個核酸序列的轉錄因子,近年來被廣泛關注。而LincRNA-p21被認為是p53的轉錄調節因子,在p53調控網絡起著“效應器”的作用,可抑制p53的轉錄,調節細胞周期與凋亡[4-5]。有研究[6]表明LincRNA-p21與前列腺癌的發生及發展有關,但其在胃癌發生過程中的作用尚不清楚。Janus激酶/信號轉導子與轉錄激活子(Janus kinase/signal transducer and activator of transcription,JAK/STAT)信號通路被認為是與腫瘤的發生、遷移和侵襲等過程相關的信號通路,其激活可導致STAT5蛋白異常磷酸化,p-STAT5轉移至細胞核結合在DNA-STAT5結合位點上,加速細胞增殖基因的轉錄,從而導致腫瘤的發生[7]。近年來,有研究[8-9]表明多種LncRNA參與JAK/STAT信號通路的調節。
為了探討LincRNA-p21是否通過此通路來調節腫瘤的發生發展、遷移及侵襲,本文作者首先研究LincRNA-p21在胃癌組織和多種胃癌細胞中的表達情況,再利用體外及體內實驗,采用慢病毒感染方法敲減胃癌細胞MGC-803中LincRNA-p21表達,觀察LincRNA-p21敲減對MGC-803細胞的生長、遷移及侵襲功能的影響,且研究其對JAK-STAT信號通路的調節作用,來闡明LincRNA-p21低表達可能是胃癌進展的關鍵事件之一。
1 材料與方法
1.1 實驗動物、細胞、主要試劑和儀器8只6周齡SPF級雄性BALB/c裸鼠購自北京維通利華實驗動物技術有限公司,動物合格證號:SCXK(京)2016-0011。胃癌細胞MGC-803、MKN-45、SGC-790和正常胃黏膜細胞GES-1(ATCC細胞庫,美國)。5-乙炔基-2′-脫氧尿苷(EdU)檢測試劑盒(廣州銳博生物科技有限公司),胎牛血清和DMEM培養基(Gibco公司, 美國),CCK-8 細胞計數試劑盒(武漢默沙克生物科技有限公司),RNAiso Plus試劑盒、逆轉錄試劑盒和SuperReal PreMix試劑盒[天根生化科技(北京)有限公司],RIPA裂解液、BCA蛋白定量試劑盒和β-actin抗體(上海碧云天生物科技有限公司),p-JAK1抗體、p-STAT3抗體和pSTAT5抗體(CST公司, 美國),兔抗鼠二抗[艾博抗(上海)貿易有限公司],靶向抑制LincRNA-p21的慢病毒載體(sh-LincRNA-p21)和對照(sh-NC)由上海吉瑪公司合成。BX3型熒光顯微鏡(Olympus公司,日本),ABI 7500熒光定量 PCR儀(Applied Biosystems公司, 美國),iMark多功能酶標儀(Bio-Rad公司,美國)。
1.2 組織來源收集2014—2016年青海省人民醫院腫瘤外科留存的20例Ⅲ期(T分期)胃癌患者行腫瘤切除術的胃癌腫瘤組織和配對的癌旁對照組織(距離腫瘤組織邊緣2.5 cm)。本研究通過青海省人民醫院倫理委員會批準(No.20140315116)。
1.3 細胞培養胃癌細胞MGC-803、MKN-45、SGC-790與正常胃黏膜上皮細胞GES-1培養于含10%胎牛血清的DMEM培養基、37℃的培養箱(5%CO2,95%濕度)中培養,當細胞達到90%融合時按照1∶3傳代。取對數期細胞用于后續實驗。
1.4 細胞處理和分組將2×105個MGC-803細胞接種至24孔板中,待細胞貼壁后,吸棄培養基,加入2 mL含有6 mg·L-1聚凝胺的新鮮培養基,并分別加入感染復數(multiplicity of infection,MOI)為40的 sh-LincRNA-p21和sh-NC病毒液,繼續培養24 h后,更換新鮮的完全培養基,再繼續培養24 h。該病毒感染的MGC-803細胞經RT-qPCR法檢測干擾效果后,收集細胞,分別命名為sh-NC組和sh-LincRNA-p21組。將密度為1×106mL-1且穩定感染sh-LincRNA-p21的MGC-803細胞接種于6孔板,待細胞貼壁后,采用10 μg·L-1JAK-STAT通路特異性抑制劑AG490處理細胞30 min。收集細胞并命名為AG490+sh-LincRNA-p21組。
1.5 RT-qPCR法檢測LincRNA-p21 mRNA表達水平收集胃癌腫瘤組織、癌旁組織、MGC-803細胞、MKN-45細胞、SGC-790細胞和GES-1細胞與sh-NC組及sh-LincRNA-p21組MGC-803細胞分別置于EP管中,按照 RNAiso Plus說明書步驟,依次采用RNAiso Plus變性緩沖液、20%體積氯仿、異丙醇、75%乙醇萃取細胞總RNA。其次,取1 μg總RNA通過逆轉錄試劑盒方法逆轉錄合成cDNA。再次取cDNA模板和目的基因引物,按照SuperReal PreMix試劑盒說明書利用ABI 7500熒光定量 PCR儀進行RT-qPCR。反應條件:95℃、30s,然后進行40循環(95℃、2 s,60℃、30 s,66℃、1 min)。選用GAPDH作為目的基因的內參,目的基因的相對表達水平以2-ΔΔCt表示。引物序列:LincRNA-p21正向引物5′-TGTAGTTTTCGGAGTTAGTGTCGCGC-3′,反向引物5′-CCTACGATCGAAAACGACGCGAACG-3′;GAPDH正向引物5′-GGGAAATTCAACGGCACAGT-3′,反向引物5′-AGATGGTGATGGGCTGCCC-3′。
1.6 EdU摻入法檢測細胞EdU摻入百分比將密度為1×106mL-1的sh-NC組和sh-LincRNA-p21組MGC-803細胞鋪于96孔板上,待細胞貼壁后,培養48 h,按照EdU檢測試劑盒操作步驟,加入100 mg·L-1EdU試劑,孵育2 h,DAPI試劑染核5 min。熒光顯微鏡下采用隨機視野法拍攝5張細胞圖像并計數。每組實驗重復4次。EdU摻入百分比=EdU+DAPI+細胞數/DAPI細胞數×100%。
1.7 CCK-8法檢測細胞活性將密度為1×106mL-1的sh-NC組、sh-LincRNA-p21組和AG490+sh-LincRNA-p21組MGC-803細胞鋪于96孔板上,待細胞貼壁后,培養24、48和72 h后,按照CCK-8 細胞計數試劑盒操作步驟,加入10 μL CCK-8試劑,孵育2 h。酶標儀檢測450 nm波長處的吸光度(A)值。每組實驗重復4次,取A值的平均值,并繪制細胞生長曲線。細胞活性以A值的平均值表示。
1.8 Transwell法檢測細胞遷移數和細胞侵襲數將sh-NC組、sh-LincRNA-p21組和AG490+sh-LincRNA-p21組MGC-803細胞采用無血清培養基分別制備成濃度為5×105mL-1的單細胞懸液。細胞遷移檢測:在Transwell上室加入100 μL單細胞懸液,下室加入600 μL含有10%胎牛血清的DMEM培養48 h,取出上室,擦除上室上膜細胞,0.25%的結晶紫染色上室下膜細胞10 min,顯微鏡下采用隨機視野法拍攝5張細胞圖像并計數。細胞侵襲檢測:先將Transwell上室鋪10%的基底膜,其余操作步驟與細胞遷移步驟相同。上述每組實驗均重復4次。
1.9 Western blotting法檢測各組細胞中p-JAK1、p-STAT3和p-STAT5蛋白表達水平收集sh-NC組和sh-LincRNA-p21組MGC-803細胞,利用RIPA裂解液萃取蛋白。利用SDS-聚丙烯酰胺凝膠電泳分離蛋白。分離的蛋白經轉膜和封閉后,在室溫條件下以1∶1 000的稀釋比例孵育一抗(p-JAK1、p-STAT3、p-STAT5和GAPDH)2 h。TBST洗滌后,室溫條件下孵育HRP標記的二抗1 h。TBST洗滌后利用化學發光成像儀顯影。各組細胞中p-JAK1、p-STAT3和p-STAT5蛋白條帶采用Image J軟件掃描灰度值,并以GAPDH灰度值進行量化。目的蛋白表達水平=目的蛋白條帶灰度值/GAPDH灰度值×100%。
1.10 體內成瘤實驗裸鼠飼養于恒定室溫25℃、45%~55%相對濕度的青海省地方病預防控制所SPF動物房,每天光照12 h,常規飼料飼養1周后進行實驗。分別將1×107個穩定感染sh-LincRNA-p21和sh-NC的MGC-803細胞移植入裸鼠頸部皮下成瘤,命名為sh-LincRNA-p21組和sh-NC組,每組4只裸鼠。定期用游標卡尺測量腫瘤大小,瘤體體積按照 1/2×長×寬2公式近似估算。飼養30 d后取腫瘤稱質量。
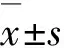
2 結 果
2.1 LincRNA-p21 mRNA在胃癌組織和不同胃癌細胞中的表達水平與癌旁組織比較,胃癌組織中LincRNA-p21 mRNA表達水平明顯降低(P<0.01)。與正常胃黏膜上皮細胞GES-1比較,胃癌細胞MGC-803、MKN-45和SGC-790中LincRNA-p21 mRNA表達水平均明顯降低(P<0.01)。與sh-NC組比較,sh-LincRNA-p21組MGC-803細胞中LincRNA-p21 mRNA表達水平明顯降低(P<0.01)。見圖1。

A:n=20,*P<0.01vsadjacent tissue;B:n=4,△P<0.01vsGES-1 cells;C:n=4,#P<0.01vssh-NC group. A: Expression levels of LincRNA-p21 mRNA in gastric cancer tissue and adjacent tissue; 1:Adjacent;2:Tumor.B: Expression levels of LincRNA-p21 mRNA in GES-1, MGC-803, MKN-45 and SGC-790 cells;1:GES-2 cells;MGC-803 cells;3:MKN-45 cells;4:SGC-790 cells; C: Expression levels of sh-LincRNA-p21 in sh-NC group and sh-Linc RNA-p21 group;1:sh-NC group;2:sh-LincRNA-p21 group.
圖1 胃癌組織和不同胃癌細胞中LincRNA-p21 mRNA表達水平
Fig.1 Expression levels of LincRNA-p21 mRNA in gastric cancer tissue and different gastric cancer cells
2.2 sh-NC組和sh-LincRNA-p21組MGC-803細胞中EdU摻入百分比和細胞活性與sh-NC組比較,sh-LincRNA-p21組MGC-803細胞中EdU摻入百分比明顯升高(P<0.01)。與sh-NC組比較,sh-LincRNA-p21組MGC-803細胞活性升高,轉染后48和72 h時,細胞活性明顯升高(P<0.05或P<0.01)。見圖2(插頁三)和圖3。
2.3 sh-NC組和sh-LincRNA-p21組MGC-803細胞遷移數與侵襲數與sh-NC組比較,sh-LincRNA-p21組MGC-803細胞遷移數和侵襲數均明顯增加(P<0.01)。見圖4(插頁三)和圖5。
2.4 sh-NC組和sh-LincRNA-p21組MGC-803細胞中p-JAK1、p-STAT3和p-STAT5蛋白表達水平與sh-NC組比較,sh-LincRNA-p21組MGC-803細胞中p-JAK1、p-STAT3和p-STAT5蛋白相對表達水平均明顯升高(P<0.01)。見圖6和圖7。

n=4,*P<0.05,**P<0.01vssh-NC group.1:sh-NC group;2:sh-LincRNA-p21 group.
圖3 sh-NC組和sh-LincRNA-p21組MGC-803細胞的EdU摻入百分比(A)和細胞活性(B)
Fig.3 Percentages of EdU incorporation (A) and cell viabilities (B) of MGC-803 cells in sh-NC group and sh-LincRNA-p21 group
2.5 sh-LincRNA-p21組和AG490+sh-LincRNA-p21組MGC-803細胞活性、遷移數與侵襲數與sh-LincRNA-p21組比較,AG490+sh-LincRNA-p21組MGC-803細胞活性在24、48和72 h時均明顯降低(P<0.05或P<0.01)。與sh-LincRNA-p21組比較,AG490+sh-LincRNA-p21組MGC-803細胞遷移數與侵襲數明顯降低(P<0.01)。見圖8(插頁三)和圖9。
2.6 sh-NC組和sh-LincRNA-p21組荷瘤裸鼠模型中瘤體體積和質量與sh-NC組比較,sh-LincRNA-p21組在移植后第9、16、23和30天時瘤體體積明顯增加(P<0.05或P<0.01),第30天時瘤體質量也明顯增加(P<0.01)。見圖10(插頁三)和圖11。

n=4,**P<0.01vssh-NC group.1:sh-NC group;2:sh-LincRNA-p21 group.
圖5 sh-NC組和sh-LincRNA-p21組中MGC-803細胞遷移數(A)和侵襲數(B)
Fig.5 Number of migration (A) and invasion (B) of MGC-803 cells in sh-NC group and sh-LincRNA-p21 group

Lane 1: sh-NC group; Lane 2: sh-LincRNA-p21 group.
圖6 sh-NC組和sh-LincRNA-p21組MGC-803細胞中p-JAK1、p-STAT3和p-STAT5蛋白表達電泳圖
Fig.6 Electrophoregram of expressions of p-JAK1,p-STAT3, and p-STAT5 proteins in MGC-803 cells in sh-NC group and sh-LincRNA-p21 group

n=4, *P<0.01 vs sh-NC group. A: p-JAK1; B: p-STAT3; C: p-STAT5;1:sh-NC group;2:sh-LincRNA-p21 group.
Fig.7 Expression levels of p-JAK1, p-STAT3, and p-STAT5 proteins in MGC-803 cells in sh-NC group and sh-LincRNA-p21 group
Fig.9 Number of migration (A) and invasion (B) and viabilities (C) of MGC-803 cells in sh-LincRNA-p21 group and AG490+sh-LincRNA-p21 group
3 討 論
胃癌的高發生率和低生存率對人類健康構成嚴重威脅,且其發展是一個多步驟的過程,涉及遺傳改變及表觀遺傳等多種因素[10]。因此,了解胃癌的發生機制對于發現新的治療靶點有相當重要的意義。LncRNAs在癌癥發展過程中的作用被眾多學者所關注,主要是因為其可作為信號、向導等調節細胞內的病理生理過程[11-13]。而LincRNA-p21是一種可抑癌的非編碼RNA,其主要是作用于p53基因調節細胞周期和凋亡[14]。基于LincRNA-p21表達特征,本文作者發現其在3種胃癌細胞系中表達水平較正常胃黏膜上皮細胞GES-1均下調。另外,臨床病理相關研究[15]表明:LincRNA-p21的低表達水平與腫瘤高侵襲性、高轉移性風險和更廣泛的TNM轉移分期有關;提示LincRNA-p21低表達可能與胃癌進展有關。為證明這一猜測,本研究采用sh-LincRNA-p21感染胃癌MGC-803細胞,結果發現LincRNA-p21敲減可促進MGC-803細胞增殖、遷移和侵襲性。而體內成瘤實驗同樣證明了LincRNA-p21敲減可促進移植瘤的生長。
異常激活JAK-STAT信號可促進包含胃癌在內的多種腫瘤細胞增殖、遷移、侵襲及上皮間質轉化(epithelial-mesenchymal transition,EMT)[16-18]。研究[19-20]顯示:LncRNA可作為JAK-STAT信號通路的重要調節因子來調節腫瘤的生長與分化。因此,本研究選取了與腫瘤發生相關的JAK/STAT信號通路作為研究重點,用來探討LincRNA-p21低表達對胃癌細胞增殖、遷移和侵襲的促進作用。本研究結果顯示:LincRNA-p21敲減能促進MGC-803細胞JAK/STAT信號通路關鍵分子p-JAK1、p-STAT3與p-STAT5的表達。

n=4,*P<0.05,**P< 0.01vssh-NC group.1:sh-NC group;2:sh-LincRNA-p21 group.
圖11 sh-NC組和sh-LincRNA-p21組瘤體體積(A)和質量(B)
Fig.11 Volumes (A) and weights (B) of tumor in sh-NC group and sh-LincRNA-p21 group
本研究利用JAK-STAT通路特異性抑制劑AG490來驗證其對感染sh-LincRNA-p21的MGC-803細胞生長、遷移和侵襲的影響,結果顯示:AG490能逆轉sh-LincRNA-p21對細胞生長、遷移及侵襲的促進能力,提示LincRNA-p21敲減對胃癌細胞生長與轉移的促進作用可能與其促進JAK/STAT通路信號活性有關。
綜上所述,LincRNA-p21敲減可促進胃癌細胞生長、遷移與侵襲。而這種作用可能與促進JAK/STAT信號通路活性有關聯,但其激活此通路的具體分子機制尚待更深入的研究。另外,本研究結果提示LincRNA-p21低表達可能是胃癌進展的潛在危險因素之一。

