孟魯司特鈉通過抑制TLR4/NF-κB信號通路影響哮喘大鼠氣道平滑肌細胞增殖和凋亡
王亞洲, 何 鵬,王丹虹
(1.海南省婦女兒童醫學中心兒科,海南 海口 570206; 2.廣西壯族自治區人民醫院兒科,廣西 南寧 530021;3. 中南大學湘雅醫學院附屬海口醫院兒科,海南 海口 570208)
半胱氨酰白三烯是一種強效的炎癥介質,可與分布在人體氣道平滑肌細胞中的Ⅰ型半胱氨酰白三烯受體相結合,參與支氣管收縮、嗜酸性粒細胞聚集、黏液分泌和血管通透性增加等氣道反應,與哮喘的病理生理過程密切相關。孟魯司特鈉(montelukast,Mon)是一種白三烯受體拮抗劑,能特異性抑制氣道中的半胱氨酰白三烯受體,在改善哮喘氣道重塑及炎癥方面具有良好的作用[1]。氣道平滑肌細胞的惡性增殖是哮喘氣道重塑的重要基礎,在氣道重塑時,氣道平滑肌細胞受到如生長因子和炎性遞質等外界信號刺激后,可引起氣道增生肥大和收縮、釋放細胞因子及產生蛋白酶等,加重氣道重塑。Toll樣受體4(Toll-like receptor-4,TLR4)是Toll樣受體家族成員,而核因子κB(nuclear factor-κB,NF-κB)是位于Toll樣受體家族下游的核轉錄因子,兩者均在調控免疫反應、炎癥反應和細胞增殖及凋亡過程中發揮重要作用[2-6]。然而,Mon影響氣道平滑肌細胞增殖凋亡及炎癥反應的分子機制是否與TLR4/NF-κB信號通路有關尚不明確。因此,本研究從TLR4/NF-κB信號通路角度出發,探討Mon對氣道平滑肌細胞增殖、凋亡及炎癥因子分泌的影響,以期為Mon更好地治療哮喘提供新的實驗依據。
1 材料與方法
1.1 實驗動物、主要試劑和儀器8只SPF級雄性SD大鼠購于廣西醫科大學動物實驗中心,動物合格證號:SCXK(桂)2009-0002。Mon購于杭州默沙東公司。噻唑藍(methylthiazolyldiphenyl-tetrazolium bromide,MTT)試劑、卵清蛋白和胰蛋白酶購于美國Sigma公司,胎牛血清購于杭州四季青公司,DMEM培養基購于美國Gibco公司,增殖細胞核抗原(proliferating cell nuclear antigen,PCNA)抗體和細胞周期蛋白D1(CyclinD1)抗體購于美國Promega公司,B細胞淋巴瘤2(B-cell lymphoma-2,Bcl-2)抗體、Bcl-2相關X蛋白(Bcl-2 associated X protein, Bax)抗體、TLR4抗體和β肌動蛋白(β-actin)抗體購于美國Santa Cruz公司,NF-κB p65抗體和辣根過氧化酶標記的二抗購于美國Abcam公司,蛋白裂解液和細胞凋亡檢測試劑盒購于上海碧云天公司,總RNA提取試劑盒購于美國Biomiga公司,逆轉錄試劑盒購于日本TaKaRa公司,白細胞介素6(interleukin-6,IL-6) 酶聯免疫吸附實驗(enzyme-linked immunosorbent assay,ELISA)法檢測試劑盒購于美國ADL公司,轉化生長因子β1(transforming growth factor-β1,TGF-β1) ELISA檢測試劑盒購于美國R&D公司。聚合酶鏈反應(polymerase chain reaction,PCR)引物由生工生物工程(上海)股份有限公司合成。
1.2 哮喘大鼠模型的建立5只SD大鼠適應性培養7 d,在第1天腹腔注射含100 μg 的1%卵清蛋白和200 mg氫氧化鋁的致敏液1 mL,于第8 天重復致敏1次;從第15 天開始,將大鼠置于不完全密閉的容器內,以給予1%卵清蛋白激發液霧化吸入激發氣道20 min,以每天1次的頻率持續4周,建立哮喘大鼠模型。其中,對照組大鼠以生理鹽水代替卵清蛋白進行致敏和激活處理。
1.3 細胞的純化、傳代和分組采用10%水合氯醛(40 mg·kg-1)麻醉2只SD大鼠,于無菌條件下分離氣道平滑肌組織,以組織貼壁法分離培養氣道平滑肌細胞,差速貼壁法純化細胞。小鼠平滑肌 α-actin 免疫細胞化學染色鑒定為氣道平滑肌細胞[7]。經純化后的細胞接種至含DMEM培養基的培養瓶中,培養至細胞融合度約為80%時以胰蛋白酶消化傳代。取第5代氣道平滑肌細胞,以含10%胎牛血清的培養液在5%CO2、37℃的恒溫培養箱中培養至細胞融合度達90%時,更換無血清培養基繼續培養使細胞同步于G0期,培養24 h后,更換含血清培養液。將細胞隨機分為對照組(加入含胎牛血清的培養液),模型組(加入含致敏大鼠血清的培養液[8])和治療組(加入終濃度為1×10-6mol·L-1Mon和含致敏大鼠血清的培養液)。
1.4 MTT法檢測氣道平滑肌細胞增殖活性將氣道平滑肌細胞以每孔200 μL(濃度為4×105mL-1)的細胞懸液接種至96孔細胞培養板上,置于恒溫培養箱內培養48 h后,加入20 μL的5 g·L-1MTT溶液孵育4 h,吸取培養基后加入150 μL二甲基亞楓,待紫色結晶充分溶解后,以酶聯檢測儀檢測各組細胞的吸光度(A)值,以A值表示細胞的增殖活性。
1.5 流式細胞術檢測氣道平滑肌細胞凋亡率收集培養48 h后的對照組、模型組和治療組細胞,調整細胞密度為1×106mL-1。嚴格按照細胞凋亡檢測試劑盒說明書操作,流式細胞儀檢測各組細胞凋亡率,結果以早期凋亡率與晚期凋亡率之和表示。
1.6 ELISA法測定氣道平滑肌細胞上清液中IL-6和TGF-β1水平收集培養48 h后的對照組、模型組和治療組細胞上清液,1 000 r·min-1離心5 min后,參照ELISA檢測試劑盒說明書檢測氣道平滑肌細胞上清液中IL-6和TGF-β1的水平。
1.7 Western blotting法檢測氣道平滑肌細胞中PCNA、CyclinD1、Bax、Bcl-2、TLR4和NF-κB p65蛋白表達水平以磷酸緩沖液洗滌收集各組細胞,加入蛋白裂解液提取細胞總蛋白,Bradford法對所提總蛋白進行定量。采用10% SDS-PAGE凝膠進行電泳分離,半干式電轉移儀轉至PVDF膜后,浸入封閉液中封閉。以特異性一抗(PCNA、CyclinD1、Bax、Bcl-2、TLR4和NF-κB p65抗體)和辣根過氧化物酶標記二抗進行孵育,經封閉液漂洗后,加顯色劑顯色,凝膠成像系統成像,以β-actin為內參,采用QuantityOne圖像分析軟件對目的蛋白灰度值進行分析,計算目的蛋白表達水平。目的蛋白表達水平=目的蛋白灰度值/β-actin灰度值。
1.8 逆轉錄-聚合酶鏈反應 (reverse transcription-polymerase chain reaction,RT-PCR)檢測氣道平滑肌細胞中TLR4和NF-κB p65 mRNA表達水平采用總RNA提取試劑盒提取對照組、模型組和治療組細胞的總RNA,并以蛋白核酸儀進行濃度定量。以RNA為模板,參照逆轉錄試劑盒步驟合成cDNA。以20 μL反應體系進行PCR擴增,采用2-△△Ct法計算氣道平滑肌細胞中TLR4和NF-κB p65 mRNA表達水平。反應條件:94℃、 3 min(1×),94℃、30 s(30×),58℃、30 s(30×),72℃、1 min(30×),72℃、5 min(1×)。內參β-actin引物F:5′-TCAGGTCATCACTATCGGCAAT-3′,R:5′-AAAGAAAGGGTGTAAAACGCA-3′;TLR4引物F:5′-CATCCAAAGGAATACTGCAACA-3′,R:5′-GTTTC-TCACCCAGTCCTCATTC-3′;NF-κB p65引物F:5′-GATAAAATCCTCGGGGTCCTAC-3′,R:5′-GCTGCTATGTGTAGAGGTGTCG-3′。
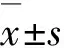
2 結 果
2.1 各組細胞增殖活性對照組、模型組和治療組細胞的增殖活性分別為0.31±0.04、0.68±0.06和0.42±0.02,3組細胞增殖活性比較差異有統計學意義(F=58.018,P<0.05)。與對照組比較,模型組和治療組細胞增殖活性明顯升高(P<0.05);與模型組比較,治療組細胞增殖活性明顯降低(P<0.05)。
2.2 各組細胞凋亡率流式細胞術檢測結果顯示:對照組細胞凋亡率為(9.58±0.46)%,模型組細胞凋亡率為(3.06±0.12)%,治療組細胞凋亡率為(6.72±0.39)%,3組細胞凋亡率比較差異有統計學意義(F=254.241,P<0.05)。與對照組比較,模型組和治療組細胞凋亡率均明顯降低(P<0.05);與模型組比較,治療組細胞凋亡率明顯升高(P<0.05)。見圖1。

圖1 流式細胞術檢測各組細胞凋亡率
Fig.1 Apoptotic rates of cells in various groups detected by flow cytometry
2.3 各組細胞上清液中IL-6和TGF-β1水平對照組、模型組和治療組細胞上清液中炎癥因子IL-6水平分別為(457.66±28.25)、(1 785.54±85.96)和(982.65±56.89)ng·L-1,TGF-β1水平分別為(156.28±28.65)、(682.75±66.58)和(417.26±32.43)ng·L-1。各組細胞上清液中IL-6和TGF-β1水平分別整體比較差異均有統計學意義(F=352.363,P<0.05;F=98.907,P<0.05)。與對照組比較,模型組和治療組細胞上清液中IL-6和TGF-β1水平均明顯升高(P<0.05);與模型組比較,治療組細胞上清液中IL-6和TGF-β1水平明顯降低(P<0.05)。
2.4 各組平滑肌細胞中PCNA和CyclinD1蛋白表達水平對照組、模型組和治療組細胞中PCNA蛋白表達水平分別為0.55±0.02、0.76±0.05和0.65±0.03;CyclinD1蛋白表達水平分別為0.41±0.03、0.83±0.06和0.53±0.03。各組細胞中PCNA和CyclinD1蛋白表達水平分別整體比較差異均有統計學意義(F=26.132,P=0.01;F=78.000,P<0.05)。與對照組比較,模型組和治療組細胞中PCNA和CyclinD1蛋白表達水平均明顯升高(P<0.05);與模型組比較,治療組細胞中PCNA和CyclinD1蛋白表達水平均明顯降低(P<0.05)。見圖2。

Lane 1:Control group;Lane 2:Model group;Lane 3:Treatment group.
圖2 各組細胞中PCNA和CyclinD1蛋白表達電泳圖
Fig.2 Electrophoregram of expressions of PCNA and CyclinD1 proteins in cells in various groups
2.5 各組細胞中Bcl-2和Bax蛋白表達水平對照組、模型組和治療組細胞中Bcl-2蛋白表達水平分別為0.31±0.02、0.68±0.03和0.54±0.03,Bax蛋白表達水平分別為0.61±0.03、0.37±0.02和0.45±0.03,各組細胞中Bcl-2和Bax蛋白表達水平分別整體比較差異有統計學意義(F=142.773,P<0.05;F=61.091,P<0.05)。與對照組比較,模型組和治療組細胞中Bcl-2蛋白表達水平升高(P<0.05),Bax蛋白表達水平降低(P<0.05);與模型組比較,治療組細胞中Bcl-2蛋白表達水平降低(P<0.05),而Bax蛋白表達水平升高(P<0.05)。見圖3。

Lane 1:Control group;Lane 2:Model group;Lane 3:Treatment group.
圖3 各組細胞中Bax和Bcl-2蛋白表達電泳圖
Fig.3 Electrophoregram of expressions of Bax and Bcl-2 proteins in cells in various groups
2.6 各組細胞中TLR4和NF-κB p65蛋白表達水平對照組、模型組和治療組細胞中TLR4蛋白表達水平分別為0.20±0.02、0.91±0.06和0.48±0.03,NF-κB p65蛋白表達水平分別為0.25±0.03、0.67±0.04和0.34±0.03,各組細胞中TLR4和NF-κB p65蛋白表達水平分別整體比較差異均有統計學意義(F=234.918,P<0.05;F=129.441,P<0.05)。與對照組比較,模型組和治療組細胞中TLR4 和NF-κB p65蛋白表達水平均明顯升高(P<0.05);與模型組比較,治療組細胞中TLR4 和NF-κB p65蛋白表達水平明顯降低(P<0.05)。見圖4。

Lane 1:Control group;Lane 2:Model group;Lane 3:Treatment group.
圖4 各組細胞中TLR4和NF-κB p65蛋白表達電泳圖
Fig.4 Electrophoregram of expressions of TLR4 and NF-κB p65 proteins in cells in various groups
2.7 各組細胞中TLR4和NF-κB p65 mRNA表達水平對照組、模型組和治療組細胞中TLR4 mRNA表達水平分別為1.00±0.08、5.22±0.15和3.35±0.23,NF-κB mRNA表達水平分別為1.00±0.05、4.16±0.26和2.63±0.12,各組細胞中TLR4和NF-κB p65 mRNA表達水平分別整體比較差異均有統計學意義(F=491.952,P<0.05;F=265.978,P<0.05)。與對照組比較,模型組和治療組中TLR4和NF-κB p65 mRNA表達水平明顯升高(P<0.05);與模型組比較,治療組細胞中TLR4和NF-κB p65 mRNA表達水平明顯降低(P<0.05)。
3 討 論
作為半胱氨酰白三烯受體的Mon,商品名為順爾寧,對哮喘具有較好的治療作用[9-10]。研究[11-12]顯示:Mon可通過降低炎癥相關因子的表達,減輕炎癥的發生,改善肺功能。Toll受體家族是一類與炎癥反應密切相關的蛋白質分子,TLR4是該家族中的重要成員,可通過識別外源性或內源性配體,激活NF-κB參與機體內血管重塑、炎癥、免疫反應和細胞增殖及凋亡等多種病理生理過程,與多種疾病的發生發展密切相關[13]。例如在實驗性創傷性腦損傷神經元自噬和炎性損傷過程中,TLR4/NF-κB信號通路發揮著重要的促進作用[14];抑制TLR4/NF-κB信號通路的活化可減輕小膠質細胞的炎癥反應,改善神經膠質細胞損傷[15];同時,抑制TLR4/NF-κB活化還可降低脂多糖對鼻咽癌5-8F細胞增殖和凋亡的作用[16]。另外,Mon還可通過改善氣道重塑,改善肺功能[17]。氣道平滑肌細胞的惡性增殖是哮喘氣道重塑的重要基礎,探討Mon調控氣道平滑肌細胞增殖的分子機制對Mon更好地應用于臨床哮喘治療具有重要意義。
研究[7,18-19]顯示:Mon可抑制NF-κB活化改善小鼠的心肌損傷,TLR4可通過NF-κB參與哮喘大鼠氣道平滑肌細胞的增殖和凋亡過程。然而,Mon影響氣道平滑肌的細胞增殖、凋亡及炎癥反應是否與TLR4/NF-κB信號通路有關尚不清楚。閆新星等[20]和魏蔚等[21]研究發現:TLR4可通過調控PCNA和CyclinD1的表達參與細胞的增殖過程;CHEN等[22]研究顯示:TLR4能夠調控炎性因子IL-6、TNF-α和IL-1水平以及凋亡相關蛋白Bax和Bcl-2的表達。NF-κB p65是NF-κB蛋白家族成員,可調控CyclinD1、Bax、Bcl-2、IL-6和TGF-β1等多種基因參與細胞的增殖、凋亡過程和炎癥反應[23-27]。本研究結果表明:Mon能夠明顯抑制哮喘誘導的氣道平滑肌細胞增殖。這一結果與王力寧等[19]發現的Mon可抑制哮喘氣道平滑肌細胞增殖、減緩氣道重構的結果相吻合。同時,Mon能夠抑制哮喘引起的PCNA和CyclinD1蛋白表達水平升高;可通過調控Bax和Bcl-2的表達減輕哮喘對氣道平滑肌細胞凋亡的抑制作用;還可降低氣道平滑肌細胞上清液中IL-6和TGF-β1水平。另外,Mon可從轉錄和翻譯水平抑制TLR4和NF-κB p65表達。本研究結果顯示:Mon影響氣道平滑肌細胞增殖和凋亡、改善氣道重塑、減輕炎癥反應的分子機制可能與抑制TLR4/NF-κB信號通路有關。
綜上所述,Mon可抑制哮喘大鼠氣道平滑肌細胞增殖促進細胞凋亡,減輕哮喘氣道炎癥反應,其作用機制可能與抑制TLR4/NF-κB信號通路有關。

