舞毒蛾標本DNA提取和COI基因擴增
徐 瑤,王鴻斌,王 梅,李國宏
(1. 中國林業(yè)科學研究院森林生態(tài)環(huán)境與保護研究所 國家林業(yè)局森林保護重點實驗室,北京 100091;2. 中國農業(yè)大學昆蟲學系,北京100193)
世界各地的生物博物館保存有數百萬個標本,其包含了時間和空間上不同歷史階段廣泛的生物群,提供了生物多樣性的豐富記錄[1-2],是生物分類學、生物地理學和生物系統(tǒng)學研究的重要組成部分[3-7]。同時,博物館標本為物種進化研究提供了難以置信的潛力[8],歷史標本與現生標本的結合可以揭示物種在一定時間尺度上以響應環(huán)境壓力在表現型或基因型上發(fā)生的變化[9-10]。隨著分子生物學、基因組學以及相關統(tǒng)計工具的發(fā)展,標本中更多的分子數據正在被挖掘和利用,例如對博物館標本中基因序列的分析能夠標識目前形成的物種遺傳多樣性的過程[11];將從模式標本獲得的序列作為新物種描述和分類修訂的附加數據來源,可增加物種識別的準確性并加快物種分類的過程等[12-13]。然而,標本中低濃度和小片段的DNA限制了從其中獲得基因序列的能力[14-15]。因此,前人做了很多關于標本DNA提取方法的研究[16-19]。Guzman-Larraldeet al[19]評價了 DNeasy?Blood& Tissue Kit、改良DNeasy?Blood& Tissue Kit、CaCl2法、改良 CaCl2法和HotSHOT法5種方法對乙醇保存昆蟲標本的DNA提取效果。魏亦寒等[20]用了4種方法(CTAB法、SDS法、磁珠法以及GeneJET基因組DNA純化試劑盒)對扶桑綿粉蚧成蟲的新鮮樣本以及乙醇保存標本進行DNA的分離提取,并對4種方法的DNA提取效果進行了比較分析。Hunter等人[21]在提取雙翅目昆蟲標本的DNA時將裂解液用超聲波處理。雖然在國內外期刊上已經發(fā)表了很多有關標本DNA提取方法的相關文獻,但是目前為止還未有一個適用于各類型標本的、提取效果較好的通用方法。標本DNA的提取方法常因保存方法、物種體型大小以及保存物種的不同而存在差異[22-27]。因此為了保證順利從標本中提取到分子數據并減少標本資源的浪費,常需要根據標本的保存方法、保存物種以及標本體型大小等選擇合適的DNA提取方法。因此本研究嘗試比較分析SDS法、磁珠法以及E.Z.N.A.?昆蟲DNA提取試劑盒3種方法對舞毒蛾新鮮樣本、干燥成蟲標本和福爾馬林幼蟲標本的DNA提取效果,以確定適用于3種類型標本的DNA提取方法,為進行下一步的實驗打好基礎。
此外,標本的保存時間、保存方式以及保存環(huán)境常會對標本的DNA降解產生影響[14-15,28-30],從而導致從標本中擴增基因序列變得困難。Zimmermann 等人[29]表明鱗翅目夜蛾科標本保存時間越久,標本中含有的大片段DNA越少,PCR擴增成功率越低。Strange等人[14]在利用熊蜂(Bombus)標本擴增微衛(wèi)星位點時,同樣表明微衛(wèi)星位點擴增的成功率與標本的保存時間成負相關。Sutrisno等人[30]在利用鱗翅目通用引物進行基因擴增時發(fā)現:對于保存時間低于6年的標本可以成功擴增出650 bp的片段;保存7年的標本擴增300 bp的片段較容易成功;而對于保存7~19年的標本未擴增得到目的片段。季清娥等[31]比較并分析了繭蜂的冷凍標本、干燥標本和乙醇標本的DNA降解情況,結果表明50 mmol·L-1無水乙醇保存的寄生蜂標本DNA降解程度最低。Miller等人[15]利用酒精保存蜘蛛標本并調查了保存時間、體型大小、系統(tǒng)發(fā)育距離等因素對DNA條形碼測序成功率的影響。結果表明保存時間與測序成功率成負相關;標本大小與測序成功率成正相關,與較小的蜘蛛物種相比可以從保存更長時間的較大的蜘蛛物種獲得標準DNA條形碼序列;而物種系統(tǒng)發(fā)育距離與測序成功率無明顯的相關關系。通過比較不同類型標本的基因序列擴增成功率不僅能夠預測是否能夠從保存標本中成功獲取到分子數據以及進一步的研究,而且能夠為標本的處理和保存提供指導。因此本研究嘗試分析討論保存時間和保存方式對舞毒蛾標本基因序列擴增成功率的影響,從而為舞毒蛾標本的保存和處理提供建議。
1 材料與方法
1.1 材料
新鮮舞毒蛾幼蟲樣本由中國林業(yè)科學研究院昆蟲病毒研究中心提供。舞毒蛾的卵塊是2008年在遼寧收集,然后在溫室中進行人工飼養(yǎng),飼養(yǎng)條件如下:溫度保持在24~26°C,光周期保持14L:10D,相對濕度60%~80%。
在中國林業(yè)科學研究院森林生物標本館中,本研究獲得了1956年至1996年收集的舞毒蛾標本(表1),所有標本都保存在低溫(10 ℃左右)、通風、光線暗的環(huán)境中。標本在保存時間和保存方式上存在差異,因此本研究嘗試利用標本進行兩個方面的研究:一方面利用1956年、1979年和1993年收集的干燥成蟲標本和福爾馬林幼蟲標本以及新鮮舞毒蛾幼蟲樣本分析并比較不同DNA提取方法對各標本的提取效果,以確定一種適合各標本DNA提取的最優(yōu)方法;另一方面利用本研究中確定的最優(yōu)DNA提取方法提取其他所有舞毒蛾標本的DNA,并將提取的標本DNA作為模板進行PCR擴增,分析并比較保存時間和保存方式對基因序列擴增的影響。

表 1 本研究所用的舞毒蛾標本Table 1 Lymantria dispar specimens used in this study
1.2 方法
以往的研究表明SDS法[20,32]和磁珠法[18,33]對各種標本的DNA提取效果較好,另外E.Z.N.A.TM昆蟲DNA提取試劑盒是一種專用于提取昆蟲DNA的試劑盒,因此本研究首先比較了這3種方法對舞毒蛾標本的DNA提取效果。
1.2.1 標本預處理 (1)干燥標本的預處理 :干燥標本DNA提取前先用干凈的毛刷刷掉標本表面的鱗毛、灰塵等污染物,然后取適當組織先用0.9% NaCl溶液浸泡3 h[18],然后將浸泡后的組織用去離子水清洗3~4次,組織清洗后在室溫條件下(15~25 ℃)自然風干,最后用液氮研磨至粉末狀。一般取成蟲標本腹部組織30 mg進行DNA提取。
(2)福爾馬林標本的預處理:福爾馬林標本在DNA提取前需利用不同濃度的乙醇溶液逐步將福爾馬林置換出來[17,34-35]。本試驗依次用濃度為65%、70%、75%、80%、85%、90%、95%和100%的乙醇溶液置換。在預處理過程中先用低濃度乙醇溶液浸泡標本2 h,浸泡后5 000×g離心10 min,丟棄浸泡液,然后再依次用高濃度乙醇溶液浸泡標本2 h,浸泡后5 000×g離心10 min,丟棄浸泡液。用各濃度乙醇溶液浸泡離心后再用去離子水清洗3~4次,自然風干后剪去頭部取30 mg組織利用全自動樣品快速研磨機(凈信JXFSTPRP-64)以60 Hz的頻率研磨1 min。
另外,新鮮的幼蟲標本在進行DNA提取前用去離子水清洗3~4次,組織清洗后在室溫條件下(15~25 ℃)自然風干,自然風干后剪去頭部取30 mg組織利用全自動樣品快速研磨機(凈信JXFSTPRP-64)以60 Hz的頻率研磨1 min。
1.2.2 SDS法提取標本DNA 根據曲良建等[32]的SDS-蛋白酶K法對預處理過的標本進行DNA的提取,但本試驗中為減少裂解液對核酸的損傷,將組織、裂解液、蛋白酶K的混合液65 ℃恒溫水浴2 h。
1.2.3 磁珠法提取標本DNA 磁珠法動物基因組DNA抽提試劑盒購買自生工生物工程(上海)股份有限公司,根據操作說明對預處理過的標本分別進行提取。
(1)將研磨過的組織放入1.5 mL離心管中,加入 400 μLBuffer MACL、200 μLBuffer MCL 和20 μLProteinase K,震蕩混勻,然后65 ℃恒溫水浴2 h,水浴過程中每隔0.5 h混勻一次以充分裂解組織細胞。
(2)其他操作步驟參考蔣欣悅[35]的研究。
1.2.4 E.Z.N.A.?昆蟲DNA提取試劑盒提取E.Z.N.A.?昆蟲DNA提取試劑盒購買自上海索萊寶生物科技有限公司,根據操作說明對預處理過的標本分別進行提取。
(1)將研磨過的組織放入1.5 mL 離心管中,在離心管中加入 350 μL Buffer CTL和 25 μL Proteinaseine K(20 mg·mL-1),然后 60 ℃ 恒溫水浴2 h,水浴過程中每隔0.5 h混勻一次以充分裂解組織細胞。
(2)水浴裂解后,在2 mL離心管中加入350 μL核酸提取液(氯仿:異戊醇=24∶1),震蕩混勻后10 000×g離心5 min,離心后取250 μL上清液小心轉移至新的1.5 mL離心管中。在上清液中加入 5 μLRNase A(25 mg·mL-1)溶液,混勻,室溫放置 10~15 min。
(3)1.5 mL離心管中加入250 μLBuffer CBL,震蕩混勻15 s,然后60 ℃恒溫水浴10 min。
(4)1.5 mL離心管中加入250 μL無水乙醇(96%~100%),震蕩混勻15 s。
(5)將HiBind?DNA吸附柱放入新的2 mL收集管中,將1.5 mL離心管中的750 μL混合液轉移至吸附柱中,10 000×g離心1 min,丟掉收集管中的廢棄液并將吸附柱重新放入2 mL收集管中。
(6)吸附柱中加入500 μLBuffer HB,10 000×g離心1 min,丟掉廢棄液及收集管并將吸附柱放入新的2 mL收集管中。
(7)吸附柱中加入700 μLWash Buffer(使用前需要加入無水乙醇),10 000×g離心1 min,丟掉廢棄液及收集管并將吸附柱放入新的2 mL收集管中。
(8)吸附柱中加入700 μLWash Buffer(使用前需要加入無水乙醇),10 000×g離心1 min,丟掉收集管中的廢棄液,將吸附柱放回2 mL收集管中然后10 000×g離心2 min,丟掉廢棄液及收集管。
(9)將吸附柱放入新的1.5 mL離心管中,加入 50~100 μLElution Buffer(提前 60~70 ℃ 恒溫水浴5 min)并在60 ℃恒溫水浴2 min,最后10 000×g離心1 min得到DNA提取液。
將3種方法提取的標本DNA用超微量紫外可見分光光度計(DeNovixDS-11)測定濃度和純度,將已知濃度和純度的DNA置于-20 ℃低溫保存?zhèn)溆谩4送猓〔糠忠呀洔y定濃度和純度的DNA樣本送去厚澤生物公司,利用Qsep100全自動核酸蛋白質分析系統(tǒng)檢測樣本中的DNA片段分布情況。一般情況下待檢測的樣本DNA濃度需高于 10 ng·μL-1,DNA 純度(A260/A280)需在 1.8~2.0之間。對于DNA提取濃度較高(>500 ng·μL-1)的樣本,為保證檢測結果的準確性,檢測之前常需要用Elution Buffer稀釋,稀釋后濃度在100 ng·μL-1左右最好。
在比較不同DNA提取方法對各標本的提取效果時,本研究僅利用了1956年、1979年和1993年收集的干燥成蟲標本和福爾馬林幼蟲標本進行分析。在確定一種適合各標本DNA提取的最優(yōu)方法后,本研究利用最優(yōu)DNA提取方法提取其他舞毒蛾標本的DNA,并將提取的所有標本DNA作為模板進行PCR擴增,分析保存時間和保存方式對基因序列擴增的影響。
1.2.5 不同標本DNA片段化程度的差異顯著性檢驗 本研究檢測到所有標本的DNA片段大小都分布在20 bp至900 bp之間,而且全自動核酸蛋白質分析系統(tǒng)自動將所有DNA片段依次分成了44組(20~40 bp, 40~60 bp, ···, 880~900 bp),并提供了每組DNA片段在所有片段中所占的百分比。本研究首先利用似然比檢驗(Likelihood ratio test,LRT)分析不同方法提取的標本DNA中各組DNA片段百分比分布的差異,以確定在DNA提取過程中3種方法對DNA的損傷情況,其中每一個樣本的數據都由44組DNA片段組成,同一種標本所有樣本的各組DNA片段所占的百分比被平均。在SPSS 18.0軟件中進行LRT檢驗時參數的設置如下所示:(1)在加權個案窗口選擇加權個案,頻率變量輸入各組DNA片段的百分比;(2)在交叉表窗口的“行”輸入44組DNA片段的分布情況(20~40 bp, 40~60 bp, ···, 880~900 bp),“列”輸入標本類型;(3)統(tǒng)計量選擇卡方;(4)在單元格窗口依次選擇觀察值、期望值、行、列和無調節(jié)。此外,為了直觀表現出不同標本DNA降解程度的差異,本研究將所有原始DNA片段百分比分布的數據導入到Origin 9.5軟件中以獲得DNA片段百分比分布的擬合曲線。在進行曲線擬合時,本研究首先將原始數據導入Origin 9.5軟件中以獲得DNA片段分布的散點圖,其中44組DNA片段作為橫坐標,每組DNA片段所占有的百分比作為縱坐標,然后對散點圖進行了各種非線性擬合以獲得最佳擬合曲線(具有最高相關系數R2)。為了直觀表現出干燥成蟲標本和福爾馬林標本的DNA片段分布差異,本研究利用Origin 9.5軟件制作了兩種標本的堆積柱形圖。由于44組DNA片段所占的百分比相對較小,若直接用44組DNA片段所占的百分比作圖會導致堆積柱形圖對比不清晰。因此,在制作堆積柱形圖時本研究將44組DNA片段分成了四個大組(A,B,C和D),其中A組包括第1至8組的DNA片段,B組包括第9至17組的DNA片段,C組包括第18至 26組的DNA片段,D組包括第27至第44組的DNA片段,然后分別計算這四組DNA片段在所有片段中各自所占百分比。最后利用四組DNA片段在所有片段中各自所占百分比在Origin 9.5軟件中繪制兩種標本成組堆積柱狀圖。在繪制擬合曲線和堆積柱狀圖時,本研究利用了每一種標本所有樣本的各組DNA片段百分比的平均值。
1.2.6 引物設計和PCR擴增 本研究根據標本中的DNA片段分布情況(20~900 bp)設計了15對COI基因特異性引物,其目標片段在216 bp至977 bp之間。在設計引物時參考了GenBank上已經公布的舞毒蛾完整的線粒體基因序列(FJ617240,KY798442和KY923059-KY923067)。所有設計引物信息如表2所示。
將已知濃度和純度的DNA作為模板,利用以上15對引物進行PCR擴增,擴增體系為:DNA模板質量<1 μg,2×Tap PCR MasterMix(天根)12.5 μL,正反引物各 1 μL,ddH2O 補至 25 μL。PCR反應循環(huán)的設置為:
94℃ 3 min
94℃ 3 sec
48 ℃~54.3 ℃ 30 sec (2~4 步) 30 個循環(huán)
72 ℃ 1 min
72 ℃ 5 min

表 2 本研究所用的引物Table 2 All primers used in this study
其中15對特異性引物的退火溫度不同,在PCR擴增時具體退火溫度的設置如表2所示。
將擴增產物上樣到1%的瓊脂糖凝膠中,以DL2000 DNA Marker(天根)作為參考DNA Marker,在1×TAE電泳緩沖液中電泳30~40 min,電泳完成后取出瓊脂糖凝膠在凝膠成像系統(tǒng)中檢測PCR擴增結果。
2 結果與分析
2.1 DNA濃度與純度
3種提取方法提取的各標本的DNA濃度和純度如表3所示,從表中可以看出SDS法對1956年、1979年和1993年收集干燥成蟲標本和福爾馬林幼蟲標本的DNA提取效果相對較差,特別是未能從1956年收集的福爾馬林標本中提取到DNA;磁珠法和E.Z.N.A.TM昆蟲DNA提取試劑盒對于新鮮樣本的提取效果差異不是很明顯,但E.Z.N.A.TM昆蟲DNA提取試劑盒對于干燥標本和福爾馬林標本的DNA提取濃度和純度都較磁珠法較好。

表 3 不同方法提取DNA的濃度與純度Table 3 The concentration and purity of genomic DNA extracted by different methods
2.2 不同提取方法對標本DNA的損傷程度
本研究對用不同方法提取的干燥成蟲標本(收集時間相同)的DNA片段分布進行了似然比檢驗,結果發(fā)現用不同方法提取的干燥成蟲標本(收集時間相同)的DNA片段分布差異是不顯著的(df=1,P1956=0.745,P1979=0.560,P1993=0.101)。同樣的,通過對用不同方法提取的福爾馬林幼蟲標本(收集時間相同)的DNA片段分布進行似然比檢驗,發(fā)現用不同方法提取的福爾馬林幼蟲標本(收集時間相同)的DNA片段分布差異是不顯著的(df=1,P1956=0.439,P1979=0.983,P1993=0.482)。因此,本研究表明雖然3種DNA提取方法的提取效果存在差異,但是3種方法在提取過程中都未對標本DNA產生損傷,也可能3種方法在提取過程中對標本DNA產生的損傷程度是相同的。此外,本研究獲得了不同方法提取的干燥成蟲標本和福爾馬林幼蟲標本(收集時間相同)的DNA片段百分比分布的擬合曲線,如圖1所示。從圖1中可以看出不同方法提取的干燥成蟲標本和福爾馬林幼蟲標本的(收集時間相同)DNA片段分布的擬合曲線基本是一致,這同樣表明3種提取方法在提取過程中對標本DNA的損傷程度差異是不明顯的。
2.3 不同標本的COI基因擴增
各年份收集的舞毒蛾標本的15對引物的擴增結果如圖2所示,從圖2中可以看出干燥標本的保存時間越久長序列目的片段的擴增越困難。對于1982年之前保存的標本未能擴增出大于400 bp的基因序列,而對于1987年到1996年收集的標本擴增大于400 bp基因序列的成功率顯著增加。但是所有保存標本均未能擴增獲得大于600 bp的目的片段,而15對引物在新鮮舞毒蛾樣本中均擴增成功。本研究推測導致所有標本均未能擴增獲得大于600 bp的目的片段的原因主要與標本DNA的降解有關,而且標本保存時間越長(22~62 a)舞毒蛾標本提取DNA的降解越嚴重。本研究獲得了各年份收集的舞毒蛾干燥標本的DNA片段百分比分布的擬合曲線,如圖3所示。從圖3可以看出不同年份收集的舞毒蛾干燥標本的DNA片段百分比分布的擬合曲線明顯不一致。隨著保存時間的增加,標本中大片段DNA所占的百分比明顯降低,小片段DNA所占的百分比顯著增加。

圖 1 不同方法提取DNA的片段分布Fig. 1 The fragment distribution of genomic DNA extracted by different methods

圖 2 不同年份收集的舞毒蛾標本的測序成功情況Fig. 2 Sequencing success profile for L. dispar specimens collected in different years
另外,本研究發(fā)現對于收集時間相同的福爾馬林標本和干燥標本,福爾馬林保存的舞毒蛾標本其總體擴增成功率比干燥標本的略高,其中1956年、1979年和1993年收集的福爾馬林標本的擴增成功率分別為33.33%、46.67%和73.33%,而干燥標本的擴增成功率分別為26.67%、40.00%和53.33%。在干燥成蟲標本和福爾馬林幼蟲標本的DNA片段百分比的堆積柱狀圖中(圖4),本研究展示出四組DNA片段百分比組成在福爾馬林幼蟲標本和干燥成蟲標本之間存在明顯差異。而且干燥成蟲標本中的小片段DNA比例明顯要高于福爾馬林幼蟲標本的小片段DNA比例(1-8組DNA片段);相反的,干燥成蟲標本中的大片段DNA比例明顯低于福爾馬林幼蟲標本的大片段DNA比例(9-44組DNA片段)。

圖 3 舞毒蛾標本的DNA片段百分比分布圖Fig. 3 The percentage distributions of DNA fragments for L. dispar specimen
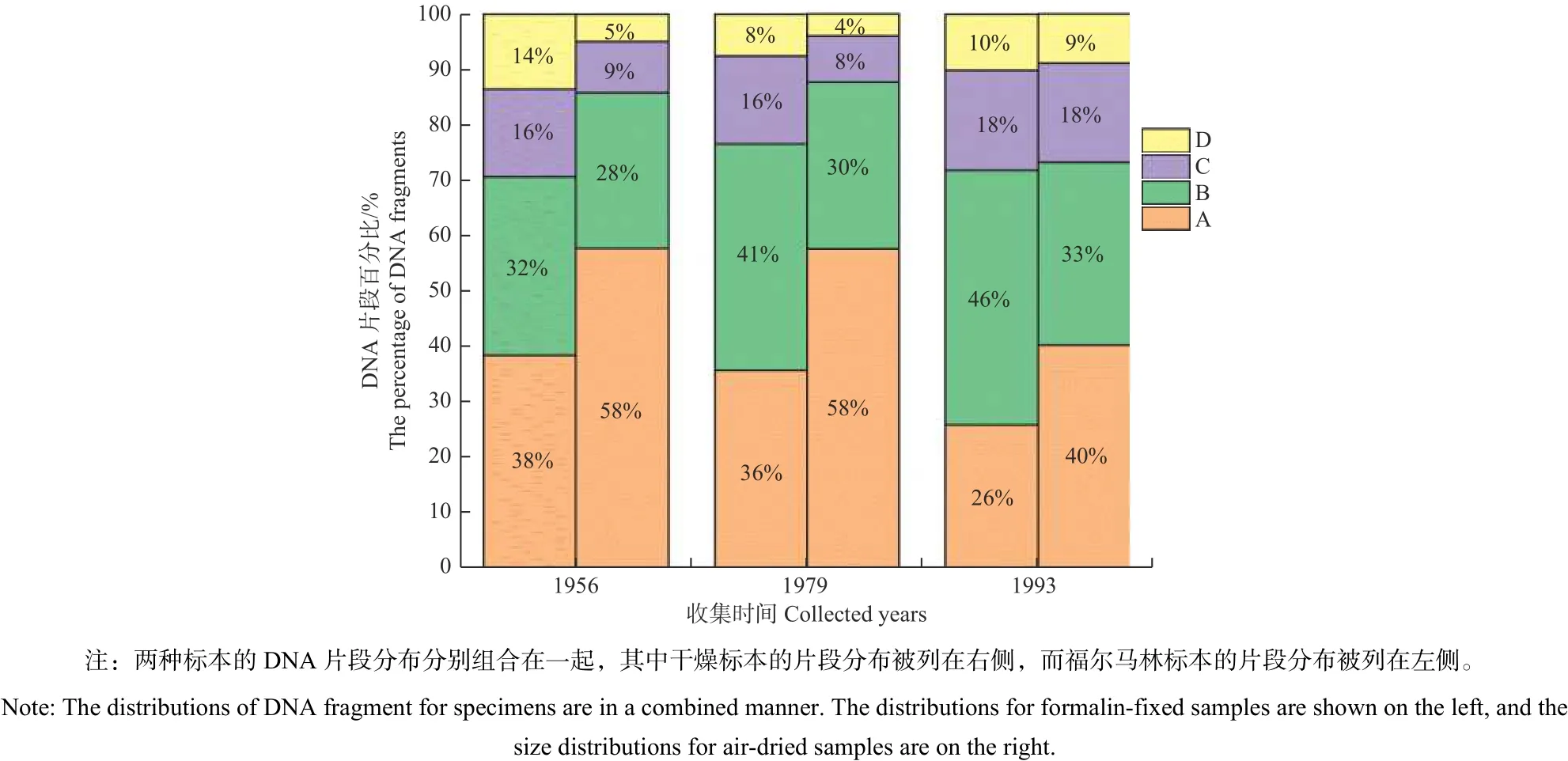
圖 4 干燥成蟲標本和福爾馬林幼蟲標本的DNA片段分布比較Fig. 4 Comparison of DNA fragment distributions between dried adults and formalin-fixed larval specimens
3 討論
通過比較分析SDS法、磁珠法以及E.Z.N.A.TM昆蟲DNA提取試劑盒3種方法對舞毒蛾新鮮樣本、干燥標本和福爾馬林標本的DNA提取效果,本研究發(fā)現E.Z.N.A.TM昆蟲DNA提取試劑盒更適合館藏的舞毒蛾干燥標本和福爾馬林標本的DNA提取。SDS法在DNA提取時利用SDS(十二烷基硫酸鈉)破壞細胞壁并裂解DNA-蛋白質復合體,使DNA釋放出來。但在標本中細胞內的DNA-蛋白質的交聯(lián)現象加重,使得SDS(十二烷基硫酸鈉)無法有效裂解DNA-蛋白質復合體,因此減少了標本中DNA的釋放。同時SDS法中常用到的氯仿、苯酚等提取劑也無法完全清除,使得標本DNA提取純度降低,因此SDS法提取的模板DNA不利于進行PCR擴增等下一步實驗。近年來,磁珠法由于其操作過程相對簡單、快速,不需要氯仿等有毒溶劑的抽提,也無需過多離心、沉淀等耗時的純化步驟,而且能夠提高DNA提取純度,在標本DNA提取方面的應用越來越廣泛[18,33]。但是磁珠法DNA提取效果常常受磁珠量的影響。當磁珠量過少時,由于磁珠表面的DNA吸附量有限,因此使得標本DNA未能被完全吸附;當磁珠量過多時,由于磁棒對磁珠的吸附能力有限導致部分磁珠未能被吸附,從而使部分磁珠吸附的DNA被浪費。因此為了達到最好的磁珠法提取效果,試驗時應該適當控制磁珠量。E.Z.N.A.TM昆蟲DNA提取試劑盒雖然提取過程較磁珠法復雜,同時需要用到氯仿等有毒溶劑的抽提,但其在標本DNA提取過程中用到的裂解、抽提緩沖液以及純化溶劑能夠很好的裂解組織細胞并將DNA釋放出來,DNA提取純度也較高,因此該法利用相對較少的標本材料即能提取到相對較高濃度和純度的DNA。因此雖然E.Z.N.A.TM昆蟲DNA提取試劑盒和磁珠法基因組DNA抽提試劑盒對于舞毒蛾干燥標本和福爾馬林標本的提取效果都較SDS法好,但是從節(jié)省珍貴標本資源的角度出發(fā),本研究更傾向于利用E.Z.N.A.TM昆蟲DNA提取試劑盒進行舞毒蛾干燥標本和福爾馬林標本的DNA提取。
本研究發(fā)現在標本館的保存環(huán)境下標本保存時間越久擴增長序列目的片段的成功率越低,這可能與標本保存過程中DNA發(fā)生降解有關。一方面新鮮活體被做成標本后其體內的代謝活動停止,細胞內的酶系統(tǒng)失去調控而導致體內DNA開始被降解,但在標本保存一段時間后其細胞內的水分會逐漸丟失從而導致體內酶失活,DNA自身降解作用也會逐漸停止。因此標本體內是否保留水分以及保留水分的時間長短對標本DNA的降解至關重要[17]。另一方面我們以前的研究表明(未發(fā)表)在標本保存足夠時間后(比如保存時間大于18 a),標本館中的環(huán)境如濕度和溫度同樣會對標本體內DNA降解產生影響,從而導致DNA片段降解程度在保存時間不同的標本中存在差異,標本保存時間越久其體內的DNA降解越嚴重,提取DNA中的大片段DNA(>400 bp)含量越低,因此擴增大片段目的序列越困難。此外,本研究表明福爾馬林幼蟲標本的擴增成功率比干燥成蟲標本的略高,因此福爾馬林幼蟲標本的DNA降解程度略低于干燥成蟲標本的DNA降解程度。這可能與干燥標本在保存前的處理以及標本館的環(huán)境有關。干燥標本在保存之前未完全干燥,使得標本體內保存水分,細胞內的酶系統(tǒng)繼續(xù)降解體內DNA;標本館環(huán)境濕度較大或者存在其他影響DNA降解的因素也可能加劇干燥標本體內的DNA降解作用。而對于福爾馬林保存的幼蟲標本,常因為福爾馬林成分中的甲醛被氧化成甲酸而導致DNA降解。但是在用福爾馬林保存標本時常會在瓶口部位纏繞封口膜以減少福爾馬林與空氣的接觸,防止甲醛氧化成甲酸從而降低了對標本DNA的損傷。因此,本研究表明干燥成蟲標本DNA降解程度比福爾馬林幼蟲標本的DNA降解程度要嚴重。但是,本研究及以前研究表明福爾馬林標本的DNA提取困難,而且樣本中存在很多PCR抑制劑[36],因此本研究不建議利用福爾馬林保存標本。另外,福爾馬林幼蟲標本與干燥成蟲標本的DNA降解程度差異也有可能與2種標本的保存蟲態(tài)有關。
標本中的分子數據是進行物種系統(tǒng)地理學、物種進化研究的重要信息,而標本DNA提取是獲得標本分子數據的基礎步驟,因此標本DNA提取方法的選擇和優(yōu)化是有效提取標本分子數據的關鍵。所以在嘗試利用標本進行分子生物學研究時,首先需要對DNA提取方法進行討論分析。本研究表明標本在處理、保存過程中發(fā)生了DNA降解,因此在標本收集保存過程中應該盡量避免導致DNA降解的操作。例如,將一部分收集的新鮮樣本直接完全干燥不做還軟處理即保存于標本館中,這將降低標本體內的水分以及水分保留時間,從而減少標本DNA自身降解的持續(xù)時間,降低標本DNA的降解程度保留更多的長片段基因序列,以便將來可利用這些標本進行分子生物學研究;而另外一部分標本可在完全干燥后展翅保存以便進行形態(tài)學研究。標本的保存條件(溫度、濕度等)也可能加劇標本體內的DNA降解作用,因此在標本保存過程中應該適當調節(jié)標本館的環(huán)境溫度和濕度,例如降低標本保存的溫度和濕度,最適合標本保存的溫度和濕度等還需要進一步研究。以前的研究表明標本的保存方式會對基因序列的擴增成功率產生影響[24,37-38],閆華超等[24]比較了甲醛、不同濃度乙醇保存標本和自然干燥標本的DNA降解程度,結果表明75%乙醇保存的蜜蜂標本DNA降解程度最低;鄭斯竹等[33]也表明無水乙醇-20 ℃保存的天牛標本比干燥標本的PCR擴增成功率高。本研究表明干燥成蟲標本的PCR擴增成功率低于福爾馬林幼蟲標本的PCR擴增成功率,因此為了不影響利用標本進行分子生物學實驗并減少采集標本的損失,可在短時間內利用適當濃度的乙醇溶液保存標本。此外,本研究建議在利用標本獲取分子數據之前提前檢測標本中的DNA片段分布和各片段的百分比分布,這將有利于為引物設計提供直接證據并減少標本資源的損失。
4 結論
本研究表明與SDS法和磁珠法相比,E.Z.N.A.TM昆蟲DNA提取試劑盒更適合舞毒蛾新鮮樣本、干燥成蟲標本和福爾馬林幼蟲標本的DNA提取,而且提取過程中未對標本DNA產生額外損傷。舞毒蛾標本的保存時間和保存方式均會對基因序列擴增產生影響,標本保存時間越久擴增長序列目的片段的成功率越低,而且福爾馬林幼蟲標本總體擴增成功率比干燥成蟲標本的略高
致謝:本研究感謝中國林業(yè)科學研究院森林生物標本館以及昆蟲病毒研究中心提供的舞毒蛾樣本。本研究還要感謝中國林業(yè)科學研究院森林生態(tài)環(huán)境與保護研究所張?zhí)K芳副研究員在試驗過程中給予的幫助和建議。

