菲脅迫下蒿柳抗氧化系統的響應
李 霞,馬曉東,鄒竣竹,周曉星,孫振元,韓 蕾*
(1. 中國林業科學研究院林業研究所,國家林業和草原局林木培育重點實驗室,北京 100091;2. 菏澤學院農業與生物工程學院(牡丹學院),山東 菏澤 274000;3. 岳陽市林業科學研究所,湖南 岳陽 414000)
人類的生存環境離不開地表水體和土壤,然而,由于工業化進程的加速,有害物質的種類和數量急劇增加,破壞生態平衡,且易通過食物鏈的富集作用危及人類健康。多環芳烴(PAHs)具有難降解性、毒性(致癌、致突變、致畸效應)和生物蓄積性[1-2],是各國優先控制的一類污染物,美國國家環保局(EPA)將萘、菲、芘、苯并[α]芘等16種PAHs列為優先控制污染物[3]。在中國東部109個農業土壤點收集的表層土壤樣本中,PAHs的總濃度從 8.8 到 3 880 μg·kg-1不等[4]。菲是三環的PAHs類,主要來源于焦化廠、煉油廠等企業生產的廢水、廢氣及汽車的尾氣排放、垃圾焚燒等,是PAHs的代表,通常在土壤、水體和沉積物中的含量較高。
植物修復是一種利用根系和地上部分修復污染土壤和沉積物的低成本修復技術,近年來得到了廣泛的研究;但目前植物修復多環芳烴的研究多以草本植物為主,而木本植物具有生物量大、根系發達及地上部分可多年生長等優點。生長較快的洋白蠟(Fraxinus pennsylvanicaMarsh.) 、 DN 34楊(Populus deltoidesMarsh.×P. nigraL. DN 34)和黑柳(Salix nigraMarsh.)相比,黑柳對土壤中PAHs的降解率最高[5]。Hultgren等[6]溫室實驗表明,蒿柳(Salix viminalisL.)種植土壤中菲和芘的降解率分別是沒有植物存在的1.47倍和1.27倍。
植物在修復PAHs的過程中,應能承受由污染物引起的脅迫,但高濃度PAHs對植物具有毒害作用,導致其形態學、細胞學以及代謝紊亂[7],甚至死亡[8]。活性氧(ROS)是逆境下破壞植物防御系統,使細胞中毒死亡的重要因素,而抗氧化系統(AOS)在活性氧的清除中起重要作用,常被用于植物的抗性評價[9]。關于植物對PAHs脅迫活性氧生成及抗氧化反應的研究有少量報道,如Salehi-Lisar等[10]用芴處理小麥(Triticunt aestivumL.)、紫花苜蓿(Medicago sativaL.)和向日葵(Helianthus annuusL.),認為過氧化氫酶(CAT)是植物抵御脅迫的重要酶。Weisman等[11]研究表明,PAHs可誘導擬南芥(Arabidopsis thalianaL.)的谷胱甘肽-S-轉移酶(GST)活性增加。Shen等[7]認為,類胡蘿卜素和超氧化物歧化酶(SOD)是菲脅迫下參與活性氧清除的最有效的抗氧化劑。這些報道表明了抗氧化系統和PAHs之間的關系,但關于木本植物這方面的研究未見報道,而揭示植物膜脂過氧化的原因及關鍵抗氧化劑的響應是提高植物在PAHs污染環境中抗性的關鍵。因此,本研究以蒿柳為研究對象,通過前期濃度篩選試驗得出其在1.0 mg·L-1菲處理下,植物的生長及根系生理指標受到顯著影響,因此,研究該濃度下抗氧化系統的響應,為提高木本植物在PAHs脅迫下的抗性及加強修復效應的研究奠定基礎。
1 材料與方法
1.1 供試植物
選取蒿柳同一無性系、直徑為(1.0±0.2)cm的1年生枝條,在水中剪成10 cm長插條,扦插在灰色塑料箱(容量20 L)內,用PVC板支撐并用海綿固定。用自來水培養2周后抹芽,保留1個枝芽,改用1/2 Hoaglang營養液培養,每3 d換1次營養液,繼續培養8周。實驗在玻璃溫室內進行,自然光照。
1.2 有機污染試劑
供試有機污染物為菲(純度>97%),其分子量 為 178.238 g·mol-1, 25℃ 純 水 中 溶 解 度 為7.3 μmol·L-1,辛醇-水分配系數(LogKow)為 4.46。用甲醇(色譜純)做溶劑配制菲的標準溶液。
1.3 試驗設計
將長勢一致的植株移入玻璃容器中適應1周后處理。菲標準溶液與蒸餾水配制的改良1/2Hoagland營養液混合,配制成菲濃度為1.0 mg·L-1的處理液,以未加菲的蒸餾水配制的改良1/2 Hoagland營養液為對照,pH值為6.0,處理液中甲醇的濃度為 0.05%。Chapin等[12]報道,甲醇濃度小于0.1%的營養液對植物根系生長沒有影響。每個處理3個重復,每個重復15根插條。容器外壁用錫箔紙包裹,保持根系和溶液避光且防止菲的光降解,每2 d更換1次處理液,每4 d隨機交換容器在溫室中的位置。自然光照,對培養液全程通氧。分別于試驗第0、4、8、12、16天采樣,測定葉片的O2·-生成速率、H2O2含量,SOD、過氧化物酶(POD)、CAT、GST、谷胱甘肽還原酶(GR)的活性,還原型谷胱甘肽(GSH)、還原型抗壞血酸(AsA)以及丙二醛(MDA)的含量。
1.4 指標測定方法
1.4.1 O2·-生成速率和H2O2的測定及原位染色每個重復將3棵植株中上部葉片剪碎混勻,放入液氮迅速冷凍并研磨。每個重復稱取0.1 g,O2·-生成速率的定量測定采用鹽酸羥胺法[13],H2O2含量的測定參考Brennan等[14]的方法進行。原位染色取上部第7~9片成熟葉,用打孔器形成圓形葉盤(直徑1 cm),采用NBT染色法測定O2·-(圖1A),DAB染色法測定H2O2(圖1B)。
1.4.2 抗氧化物質及MDA含量的測定 取樣方法同1.4.1節。SOD活性測定采用氮藍四唑法[15];POD活性測定采用愈創木酚法[16];CAT活性測定采用紫外吸收法[17];GST活性測定參考Habdous等[18]的方法;GR活性測定采用Parida等[19]的試驗方法。GSH含量測定參考Baker等[20]的方法;AsA含量測定參考Foyer等[21]的方法。MDA含量測定采用硫代巴比妥酸法[22]。
1.5 數據分析
用Excel2016進行數據整理,用GraphPad PrismVersion7.0( GraphPad software, La Jolla,CA,USA)對測定數據作圖,并進行單因素、雙因素方差分析和多重比較。圖中數據均為重復測定的平均值和標準誤差。
2 結果與分析
2.1 菲脅迫下 O2·-生成速率和 H2O2的變化
圖1表明:O2·-生成速率與H2O2均在菲處理后即大幅度增加。O2·-生成速率在處理后一直極顯著高于對照(p<0.01),其中,第4天上升最快,為對照的2.42倍,之后有所下降。H2O2在菲處理后第4天和第8天與對照達極顯著差異(p<0.01),分別為對照的1.95倍和1.92倍,之后呈下降趨勢,處理第16天時與對照相比無顯著差異(p>0.05)。
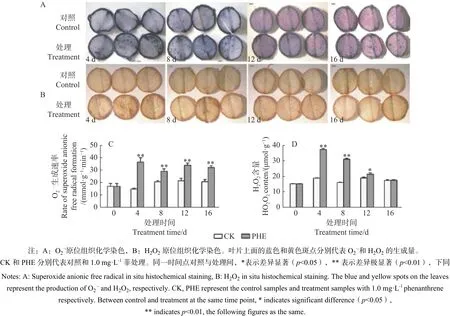
圖 1 菲處理下蒿柳活性氧的動態變化Fig. 1 Changes of ROS contents under phenanthrene treatment
2.2 菲脅迫下SOD、POD和CAT活性的變化
圖2 表明:菲脅迫下,SOD、POD和CAT活性均升高。與對照相比,SOD活性和POD活性均在處理第8天出現顯著變化(p<0.05),分別為對照的1.32和1.23倍,之后 SOD的變化不大,POD一直升高,第16天時達到最高,為對照的2.03倍。CAT在處理第4天迅速升高,為對照的2.69倍,之后出現下降,但與對照相比一直呈顯著(p<0.05)或極顯著差異(p<0.01)。
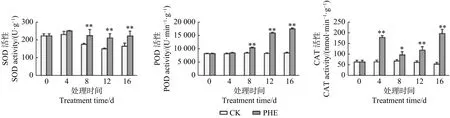
圖 2 菲處理下蒿柳SOD、POD、CAT活性的變化Fig. 2 Changes of SOD、POD、CAT activity under phenanthrene treatment
2.3 菲脅迫下GST和GR活性的變化
圖3 表明:菲處理后,GST和GR活性均上升;GST活性在處理第4天和第8天與對照相比差異不顯著,第12~16天迅速上升,第16天時為對照的1.94倍,差異極顯著(p<0.01)。GR活性在處理后即迅速上升,與對照相比呈極顯著差異(p<0.01),第16天為對照的2.24倍。
2.4 菲脅迫下GSH和AsA含量的變化
圖4表明:菲處理后,GSH含量迅速升高,且一直處于較高水平,與對照相比呈極顯著差異(p<0.01),最大為對照的2.43倍。AsA的含量處理后即低于對照,第4天時為對照的60.6%,但隨著脅迫時間的延長呈上升趨勢,第16天時高于對照(p<0.01),為對照的1.23倍。
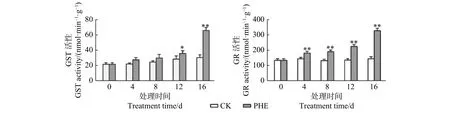
圖 3 菲處理下蒿柳GST和GR活性的變化Fig. 3 Changes of GST and GR activity under phenanthrene treatment
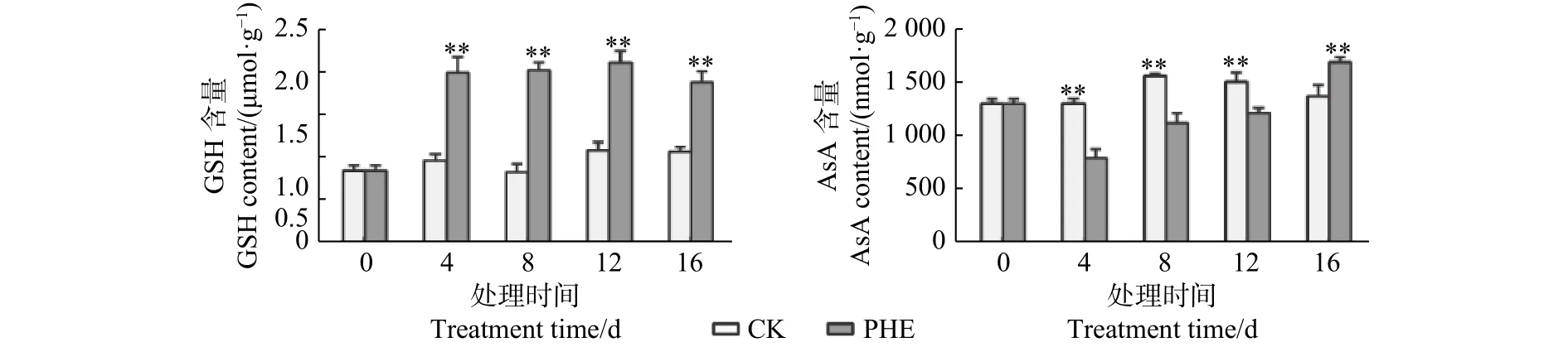
圖 4 菲處理下蒿柳GSH和AsA含量的變化Fig. 4 Changes of GSH and AsA contents under phenanthrene treatment
2.5 菲脅迫下MDA含量的變化
圖5 表明:菲脅迫下,MDA含量一直高于對照,第8天上升最快,與對照相比差異極顯著(p<0.01),為對照的1.24倍,第16天時有所下降,為對照的1.14倍。
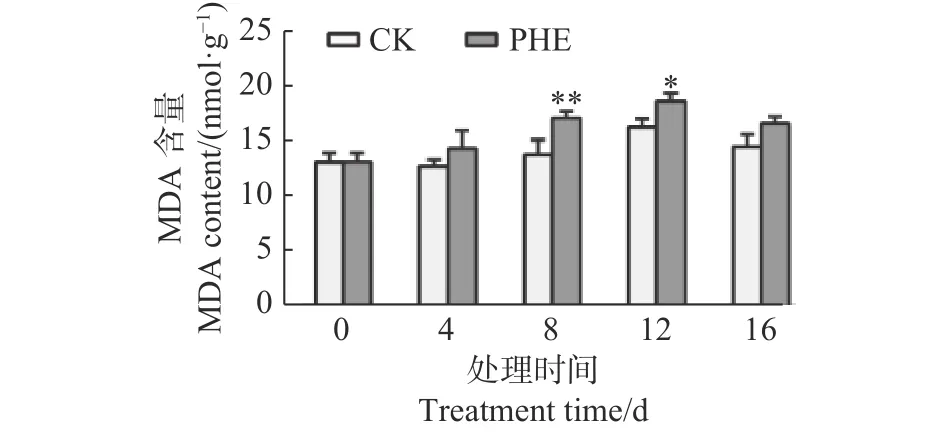
圖 5 菲處理下蒿柳MDA含量的變化Fig. 5 Changes of MDA contents under phenanthrene treatment
3 討論
3.1 菲脅迫下活性氧的動態變化
植物遭受脅迫后往往體內活性氧增加,主要包括 O2·-、 H2O2、 單 線 態 氧 (1O2) 和 羥 自 由 基(·OH)。O2·-和H2O2能直接氧化細胞內的許多組分,破壞生物大分子,造成膜脂過氧化。本試驗中,O2·-生成速率在菲處理后一直高于對照,這是因為PAHs被植物吸收后首先在體內發生羥基化反應,單加氧酶(如細胞色素P-450)可使單環和PAHs轉化為羥基化合物,在此過程中可能把電子漏給O2形成O2·-,或者在無氧條件下發生氧化還原反應形成超氧化物和過氧化物[23-24]。隨著處理時間的延長,O2·-生成速率的增加量有所下降,這與SOD活性的升高有關,SOD歧化O2·-生成H2O2,但SOD的升高不足以清除產生的O2·-,因此,O2·-一直高于對照。菲處理后H2O2含量迅速升高,之后一直下降,最后與對照無顯著差異,這說明CAT和POD活性的上升可以清除多余的H2O2。較高濃度的H2O2可以在過氧化物酶體和乙醇酸循環中被CAT催化轉化為O2和H2O,而在不含CAT的葉綠體、細胞質及含CAT很少的線粒體中,H2O2又在POD的催化下反應生成O2和H2O[25]。
3.2 菲脅迫下抗氧化物質的動態變化
誘導植物氧化應激是PAHs已知的效應[26],研究表明,抗氧化酶對PAHs有不同的響應,依據植物種類和PAHs的濃度而不同。擬南芥在0、0.25、0.5 mmol·L-1菲處理下,CAT活性無顯著變化,SOD和POD活性上升[27]。在熒蒽處理下,擬南芥隨熒蒽濃度的升高葉片SOD活性提高,GSH、H2O2和MDA含量均有不同程度的增加[28]。本試驗中,3種酶活性在菲處理后都升高,對于緩解氧化脅迫起重要作用。SOD以O2·-為底物,將其歧化為H2O2。CAT可直接清除H2O2,是早期反應的重要保護酶。POD則有不同的反應機制,Chroma等[29]研究得出,POD和細胞色素P450這2種酶系統在植物體內對外源物質多氯聯苯(PCBs)和PAHs的解毒機制中都有部分參與。本研究中,POD與H2O2成顯著負相關(p<0.05),POD可能利用H2O2氧化菲或其代謝中間產物,使其變成低毒或無毒的物質,這與Gao等[30]的研究結果一致。
GSH和AsA是植物體內重要的抗氧化劑。本試驗中,菲處理后GSH含量迅速上升,GR的活性上升使蒿柳保持較高的GSH含量。GSH除清除活性氧外以外,對有毒的外來化合物具有解毒作用,是植物防御系統的重要組成部分[31]。GST專一催化GSH的巰基與其它化合物的親電基團作用,生成谷胱甘肽衍生物[32]。本試驗中,菲誘導了GST活性上升,且在第16天時達到對照的2.1倍,說明隨著菲向地上部分的轉運增多,經細胞色素第一步代謝后,代謝生成的羥基化合物等中間產物可以在GST的催化下與GSH結合,從而達到解毒的目的。AsA含量與對照相比降低,Caviglia等[33]也報道了類似的結果,長期(2周和4周)施用除草劑百草枯后,植物組織中的抗氧化劑濃度顯著降低,植物組織產生大量草酸鈣,草酸鈣的前體是抗壞血酸。這是因為植物組織中的AsA可以被在細胞中積累的H2O2迅速轉化。Wieczorek等[34]把蒽和苯并[k]熒蒽噴灑在芹菜葉片上,導致AsA含量降低,總酸含量升高,可以間接證明這種轉化。本研究在處理過程中,雖然AsA低于對照,但一直呈上升趨勢,而H2O2的含量一直下降,間接證明了這種相關性。
3.3 菲脅迫下MDA的動態變化
MDA含量是活性氧積累和脂質過氧化的生物標志物[35],通常用于說明植物對氧化應激的敏感性[36]。植物中PAHs毒性引起的MDA積累在擬南芥和菜心(Brassica campestrisvar.campestrisL.)中已有報道[27,37]。本研究中,MDA在脅迫過程中一開始上升,后呈下降趨勢,這與Salehi-Lisar等[10]用芴處理下盆栽小麥、紫花苜蓿和向日葵的研究結果一致。這是由于蒿柳在一開始產生氧化應激反應,應激條件下的代謝失衡導致活性氧的產生,活性氧作為信號分子被傳導到植物體內,觸發抗氧化系統的防御機制,從而達到適應環境的目的,從而緩解應激條件[36,38]。
4 結論
PAHs是一種能誘導蒿柳葉片細胞氧化應激反應的污染物。菲處理下,首先,O2·-和H2O2大量增加,MDA含量升高,蒿柳表現出積極的防御措施,表現為抗氧化酶和抗氧化劑的上升;SOD活性升高,但不足以清除多余的 O2·-,O2·-是造成細胞膜脂過氧化的主要活性氧;CAT與POD的升高可以清除菲脅迫下產生的過量H2O2,對于緩解氧化脅迫起重要作用,其中,CAT是蒿柳早期響應的重要標志物;抗氧化劑中,GSH對PAHs的反應最敏感,GSH是蒿柳應對菲脅迫的重要抗氧化劑,并通過GST的催化對植物體內菲的代謝中間產物進行解毒。

