夾脊電針對急性脊髓損傷大鼠脊髓病理形態及組織中炎性因子表達的影響*
付 豪,梅繼林,李慶琳,李曉寧
(1.黑龍江中醫藥大學,黑龍江 哈爾濱 150040; 2.黑龍江中醫藥大學附屬第二醫院,黑龍江 哈爾濱 150001)
急性脊髓損傷(ASCI)為臨床常見的機械性損傷,一旦發生損傷通常會遺留嚴重的神經功能障礙,且臨床恢復較難,為患者的運動功能及心理帶來巨大壓力[1]。夾脊電針對于急性脊髓損傷的療效目前已得到大量的臨床驗證,但對于其確切作用機制的研究并無確切結論[2]。本研究通過夾脊電針治療急性脊髓損傷模型大鼠,統計各組大鼠前后運動功能及脊髓組織病理形態學及組織中IL-18、IL-1β及cleaved caspase-1表達的改變,旨在探究夾脊電針對急性脊髓損傷療效可能的作用機制。
1 實驗材料
1.1 實驗動物
清潔級Sprague-Dawley(SD)大鼠36只,雌性,體質量為(220±10)g。所有大鼠均為正常飲食且分籠飼養,實驗室溫度保持在(25±1.0)℃,空氣濕度保持在50%,光照按照晝夜循環進行。大鼠在實驗開始前,首先接受7天時間的適應性飼養。實驗過程符合國際相關的動物使用關懷標準。
1.2 試劑及儀器
大鼠白介素18酶聯免疫吸附測定試劑盒(EK0592,中國博士德);大鼠白介素1β(IL1β)ELISA檢測試劑盒(EK0393,中國博士德);cleaved caspase-1(WL03450,中國Wanleibio);BCA蛋白濃度測定試劑盒(WLA004a,中國萬類生物);石蠟切片機(RM2235,德國Leica);無水乙醇(10009218,中國國藥);顯微鏡(DP73,日本OLUMPUS);曙紅Y,醇溶(A600190,中國sangon);蘇木精(H8070,中國Solarbio);超純水系統(NW10LVF,香港Heal Force);電熱恒溫鼓風干燥箱(QH01-9030A,上海精宏);二甲苯(X112051,中國國藥);電針儀(KWD-808 II,中國英迪)。
2 實驗方法
2.1 動物分組
本次實驗研究將大鼠按照隨機分配的方法分為Sham組(假手術組)、Model組(模型組)和EA組(夾脊電針組)3組,然后每組再按照3天和7天兩個時間節點分成兩個亞組,每組6例,應用苦味酸溶液對大鼠進行標記。
2.2 模型制備及評價
在前期課題的基礎上,本次研究中主要研究了通過Allen′s法改良脊髓損傷大鼠模型的制備效果與制備方法[3]。在手術開始前,對大鼠進行12 h禁食,但可以飲水,準備所需實驗材料,大鼠稱重后,以3.5 mL/kg的劑量,采用10%水合氯醛進行腹腔注射,致大鼠麻醉,然后固定在捆綁板,在第8肋的位置處定位T10棘突,在此處備皮,消毒。再對大鼠脊柱T10節段確定之后,縱行將大鼠的背部皮膚切開,切口長3 cm,移除皮下筋膜,鈍性分離皮下組織,使T9~11節段的棘突暴露,然后剪斷,應用小號止血鉗夾住脊板,直到脊髓組織暴露,操作過程中注意不要破壞脊髓組織。將10 cm玻璃管垂直放置于已暴露出的脊髓組織正上方,使5 g的砝碼沿玻璃管內從頂端自由下落,撞擊下方脊髓,造成脊髓外力性損傷,脊髓局部用生理鹽水進行反復沖洗,分層縫合傷口。
在砝碼下落撞擊后,大鼠出現明顯的尾部搖動、痙攣扭動、雙下肢回縮的情況,并且撞擊部位出現充血情況就表示造模成功[4-5]。
在大鼠麻醉蘇醒后,采用BBB評分對大鼠進行評估,評估在3分以下的排除出本次實驗。
2.3 干預方法
2.3.1 Sham組(假手術組) 在脊髓暴露后,不做造模及其他處理,直接將傷口縫合,術后常規飼養,與EA組大鼠每天同步固定30 min。
2.3.2 Model組(模型組) 在模型制備成功之后進行傷口縫合,不開展治療,與EA組大鼠每天同步固定30 min。
2.3.3 EA組(夾脊電針組) 在造模成功之后的3 h內采用夾脊電針進行治療[6]。取穴參照實驗動物針灸圖譜,取大鼠雙側T9、T11節段夾脊穴進行針刺;操作流程:應用針灸針(華佗牌,規格:0.35 mm×13 mm)在消毒后進行穴位的刺入,刺入4~5 mm,然后將電針兩極接在同側夾脊穴上,正極為上,時間為30 min,頻率為100 Hz,調節電流避免大鼠的背部肌肉出現抽動且掙扎后停止的情況。按照該方案每天治療1次。
2.4 指標檢測
2.4.1 BBB評分評定各組大鼠肢體運動功能 BBB評分法能根據臀、膝、踝、軀干等部位運動的協調情況,量化評價脊髓損傷大鼠肢體運動功能[7],分值范圍為0~21分,在7分以內屬于后肢關節運動情況的內容,8~13分屬于對運動的協調性與步態的評估,14~21分主要針對運動過程中肢體精細運動能否完成進行評估。所有大鼠分別在造模后3天、7天兩個時間點使用BBB評分法觀察各組大鼠肢體運動功能情況。
2.4.2 HE染色法觀察大鼠脊髓組織病理形態學變化 36只大鼠均在3天、7天兩個時間節點進行BBB評分后采用10%水合氯醛(3.5 mL/kg)進行腹腔注射,達到麻醉效果,在大鼠麻醉之后迅速斷頭致死,然后在冰盒上快速的于損傷處為中點進行對脊髓組織的提取,大概2 cm,將其置于4%多聚甲醛緩沖液中進行固定,保存備用。包埋后切至厚度為5 μm的蠟片。在切片架按順序加入95%乙醇、85%乙醇、75%乙醇中各2 min,然后將切片浸泡于蒸餾水中2 min,使切片脫蠟至水。通過蘇木-伊紅溶液染色,通過顯微鏡觀察染色組織的病理形態,并于200倍鏡下拍照。
2.4.3 ELISA法檢測大鼠脊髓組織IL-18、IL-1β表達 每組大鼠于3天、7天的時間節點進行BBB評分后采用10%水合氯醛(3.5 mL/kg)進行腹腔注射,達到麻醉效果,在大鼠麻醉之后迅速斷頭致死,然后在冰盒上快速的于損傷處為中點取出長度約為2 cm的組織,置于-80℃液氮中保存備用以待進行ELISA檢測。
2.4.4 IHC法檢測各組大鼠脊髓組織cleaved caspase-1表達情況 將固定后的脊髓組織修好塊后自來水流水沖洗4 h,酒精中脫水,二甲苯中固定,直至標本透明為止,包埋后切成層厚為5 μm的薄片,放在60℃溫箱中2 h,烘干,脫蠟至水,隨后進行IHC檢測。
2.5 統計學分析
3 實驗結果
3.1 BBB評分法觀察各組大鼠運動功能
由表1可知,Sham組大鼠運動功能基本正常,Model組大鼠后肢運動功能障礙明顯,對比Sham組大鼠有明顯差異,組間差異具有統計學意義(P<0.05)。治療后,觀察EA組大鼠的評分情況明顯有所上升,與模型組比較,差異具有統計學意義(P<0.05)。說明大鼠出現脊髓組織損傷后,運動能力下降,存在運動障礙,夾脊針刺治療可以有效的優化并改善其運動能力。
3.2 HE染色觀察各組大鼠脊髓組織病理形態學變化
由封三彩圖1可見顯微鏡主要顯示為:Sham組大鼠脊髓組織無炎性細胞浸潤、未觀察到有組織水腫或者出血壞死等異常情況。Model組大鼠脊髓組織表現出嚴重的組織疏松,空泡形成,神經細胞較Sham組顯著減少,且細胞形態改變明顯,大量神經元死亡,可以明顯看出炎性細胞浸潤情況嚴重,還有一些核固縮與核染色情況明顯加深,傾向于細胞的一側,使得膠質細胞更多,且隨時間推移呈加重趨勢。EA組3天時大鼠脊髓組織病理改變與Model組類似,對比Model組的情況來看,神經細胞明顯變多,炎性細胞的浸潤情況也變多,還會出現大量的膠質細胞,這些情況相較于Model組有著明顯的減輕趨勢;在7天的時間點上,整體結構更加完整,大部分地方出現了神經細胞,且細胞的形狀不規則,胞體及胞核正常。
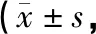
表1 各組大鼠BBB評分比較分)
注:與Sham組比較,#P<0.05;與Model組比較,*P<0.05。
3.3 各組大鼠脊髓組織IL-18表達情況
由表2可知,Sham組中可以見到一小部分大鼠脊髓組織中存在的IL-18表達,以3天、7天作為時間節點觀察,在這兩個點上趨于穩定。與Sham組相比,Model組大鼠脊髓組織IL-18表達出現了升高狀態,組間比較差異具有統計學意義(P<0.05)。而通過夾脊電針治療的方式展開治療后,觀察到EA組大鼠脊髓組織IL-18表達出現下降狀態,7天節點與Model組比較,差異具有統計學意義(P<0.05)。說明大鼠脊髓組織促炎細胞因子IL-18出現升高情況主要是在大鼠的脊髓組織受到損傷的情況下,出現這種情況很可能表現出其參與脊髓炎癥反應,本實驗采用夾脊電針進行針刺干預效果明顯,有效降低IL-18表達,減輕炎癥損傷情況。
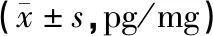
表2 各組大鼠脊髓組織IL-18表達
注:與Sham組比較,#P<0.05;與Model組比較,*P<0.05。
3.4 各組大鼠脊髓組織IL-1β表達情況
由表3可知,Sham組大鼠脊髓組織中有一小部分IL-1β表達,以3天、7天作為時間節點,在這兩個節點上具備穩定的水平。Model組大鼠脊髓組織IL-1β表達出現了明顯升高,與Sham組比較差異具有統計學意義(P<0.05)。而通過夾脊電針治療的方式展開治療后,EA組大鼠脊髓組織IL-1β表達出現明顯下降,尤其是在7天節點上,與Model組比較,差異具有統計學意義(P<0.05)。說明在大鼠脊髓受到損傷的情況下,大鼠的促炎細胞因子IL-1β表達相較于其他組大鼠有著明顯的升高趨勢,采用夾脊電針治療可以有效的降低IL-1β表達,減輕炎性反應,使得炎癥損傷得到明顯恢復。
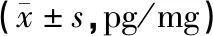
表3 各組大鼠脊髓組織IL-1β表達
注:與Sham組比較,#P<0.05;與Model組比較,*P<0.05。
3.5 IHC法檢測各組大鼠脊髓組織cleaved caspase-1表達情況
由圖2可知,Sham組大鼠脊髓中有一小部分cleaved caspase-1,主要呈現出棕黃色陽性表達狀態,以手術后3天、7天作為主要的觀察點,整體呈現出穩定的水平。觀察Model組大鼠,脊髓組織中的cleaved caspase-1陽性細胞密度值升高,與Sham組比較,差異具有統計學意義(P<0.05)。EA組大鼠治療后,大鼠脊髓組織中cleaved caspase-1呈現陽性細胞平均光密度值下降的情況,而在3天、7天的時間節點上,EA組相較于Model組差異具有統計學意義(P<0.05)。
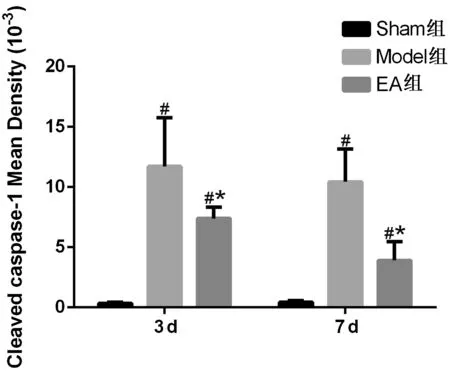
注:與Sham組比較,#P<0.05;與Model組比較,*P<0.05。圖2 各組大鼠脊髓組織cleaved caspase-1陽性細胞平均光密度值(n=6)
4 討論
“夾脊穴”靠近足太陽膀胱經與督脈,不僅具有局部的治療作用,同時能夠通過刺激背俞穴,從而疏通一身臟腑經氣[8]。主要的治療方法是將夾脊電針的導線兩極接通脈沖電流,然后針刺入夾脊穴。根據現階段的研究可以得知,在脈沖電流接通之后,人體內會產生電場,通過針刺的神經影響,促進纖維生長,使得炎癥因子與營養因子得到明顯釋放,起到調節作用[9-10]。李曉寧等[11]臨床發現,夾脊配合督脈電針治療脊髓損傷患者,在ASIA評分的改善中有著明顯的效果,并且對于MBI能力評分與感覺量表評分都能起到改善作用,相較于普通電針有著更加明顯的治療效果。吳磊[12]通過對ASCI模型大鼠實驗研究,發現夾脊電針能夠改善SCI大鼠脊髓組織炎性損傷,促進大鼠運動功能恢復。
現有研究證實,Caspase家族因子介導了一系列炎癥反應,在ASCI的繼發性損傷中起到了至關重要的影響[13]。在ASCI早期,Caspase家族炎性因子可作用于NLRP3信號通路,觸發其后一系列細胞、分子水平的炎性反應,從而加重脊髓損傷。李慶琳等[14]經動物實驗研究證實,夾脊電針能有效抑制ASCI中細胞焦亡的過程,其作用機制與降低大鼠脊髓組織中NLRP3及caspase-1的表達有密切關系。活化的Caspase-1通過進一步加工pro-IL-1β和pro-IL-18,最終形成并釋放具有生物活性的IL-1β和IL-18,促使整個細胞焦亡過程完成。IL-1β屬于IL-1家族,是一種具有多種生物學功能的細胞因子,IL-18同屬白介素1家族分子,在分子結構層面和生物功能上與IL-1β有明顯的相似性。過量的IL-1β和IL-18能夠介導生物體內炎癥反應的發生,打破正常機體組織中促炎癥細胞因子和抑炎癥細胞因子之間的平衡,誘發炎癥反應,引起機體免疫功能紊亂,從而影響正常的生理功能。因此,Caspase-1、IL-1β與IL-18的水平能夠直接反應機體內炎性反應的程度。
本研究結果顯示,在3天、7天兩個時間點上,Model組大鼠表現出較為嚴重的神經細胞受損;而EA組大鼠脊髓組織隨著治療的不斷進行,對于神經受損的病癥有著明顯的效果,可以見到許多神經細胞出現再生情況,減少了空泡的出現,而EA組大鼠的BBB評分提高的主要結構基礎就有可能為此。根據實驗室檢測結果,觀察到脊髓損傷后模型組大鼠脊髓組織內Caspase-1、IL-1β與IL-18水平較假手術組明顯上升;而在夾脊電針治療后,3天、7天兩個時間點,Caspase-1、IL-1β與IL-18的水平顯著下降(P<0.05),證實夾脊電針能夠通過調控ASCI大鼠脊髓組織內NLRP3信號通路中的相關因子表達水平,從而改善ASCI大鼠運動功能。
綜上所述,夾脊電針能夠有效控制并減輕ASCI后脊髓組織的炎性損傷,促進ASCI大鼠運動功能的恢復,該過程可能與下調脊髓組織中Caspase-1、IL-1β與IL-18的表達有關。

