嗜熱鏈球菌grx90凍干保護劑的制備
陳萱,趙瑞峰,陶志強,王麗,黃欣媛,陸震,印伯星,顧瑞霞,關成冉
(1.江蘇省乳品生物技術與安全控制重點實驗室揚州大學,江蘇揚州225127;2.華熙生物科技有限公司,濟南250101;3.江蘇省乳業生物工程技術研究中心,江蘇揚州225100)
0 引 言
乳酸菌(Lactic acid bacteria)是一類公認安全并可發酵碳水化合物產生大量乳酸的細菌的通稱[1],在自然界分布極為廣泛,具有豐富的物種多樣性。其中,嗜熱鏈球菌(Streptococcus thermophilus)是唯一廣泛應用于食品發酵的鏈球菌,其作為發酵劑在乳制品生產過程中起著重要的作用。隨著人民生活水平的提高,我國發酵乳制品工業的迅猛發展,發酵乳的產量日益增加,日益成為食品科學的研究熱點[2]。
隨著低溫干燥技術的發展,目前己開發出用量小、運輸儲藏方便、直接投入生產的多功能商品化發酵劑,即冷凍干燥發酵劑[3]。但是在實際干燥過程中依然會出現細胞不可逆損傷,導致復水后菌體大量死亡。研究表明,在冷凍干燥過程中添加一定比例的保護劑能提高菌體凍干存活率[4]。保護劑一方面可以改變生物樣品冷凍干燥時的環境,減輕或防止冷凍干燥對菌體細胞物理、化學損傷或復水對細胞的損害[5],盡可能保持菌體原有的代謝活性,另一方面可以作為支撐物在復水過程中為菌體提供一定的骨架結構[6]。
本實驗以本實驗室分離出的專利菌株嗜熱鏈球菌grx90 為研究對象,以其在冷凍干燥復水后的細胞存活率為評價指標,對凍干過程中的離心條件、凍干保護劑配方及條件進行優化,以期提高菌體在冷凍保藏過程中的存活率,為食品工業發酵劑的凍干保藏提供理論基礎。
1 材料與方法
1.1 主要儀器
JF-SX-500 高壓蒸汽滅菌鍋,日本TOMY 公司;DNP-9272 恒溫培養箱,上海精宏實驗設備有限公司;PL2002 電子天平,梅特勒公司;5804R 高速冷凍離心機,德國EPPEENDORF 公司;FREEZONE 18L冷凍干燥機,美國LABCONCO 公司。
1.2 菌種
本試驗所用嗜熱鏈球菌grx90 揚州大學江蘇省乳品生物技術與安全控制重點實驗室分離、篩選和保存的專利菌株。
1.3 培養基
MRS 培養基:葡萄糖20.0 g、蛋白胨10.0 g、無水乙酸鈉5.0 g、檸檬酸銨2.0 g、磷酸氫二鉀2.0 g、七水硫酸鎂0.6 g、四水硫酸錳0.3 g、吐溫80 1.0 mL、牛肉膏10.0 g、酵母膏5.0 g、水1.0 L、瓊脂15.0 g。
1.4 菌體的收集
將活化2 代的嗜熱鏈球菌grx90 培養液離心,按照8 000 r/min、10 000 r/min、12 000 r/min 的轉速分別離心8 min、10 min、12 min,離心后傾去清液,并稱重記錄,計算出菌泥獲得率。此后用生理鹽水補充至離心前的體積,進行活菌計數。通過比較離心后的細胞存活率和菌泥重量,選取在細胞存活率最大且菌體收集效果較好的離心條件下來收集菌體,供下一步試驗用。細胞存活率和菌泥獲得率公式如下:
菌泥獲得率/%=(M1-M2)/(M3-M4)×100%
式中:M1-離心后離心管總重(g);
M2-離心管空重(g);
M3-終止培養時培養物和試管總重(g);
M4-干試管空重(g);
細胞存活率(%)=S1/S2×100%
式中:S1-離心后存留活菌數(cfu/mL);
S2-離心前活菌總數(cfu/mL)。
1.5 保護劑配方優化
1.5.1 保護劑添加物的確定
保護劑中的不同成分對于菌體有不同的保護作用,參照昝繼清等人的方法[7]并加以改動,以12%脫脂乳為保護劑基質,按照表1 通過單因素實驗添加2%醇類、0.2%鹽類、0.2%氨基酸類[4]以及10%糖類,將保護劑分別與菌泥按體積1∶1 均勻混合,裝液高度為7 mm,-80 ℃預凍12 h 后進行凍干,計算細胞存活率來確定最適添加物。

表1 保護劑添加物
1.5.2 正交優化
篩選出最佳各添加物后,通過正交實驗以復水后的細胞存活率為指標優化凍干保護劑配方的含量,實驗因素水平如表2。

表2 正交優化實驗設計因素水平 %
1.6 保護劑及凍干條件的優化
1.6.1 保護劑與菌體混合比例的優化
利用前面所確定的最優保護劑配方,將菌種與保護劑分別按照1∶3、1∶2、1∶1、2∶1、3∶1 混合,計算存活率。
1.6.2 裝液高度的優化
裝液高度為5、6、7、8、9、10 mm 的五組樣品測定凍干前后活菌數,計算存活率篩選出最適裝液高度。
1.6.3 預凍時間的優化
將樣品分別預凍4、8、12、16、20 h,測定凍干前后活菌數,計算存活率,篩選出最適預凍時間。
本文以零件配套生產問題為例,研究了針對生產資源的不同屬性多角度地選擇決策變量來建立優化生產模型的方法,為企業管理者提供更多的生產決策依據,通過實例數據及其求解也驗證了三種模型及其優化生產方案的有效性,同時也指出了各自的優缺點.企業管理者可以根據本企業的實際情況合理的選取生產方案.
1.7 凍干存活率的測定
1.7.1 菌落計數
采用平板計數法。
1.7.2 凍干存活率的計算。
存活率(%)=凍干復水后1 mL 樣液的活菌數/凍干前1 mL樣液的活菌數×100%
1.8 數據處理
每個指標重復3 次,取平均值并采用Origin 分析軟件對實驗數據進行處理。
2 結果與討論
2.1 離心條件的優化
菌體收集是發酵劑工業化生產的關鍵步驟,雖然有膜濾濃縮等更先進的手段,但是考慮到成本以及效率的問題,離心依然是現代工業菌體收集的主要方式。但是菌株在高轉速以及長離心時間的環境中易受到剪切力的影響,發生細胞破碎導致細胞存活率降低[8]。本部分擬通過單因素實驗優化轉速及離心時間獲得最佳離心條件,結果如表3所示。
由表3 可知,嗜熱鏈球菌grx90 細胞存活率隨著轉速及離心時間的的增加而降低,菌泥獲得率隨著轉速及離心時間的增加而提高。王順余等[9]在探究凍干條件對于雙歧桿菌存活率的影響時觀點一致。本實驗結果表明,與其他條件相比菌泥獲得率總體差距不大,而離心時間為8 min 時,細胞存活率最高。因此選擇轉速為8 000 r/min、離心時間為8 min 來進行下一步實驗。
2.2 保護劑配方優化
醇類屬于小分子滲透型保護劑[10],其親水能力強且可以透過細胞膜,使細胞中溶質濃度上升從而抑制冰晶生成[11]。因此選取4 種醇類進行單因素實驗,以復水后細胞存活率為測定指標,結果如圖1所示。
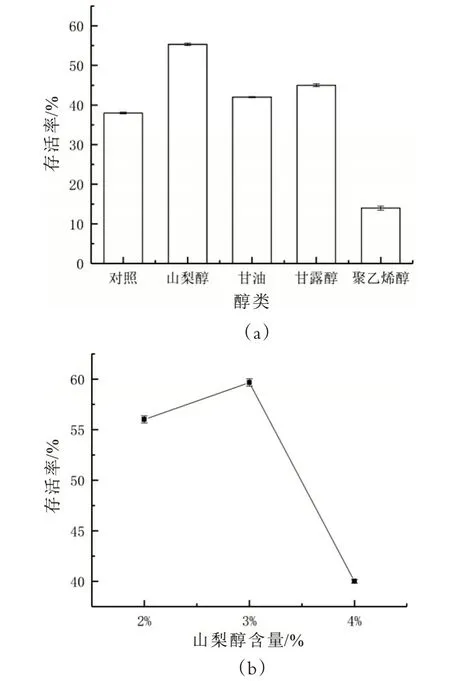
圖1 保護劑中醇類的確定及山梨醇含量的確定
由圖1(a)可知,山梨醇、甘油、甘露醇對于嗜熱鏈球菌grx90 在凍干過程中細胞損傷具有保護作用。以山梨醇作為保護劑添加劑計算凍干后所得的細胞存活率最高,為55.32%。因此選取山梨醇作為醇類添加物,并對山梨醇進行單因素實驗以確定最佳添加量來進行下一步試驗。如圖1(b)所示,當選取3%濃度山梨醇作為添加物時,凍干后計算所得的細胞存活率最高,為59.66%。因此選擇含量為3%山梨醇為醇類的最適添加量。
2.2.2 氨基酸類的優化
根據“玻璃態假說”,高濃度氨基酸分子會發生兼顧固體和流體的狀態的玻璃化,黏度極高且難以形成結晶,還存在可形成氫鍵的功能團,與菌體表面的自由基相互連結避免菌體暴露在介質中[11]。本實驗選取谷氨酸鈉以及L-半胱氨酸為氨基酸類添加物進行凍干,以復水后細胞存活率為測定指標,結果如圖2所示。

圖2 保護劑中氨基酸類的確定及L-半胱氨酸含量的確定
由圖2(a)可知,添加了谷氨酸鈉以及L-半胱氨酸的保護劑與對照組相比,細胞存活率均有所上升。添加了L-半胱氨酸的保護劑凍干后計算細胞存活率為55.43%,因此選用L-半胱氨酸作為保護劑中氨基酸類物質。如圖2(b)所示,取0.1%、0.2%、0.3%含量的L-半胱氨酸進行單因素試驗,當選取0.2%含量L-半胱氨酸作為添加物時,凍干后計算所得的細胞存活率最高,為56.19%。分析細胞存活率隨著L-半胱氨酸的增加先升高后降低的原因可能是氨基酸類與糖類相似,在濃度過高時玻璃化加劇,導致粘度過大、復水效果差。這與Fatemeh 等[12]研究凍干等儲存方法對鏈霉菌代謝的影響時結論一致。因此選擇0.2%L-半胱氨酸為鹽類的最適添加量以進行下一步試驗。
2.2.3 鹽類的優化
鹽類在菌種凍干過程中一般用于調節體系滲透壓以及充當緩沖溶液來中和細菌在凍干過程中的所產生的有機酸。本實驗選取3 種鹽類保護劑添加物進行凍干,以期復水后獲得最大細胞存活率,結果如圖3所示。
由圖3(a)可知,三種鹽類添加物乙酸鈉、硫酸錳、氯化鈣對于細胞在凍干過程中均有保護作用,其中添加乙酸鈉的保護劑細胞存活率最高,因此選取乙酸鈉作為鹽類的最佳添加物。如圖3(b)所示,以0.1%、0.2%、0.3%的乙酸鈉進行單因素試驗,當選取0.2%乙酸鈉作為添加物時,凍干后計算所得的細胞存活率最高,為59.74%,因此選擇0.2%乙酸鈉為鹽類的最適添加量。
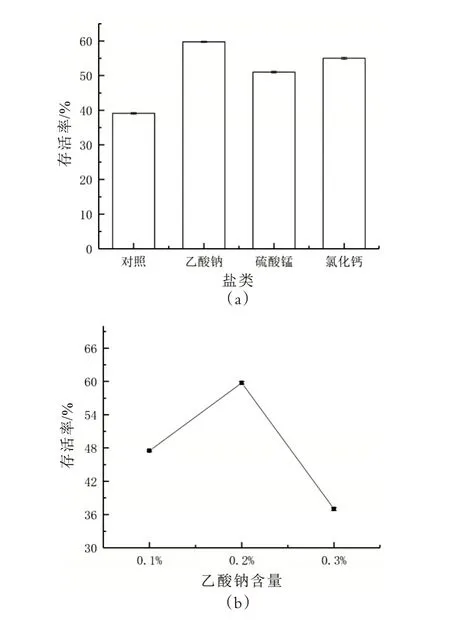
圖3 保護劑中鹽類的確定及乙酸鈉含量的測定
2.2.4 糖類的優化
研究發現,當具有黏度的糖類保護劑包圍在菌體周圍會阻止蛋白質的伸展及沉淀以維持三級結構的穩定性,從而達到保護菌體的目的[7]。因此本實驗為了探究不同糖類對菌體的保護作用,添加含量為10%的蔗糖、乳糖、葡萄糖、海藻糖以及果糖為糖類添加物進行保護劑優化實驗,結果如圖4所示。
由圖4(a)可知,添加乳糖、海藻糖的細胞存活率明顯優于對照組與其他幾種糖類,細胞存活率分別為73.40%及68.83%。這與王琳等[11]報道的在副干酪乳桿菌凍干過程中,篩選雙糖類保護劑時乳糖的效果最佳的結論一致。原因可能是由于乳糖不僅具有較高的玻璃化轉變溫度和穩定的玻璃態性質,還可以與脂雙層相互作用,對嗜熱鏈球菌grx90 在冷凍干燥過程中維持細胞膜上的脂質體的物理結構有積極意義。除此之外,乳糖作為保護劑添加物的工業成本遠低于海藻糖,因此選取乳糖作為糖類添加物。由圖4(b)可知,5%、10%、15%三種不同濃度的乳糖作為保護劑添加物時,10%濃度的乳糖添加量效果最佳,凍干后細胞存活率為71.22%。這與Lee 等人[14]在探究保護劑和復水條件對凍干后的植物乳桿菌發酵能力的影響時結果一致。原因可能是由于10%的乳糖為grx90 提供了最合適的滲透壓環境,因此選擇濃度為10%的乳糖進行下一步實驗。
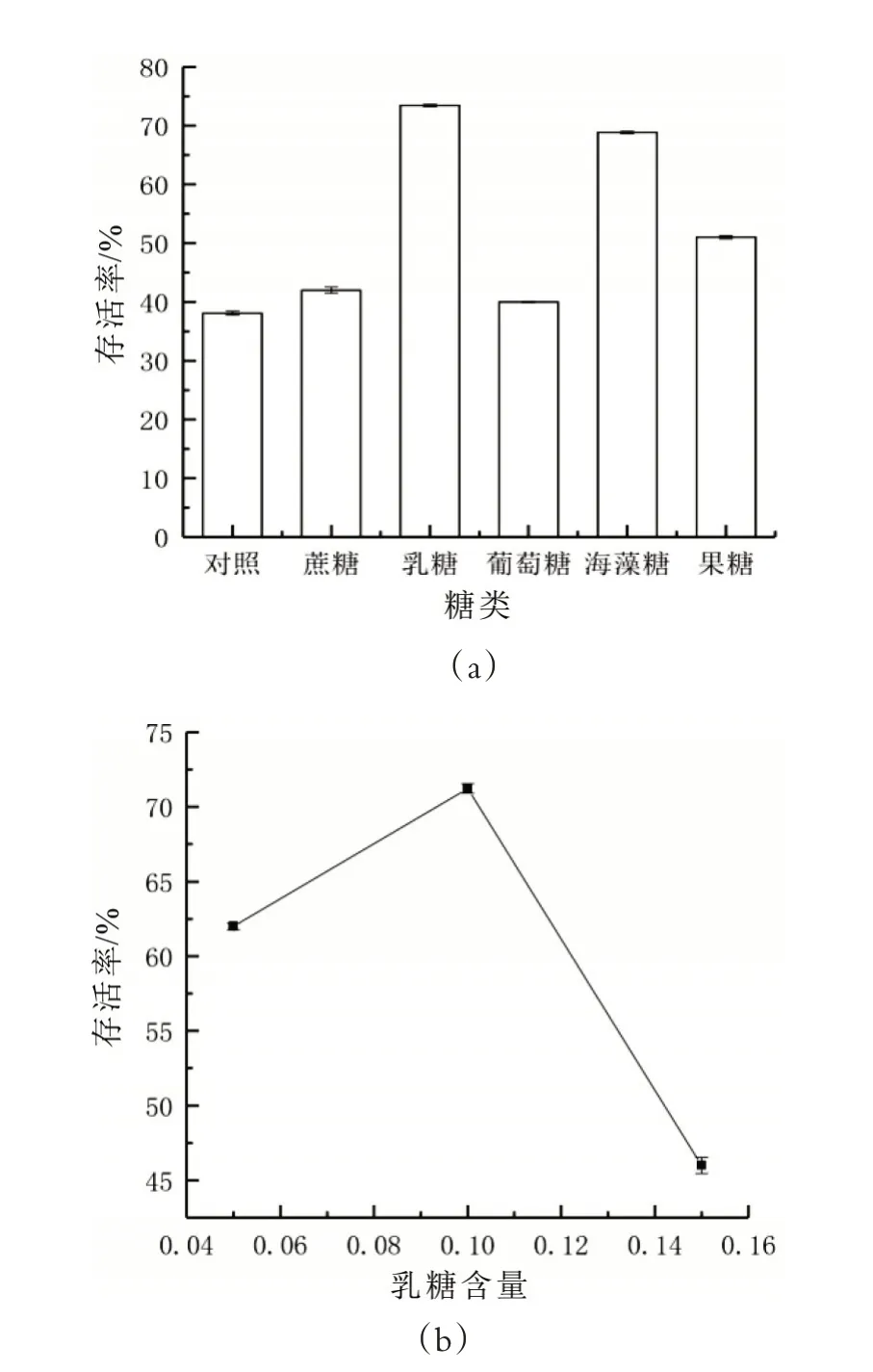
圖4 保護劑中糖類的確定及乳糖含量的確定
2.2.5 正交優化
單一保護劑并不能滿足食品工業對發酵劑的要求,因此在凍干過程中一般使用復配保護劑,而復配保護劑中的不同成分在在凍干過程中各自發揮著不同作用,但是卻又相互協同[15]。通過正交實驗優化保護劑中不同成分的配比并測定細胞存活率,結果如表4所示。

表4 嗜熱鏈球菌grx90保護劑正交優化表
根據表4 可知,最優培養基的配方為A3B1C3D1,即乳糖含量為5%、山梨醇含量為2%、L-半胱氨酸、乙酸鈉0.1%。由于得到的最優組合在正交設計中沒有,故需要進行驗證試驗,驗證試驗的結果為91.37%,優于正交表中最高的第7組的值。
2.3 凍干條件的優化
2.3.1 保護劑與菌體混合比例的優化
菌懸液與凍干保護劑的混合比例也會影響凍干過程中的細胞存活率,當總體積為2 ml 時選取5 種不同比例進行凍干,復水后測定細胞細胞存活率,結果如圖5所示。
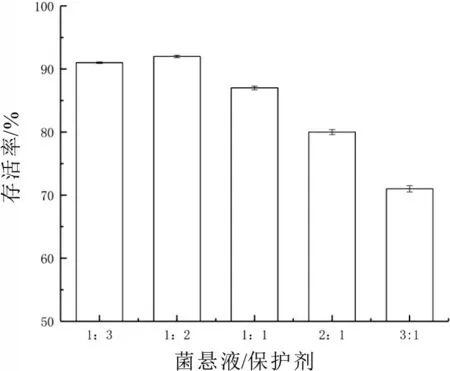
圖5 混合比例的確定
由圖5 可知,菌懸液與保護劑的比例過高或過低都會對凍干時的細胞存活率產生不良影響。當菌懸液與保護劑比例為1∶2 時得到最高的細胞存活率為92.01%。當菌懸液與保護劑比例為3∶1 時,由于保護劑濃度過低,導致在凍干過程中,細菌損傷失活現象嚴重,細胞存活率降低,僅為71.23%。但是加入過多的保護劑,則會降低菌粉的菌體含量,同時在工業生產過程中也加大了生產成本,因此選取1∶2 作為最適混合比例。
2.3.2 裝液高度的優化
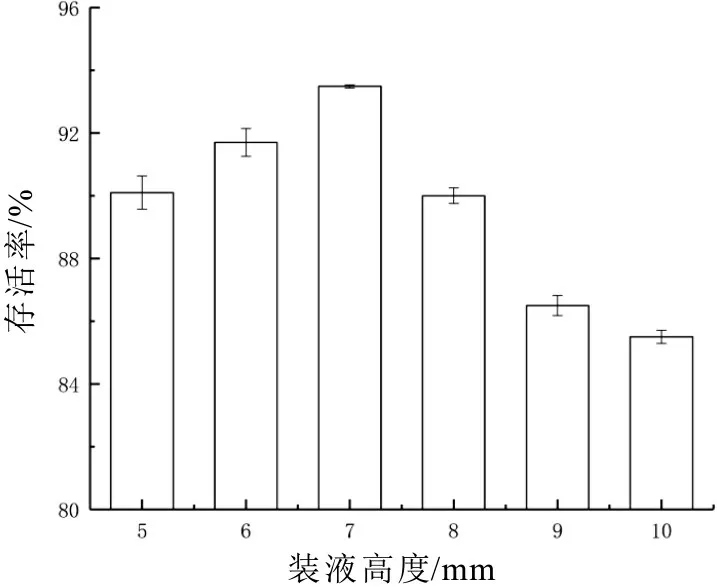
圖6 裝液高度的確定
由圖6 所知,細胞存活率隨著裝液高度的增加先增加后減小,在7 mm 時達到最高,為93.49%,隨后開始大幅降低,過薄或過厚的裝液高度不利于細胞的存活,當裝液高度過厚時,細胞無法完全凍干,導致細胞存活率大大降低;而裝液高度過低時,保護劑在凍干過程中,脫水速率過快,對細胞膜造成損傷影響存活率,因此選擇7 mm 為最適裝液高度。
2.3.3 預凍時間的優化

圖7 預凍時間的確定
由圖7 可知,細胞存活率隨著預凍時間的增長先上升后下降,在12 h 時達到峰值,為94.13%。推測原因可能是由于預凍時間過短,溫度下降速率過快而導致細胞脫水速率過快,對細胞膜造成損傷,使得細胞存活率過低。預凍過長導致細胞失去生長活性,細胞數量逐漸下降。因此應選取12 h為最適預凍時間。
3 結 論
本實驗為提升由江蘇省乳制品重點實驗室保存的專利菌株嗜熱鏈球菌grx90 在冷凍干燥過程中的細胞存活率,采用單因素實驗對凍干過程之前的離心條件進行優化。結果表明,在離心條件為轉速8 000 r/min、時間8 min 時細胞存活率最高。其次,利用單因素篩選以及正交優化的實驗確定了糖類、醇類、鹽類、氨基酸類在脫脂乳保護劑中的最佳添加物及含量分別為5%乳糖、2%山梨醇、0.3%L-半胱氨酸、0.1%乙酸鈉。最后探究了凍干條件的對菌體存活率的影響,結果表明菌液與保護劑1∶2 混合裝液高度為7 mm,預凍12 h 后對嗜熱鏈球菌grx90 具有顯著保護作用,細胞存活率最高。

