終板下椎體缺血誘導兔椎間盤退行性變模型的建立及終板中內皮素1的表達
袁 維,周小小,蔡 攀,陳 誠,郭勝洋,吳佳俊,錢 明
1.同濟大學附屬上海市第四人民醫院骨科,上海 200081
2.上海健康醫學院附屬周浦醫院骨科,上海 201318
3.海軍軍醫大學附屬長征醫院骨科,上海 200003
椎間盤是人體最大的無血管組織,其營養供應通過終板和纖維環擴散入椎間盤內。椎體終板通路是椎間盤營養供應的主要途徑,正常椎間盤營養的75%來自椎體終板的滲透,終板發生退行性變引起椎間盤營養物質供應減少是導致椎間盤發生退行性變的始動因素[1]。抗終板退行性變為防治椎間盤退行性變提供了新的思路。修復椎間盤退行性變的研究前提是建立合適的動物模型。目前,較常用的模型建立方法是纖維環穿刺或穿刺結合髓核抽吸[2-4],穿刺損傷模型操作較簡單、重復性好,且退行性變發展緩慢、便于觀察及干預,但穿刺針的型號、進針的深度需要進行精確計算,其最大的缺點是髓核組織丟失,導致發生退行性變的過程與自然退行性變有較大的差別,不能全面反映椎間盤退行性變機制。
終板退行性變包含一系列復雜的病理變化,如炎性遞質釋放、營養供應下降等[5]。發生退行性變的軟骨終板組織內ET-1 呈高表達,并且退行性變的軟骨終板細胞自身能表達ET-1,ET-1 作用于軟骨終板細胞促使其分泌基質金屬蛋白酶1(MMP-1)、MMP-13 和一氧化氮(NO),導致終板細胞外基質蛋白聚糖和Ⅱ型膠原降解,進而引起終板退行性變[6]。因此,ET-1 在椎間盤終板退行性變中起著重要作用,可能成為該病治療的新靶點。
本研究旨在探索一種建立椎間盤退行性變模型的新方法,從營養供應障礙方面著手,通過終板下注入醫用無水乙醇阻斷椎間盤營養供應,模擬椎間盤退行性變的自然過程。無水乙醇作為微循環破壞試劑,具有去血管化作用,可使椎體內骨髓血管內皮細胞迅速脫水、蛋白質變性凝固、小血管閉塞,從而造成微循環破壞[7-8]。本研究組前期實驗也證實無水乙醇注射到鼠尾終板下椎體內可阻斷椎間盤的主要營養途徑,導致椎間盤退行性變的發生[9]。本研究選用新西蘭大白兔,將無水乙醇注射到椎體內終板下,使滋養血管栓塞缺血、導致椎間盤營養物質供給障礙,進而導致椎間盤退行性變,并觀察在終板退行性變過程中ET-1 的表達情況,為后期終板退行性變的修復提供切入點及理論基礎。
1 材料與方法
1.1 實驗動物及主要材料、儀器
健康4 月齡新西蘭兔由上海中醫藥大學附屬岳陽中西醫結合醫院實驗動物中心提供[動物許可證號:SYXK(滬)2018-0040],雌雄不限,體質量(3 000±20)g,經腰椎X 線和MRI 檢查排除脊柱的先天性疾病和椎間盤退行性變后納入實驗。腰椎骨穿刺針(天津金興達實業有限公司,中國),醫用無水乙醇(國藥集團化學試劑有限公司,中國),氯胺酮、地西泮(福建古田藥業有限公司,中國),ET-1 抗體(Thermo Scientific,美國)。光學顯微鏡(Olympus,日本),數字化計算機成像X 線機和3.0 T醫用超導型磁共振掃描儀(Philips,荷蘭)。
1.2 建模方法
將32 只兔隨機分為4 組,每組8 只,選取L5,6椎體(對應L4/L5及L5/L6椎間盤)注射300 μL無水乙醇造模,選取L4椎體(對應L3/L4椎間盤)注射磷酸鹽緩沖液(PBS)作為實驗對照,L7椎體(對應L6/L7椎間盤)未注入任何物質作為正常對照。按3%氯胺酮(30 mg/kg)加0.5%地西泮(2 mg/kg)進行腹腔內注射麻醉。將兔右側臥位固定于手術臺上,在左側腰背部剃毛備皮,通過左側腹膜后入路,利用手提式X 線透視儀,側位透視顯示14G 腰椎骨穿刺針尖位于椎體前2/5 與后3/5 交界處;正位透視下,骨穿刺針在椎體左側中央處與椎體成45°角斜向下方刺入椎體,緩慢進針,至針尖達終板側椎體中心,距離終板軟骨約3 mm,將注射液注入椎體骨髓腔內,速率為50 μL/min,留針6 min,然后緩慢拔針。用4-0 Vicryl 可吸收線縫合切口。于術前和術畢肌內注射慶大霉素80 000 U,連續應用3 d。術后連續3 d 頸部皮下注射卡洛芬(0.2 mg,每日2 次)鎮痛,口服復方新諾明抗生素藥水(48 mg/mL)1 周后改用正常純凈水。術后動物自由活動。
1.3 X 線檢查測量椎間隙高度
術前和術后1、3、5個月,將實驗動物麻醉后行X 線檢查。攝影條件:50 mA,50 kV。參照Kim 等[10]的“三中線法”測量椎間隙高度,即在兔腰椎側位X線片上,選擇最上2 個和最下2 個椎體角為標記點,經過這4 點做2 條沿脊柱縱軸方向的直線,再沿相同方向做3 條直線(A、B 及C)均分先前2 條直線間的距離。再將這3 條直線經過椎間隙長度分別標記為D、E 及F,則該節段椎間盤高度為(D+E+F)/3。采用Han 等[11]的方法進行椎間盤高度指數(DHI)計算,即將椎間盤寬度四等分,測量中點及其兩側各25%位點相鄰椎體及椎間盤的高度。
1.4 椎間盤退行性變評估
術前和術后1、3、5 個月,將實驗動物麻醉后行MRI 掃描。頸椎線圈通過椎間盤矢狀正中切面,采用自旋回波序列(TR:3 000 ms,TE:120 ms)無間距掃描。采用改良Pfirrmann 分級系統[12]進行退行性變程度分級。所有MRI 影像資料均由3 位資深MRI 醫師盲法閱片。
1.5 椎間盤組織病理學觀察
術后1、3、5 個月,在X 線和MRI 檢查后,各取1 組動物給予二氧化碳(CO2)吸入處死。將整個腰椎完整取出,放入10%中性甲醛溶液中浸泡48 h 后水洗20 min,然后放入脫鈣液(按氯化鋁7 g、濃鹽酸8.5 mL 及甲酸50 mL,加蒸餾水至100 mL 配制)脫鈣4 ~ 5 d,以細針刺入椎體內無阻力為宜。沖洗15 min,于正中矢狀位剖開標本,放入50%無水乙醇浸泡后,常規包埋、制成蠟塊。4 μm 切片,行蘇木精-伊紅(HE)染色。光學顯微鏡下觀察終板及椎間盤的組織病理學變化。
1.6 終板組織ET-1表達的檢測
術后1、3、5 個月,收集終板組織進行石蠟包埋,制成組織切片,進行ET-1 抗體(1∶100)免疫組織化學染色,檢測PBS 對照和退行性變終板ET-1 表達情況。用Image-Pro Plus 6.0 軟件對陽性結果進行平均光密度定量測定。
1.7 退行性變軟骨終板細胞中ET-1表達的檢測
術后1 個月時,取1 組新西蘭大白兔,無菌情況下獲取退行性變軟骨終板組織,在超凈臺內借助4倍放大鏡仔細剔除骨屑、髓核和纖維環殘留組織,PBS 液沖洗獲得較潔白的終板組織。在含有3%胎牛血清的DMEM 培養液中加入0.15%Ⅱ型膠原酶,過濾除菌后加入終板組織。在10 cm2培養皿中用眼科剪將軟骨終板組織剪碎至約1 mm3大小,移入50 mL 離心管內,在37℃下200 r/min 振蕩,持續消化12 h。消化后的混合物用70 μm 濾網過濾,然后以1 200 r/min(離心半徑為160 mm)離心5 min;去除上清液,取沉淀細胞懸液;加入含10%胎牛血清的培養液,1 000 r/min(離心半徑為160 mm)離心5 min,去除上清液,重復3 次;按細胞密度約5×105/mL 接種于底面積為25 cm2的培養瓶中。在37℃、5% CO2培養箱中培養,培養液為含10%胎牛血清的DMEM,每3 d 換液1 次,隔天用倒置顯微鏡觀察、拍照。
將細胞接種在12 孔板內,達到80%融合時,用PBS 清洗3 次,每次2 min;然后用4%多聚甲醛固定30 min,水洗15 min,雙蒸水洗5 min;室溫下加入甲苯胺藍染色4 h,再水洗;自然晾干細胞爬片后,用中性樹膠封片,進行軟骨終板細胞鑒定。
將已消毒的10 mm蓋玻片置于12孔培養板內,按5×104/mL的密度接種于培養皿中進行細胞爬片,待細胞達到80%融合時進行ET-1 抗體(1∶100)免疫細胞組織化學染色,觀察ET-1 的表達。
1.8 統計學處理
采用SPSS 20.0 軟件對數據進行統計學分析。計量資料以s 表示,不同時間點的比較采用方差分析;以P < 0.05 為差異有統計學意義。
2 結 果
2.1 影像學評估椎間盤退行性變情況
X線片示注射無水乙醇后椎間隙變窄,椎間隙邊緣骨贅增生(圖1)。注射PBS后1、3、5個月,L3/L4DHI分別為注射前的(99.3±1.1)%、(98.8±1.6)%和(98.2±1.3)%,差異無統計學意義(P > 0.05);注射無水乙醇后1 個月,L4/L5和L5/L6DHI 為注射前的(92.1±2.8)%,3 個月時降至(72.2±6.5)%,5 個月時降至(54.3±6.0)%,差異有統計學意義(P < 0.05)。
MRI 示隨觀察時間延長,注射無水乙醇后L4/L5和L5/L6椎間盤信號改變明顯(圖2),MRI T2WI 低信號,椎間盤退行性變加劇。按改良Pfirrmann 分級,1 個月時為3 ~ 4 級,3 個月時為5 ~ 6 級,5 個月時為7 ~ 8 級。

圖 1 注射無水乙醇后腰椎椎間盤X線影像Fig. 1 Roentgenographs of lumbar disc after injection of absolute ethanol

圖2 注射無水乙醇后腰椎椎間盤MRI 影像Fig. 2 MRI of lumbar disc after injection of absolute ethanol
2.2 終板組織學觀察
HE 染色結果顯示:在無水乙醇注射后,終板逐漸出現退行性變,生長板厚度逐漸變薄,進而終板結構破損,同時軟骨終板細胞退化、直至消失;髓核內以脊索細胞為主,在第1 個月時空泡狀細胞增多,第3 個月后逐漸轉化為以軟骨樣細胞為主,隨著髓核纖維化進展,在第5 個月時殘留在纖維組織的髓核細胞轉化為纖維軟骨樣細胞;隨著退行性變加重,纖維環出現結構排列紊亂,失去同心圓狀規則排列,板層松散、斷裂,纖維化程度加重。見圖3。
2.3 終板組織免疫組織化學染色
免疫組織化學染色結果顯示,PBS 對照近乎陰性表達(圖4a,光密度為0.012 1±0.000 7)。無水乙醇注射后1 個月終板軟骨細胞質內顯示較強陽性ET-1 表達(圖4b,光密度為0.257 3±0.024 1),3 個月時為陽性表達(圖4c,光密度為0.192 2±0.015 5),隨著終板退行性變加劇,軟骨細胞活性降低,第5個月時ET-1 表達下降(圖4d,光密度為0.086 9±0.006 1)。
2.4 軟骨終板細胞ET-1 表達
提取的軟骨終板細胞成功進行了原代和傳代培養,倒置顯微鏡下可見原代細胞12 ~ 24 h貼壁,48 h后細胞開始增殖,約7 d 出現細胞集落,約14 d 鋪滿整個培養皿,細胞形態多樣,從梭形到多邊型不等(圖4e);甲苯胺藍染色可見細胞質有藍色異染出現(圖4f);免疫組織化學染色顯示終板軟骨細胞內ET-1 呈強表達,定位于細胞質內(圖4g、h)。
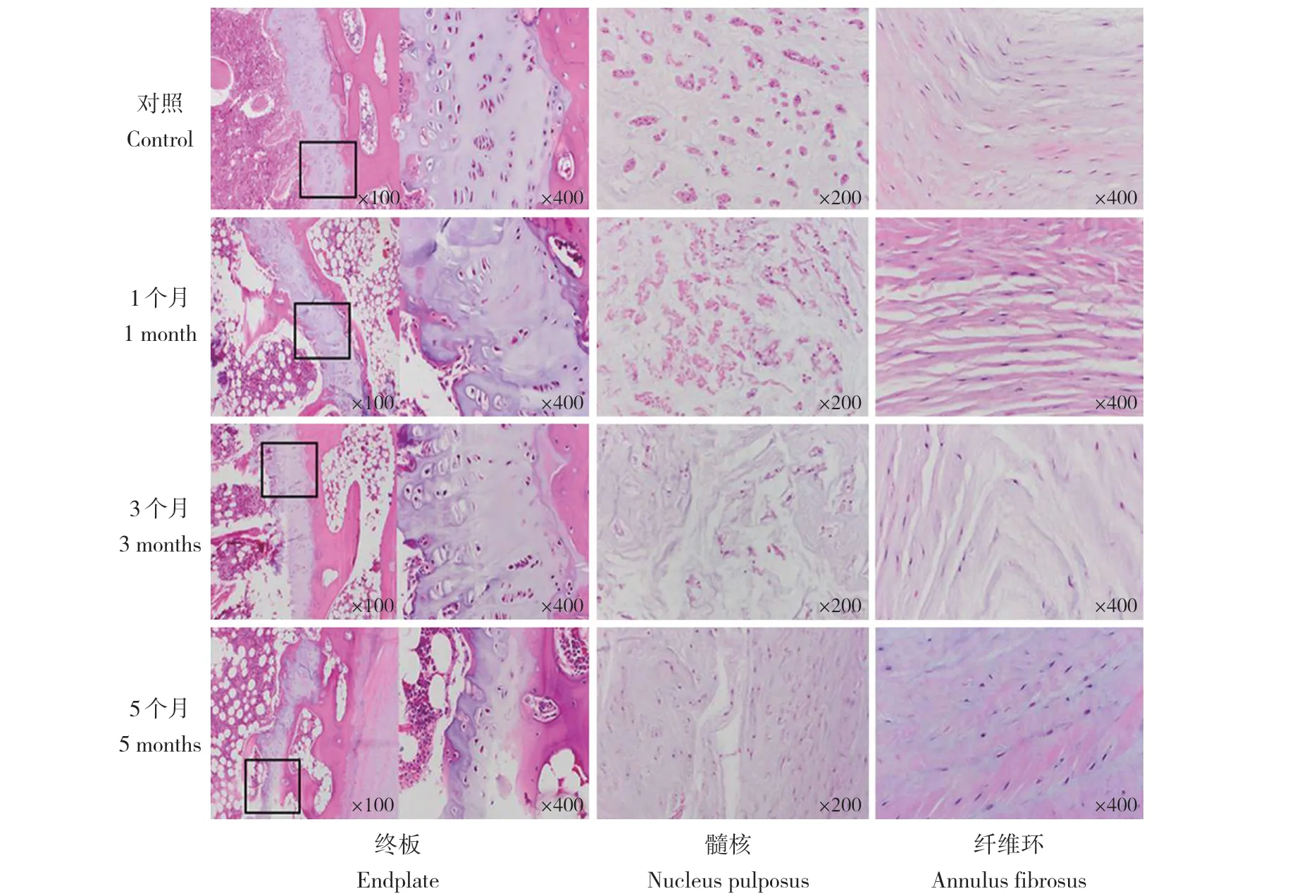
圖 3 注射無水乙醇后腰椎終板、髓核和纖維環退行性變的病理學變化(HE 染色)Fig. 3 Pathological changes of lumbar endplate,nucleus pulposus and annulus fibrosus degeneration after injection of absolute ethanol(HE staining)
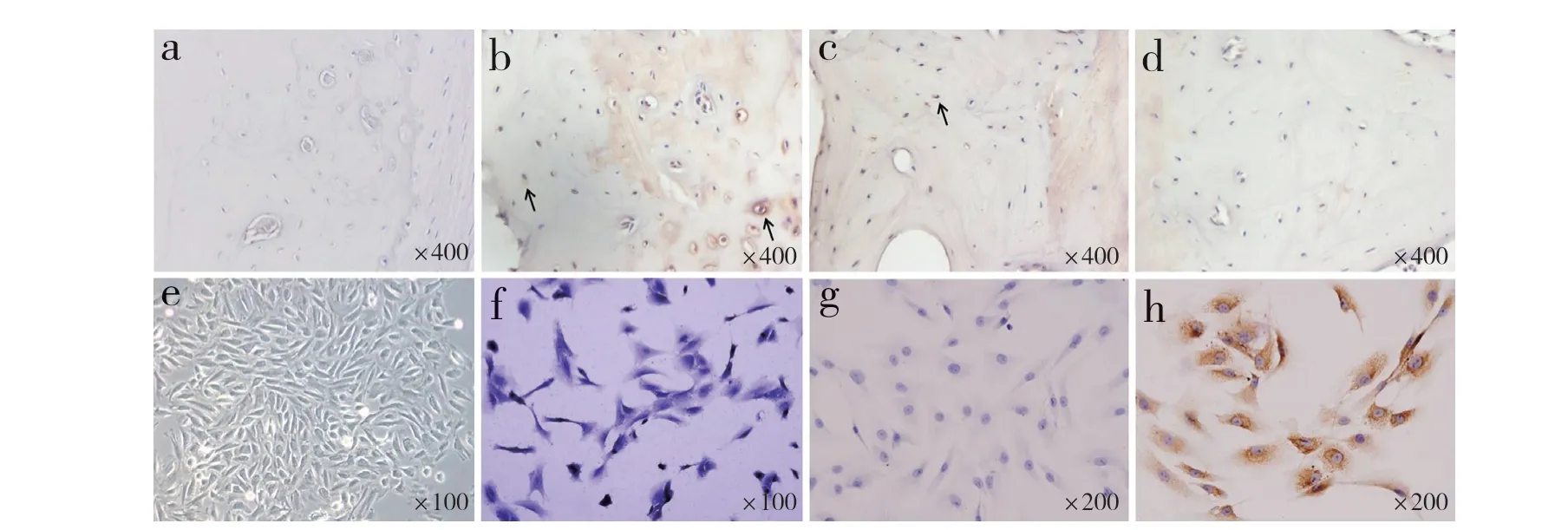
圖 4 免疫組織化學染色結果Fig. 4 Immunohistochemical staining results
3 討 論
椎間盤是脊柱運動功能單位中的關鍵結構,在解剖上分為終板、髓核和纖維環3 個部分,由于其解剖結構特殊,易發生退行性病變。有研究[13-15]顯示,其發生機制包括椎間盤營養供應障礙,炎癥介質的釋放,細胞凋亡、老化和死亡,降解酶活性增高而抑制因子降低,遺傳因素等。上、下終板位于髓核的兩端,具有防止髓核突入椎體、控制椎間盤營養滲透和承接緩沖負荷的作用,對維持椎間盤內的正常形態和生理功能具有重要意義。營養物質供應障礙是導致椎間盤退行性變的關鍵因素。營養供應減少后髓核內代謝產物排出出現障礙,伴隨降解基質酶活性增高,損傷髓核細胞,髓核處于酸性較高的環境,這種連鎖反應導致退行性變進一步加劇。同時,椎間盤營養供應減少會導致椎間盤細胞數量下降,進而細胞外基質(蛋白多糖和Ⅱ型膠原)進行性減少,引起椎間盤退行性變[16-18]。此外,有研究顯示,異常應力作用可使終板發生硬化、鈣化及骨化,椎間盤營養供給被阻斷,必然也造成其退行性變[19]。因此,要修復發生退行性變的椎間盤,首先要從病因學上了解退行性變過程及機制,其中最好的辦法是模擬椎間盤退行性變的自然病程,從形態學、細胞學及生物化學等多角度進行相關研究,進而有的放矢地進行干預治療。
學者們從終板損傷的角度對椎間盤退行性變模型的建立進行了一定的探索。Holm等[20]使用3.5 mm鉆頭損傷豬的腰椎終板,鉆頭尖部進入髓核內,3個月后纖維環前后部均發生退行性變,并且纖維環含水量和髓核蛋白多糖含量明顯減少,證實終板損傷可致椎間盤退行性變發生。該模型的缺點是終板損傷的同時髓核暴露于機體免疫系統,可能激發一系列自身免疫反應,難以判斷椎間盤退行性變是由終板損傷還是髓核損傷引起。Iwahashi 等[21]通過被動吸煙的方法誘導兔椎間盤退行性變,證實尼古丁可使椎體-終板附近血管芽的密度降低、管腔變窄,最終導致蛋白多糖和膠原的合成降低。Hutton 等[22]利用骨水泥阻斷一側或雙側軟骨終板的血供建立犬腰椎椎間盤退行性變模型,但經過70 周的觀察,椎間盤并未出現退行性變,分析其原因為骨水泥沒有注射到合適的部位,并沒有阻斷椎間盤的終板營養供給途徑,研究顯示,阻斷終板營養供應途徑應選擇在中央區,因為終板中央區和全部的纖維環對于小分子是滲透性的,而終板接近椎體周緣的外側區域是非滲透性的,滲透性得益于骨性終板血管芽的存在,而在終板中央區血管芽更為密集。上述研究證實,阻礙椎體-終板營養途徑可使椎間盤發生退行性變,但造模方法也存在明顯的不足,不能有效推廣應用。
本研究嘗試通過終板下椎體內注入醫用無水乙醇阻礙椎體-終板營養供應途徑制作一種新的椎間盤退行性變動物模型。無水乙醇注射入椎體后導致終板下血供障礙,首先出現終板退行性變,進而影響椎間盤營養供應。組織學染色結果發現,終板的生長板逐漸變薄,生長板是軟骨終板細胞密集排列的部位[23],該部位變薄表明終板退行性變加重并逐漸喪失自我修復的能力。隨著終板結構的退行性變、破壞,軟骨終板骨化程度增加,進而椎間盤營養供給減少,髓核內細胞數量及分泌的細胞外基質也發生變化,髓核內細胞增殖能力趨于降低,細胞也發生轉化,已有報道顯示髓核內細胞從脊索細胞向軟骨樣細胞方向轉化是椎間盤退行性變的表現[24-25]。通過對造模后椎間盤進行影像學、形態學和組織學觀察和檢測,結果顯示符合椎間盤自然退行性變過程,此模型適合于椎間盤退行性變的病因學研究,為未來臨床干預治療奠定了理論基礎。
本研究還發現,ET-1 存在于發生退行性變的椎間盤終板中,并且被終板軟骨細胞分泌。注射無水乙醇后1 個月時細胞質內ET-1 陽性表達,隨著終板退行性變加劇,軟骨終板細胞活性降低,后續ET-1表達下降。有研究[6]證實ET-1與人椎間盤終板退行性變相關。針對ET-1 在椎間盤退行性變中的作用,可嘗試在椎間盤退行性變的早期階段通過鄰近終板的椎體內注射ET-1 受體阻斷劑以減弱或阻斷其作用,觀察是否延緩或逆轉椎間盤退行性變進程,這為修復退行性變椎間盤開拓了新的方向。
受實驗條件所限,本研究未對兔椎間盤退行性變過程中終板鈣化/骨化情況進行具體評估。后續實驗將通過注射染料量化分析毛細血管閉塞情況與終板退行性變的相關性,并通過熒光標記物追蹤小分子物質的滲透能力,進一步評估終板退行性變對椎間盤的影響。

