晚期肺肉瘤樣癌1例及文獻復習
陳樂 陳飛宇 胡福安 王鵬 杜進臣 王占鵬 李慶新△
1)寧夏醫(yī)科大學研究生院 銀川 750004 2)中國人民解放軍聯(lián)勤保障部隊第940醫(yī)院普胸外科 蘭州 730050
肺肉瘤樣癌(PSC)是一種以肉瘤樣為主、低分化罕見的非小細胞肺癌(NSCLC),占肺原發(fā)性惡性腫瘤的0.1%~0.4%,惡性程度高,高度侵襲性,預后差,無特異型臨床表現(xiàn),就診時多數(shù)已屬晚期[1]。現(xiàn)結合文獻復習對我科近期收治的1例PSC患者的臨床資料進行分析,以提高對該疾病的認識。
1 病例資料
患者男性,56歲。因“反復咳嗽、胸痛、呼吸困難3月伴痰中帶血1周”于2019年5月24日入院。長期吸煙,20支/d,約40 a。2019年5月24日胸部CT(圖A、B)示:右肺上葉實變影內(nèi)可見空洞形成。查體:體溫36.8℃,脈搏74次/分,呼吸24次/分,血壓92/61 mmHg。全身淺表淋巴結未觸及,右胸腔閉式引流管內(nèi)水柱波動大,引出不凝固的血性液體。右肺呼吸運動減弱,語顫及語音傳導減弱。右下肺叩診濁音,右上肺叩診鼓音,聽診右肺呼吸音弱。2019年5月28日再次復查胸部CT(圖C、D)示:右肺上葉腫塊影,與胸膜粘連,其內(nèi)可見3.5 cm×2.2 cm的空洞,右側胸腔可見引流管影。頭顱MRI掃描(圖E、F)示:雙側額葉及右側小腦半球多發(fā)結節(jié)影,考慮轉移瘤。心超、心電圖無異常。血尿糞常規(guī)、腎功能、電解質(zhì)無異常。肝功能:白蛋白23.7 g/L、總蛋白46.9 g/L。痰抗酸桿菌陰性,痰培養(yǎng)正常菌群生長。結核桿菌特異性細胞免疫反應為陰性。腫瘤標志物檢查:SCC、Pro-GRP、CEA均正常,細胞角蛋白19片段(CYFRA21-1)10.75 ng/mL。2019年5月30日在全麻下行單孔胸腔鏡胸膜組織活檢術。術中見:右側胸腔內(nèi)臟層及壁層胸膜彌漫性增厚,胸膜、肺、心包及膈肌表面可見彌漫的結節(jié),質(zhì)脆,觸之易出血。術中剖開標本見:灰白、灰紅色組織。術中快速冰凍切片檢查:(右側胸膜)間葉源性惡性腫瘤,待石蠟明確診斷。術后病理診斷:肺低分化癌(肉瘤樣癌),并累及胸膜及膈肌。癌組織梭形細胞構成,呈束狀排列,細胞深染,異型性明顯(圖G、H、K、J)。免疫組化:CKp(+),Ki-67(+)60%,CK5/6(-),TTF-1(+),SMA(CR),CD34(+),CD163(+),CD68(+),Desmin(-),S100(-),Bcl-2(-),EMA(+),napsin-A(-),P63(-),Calretinin(-),MC(-),WT-1(-)。患者術后恢復順利,術后給予“TP”方案聯(lián)合化療2次,3個月后死亡。
2 討論及文獻復習
肉瘤樣癌1864年由Virchow最早報道并提出。1992年Ro等[2]建議采用肉瘤樣癌命名這類腫瘤。在2004年WHO中PSC被定義為含有肉瘤及肉瘤樣成分的分化差的非小細胞肺癌,可分為多形性癌、梭形細胞癌、巨細胞癌、癌肉瘤和肺母細胞瘤5個亞型。多形性癌(PC)是一種低分化非小細胞肺癌(鱗狀細胞癌、腺癌或大細胞癌),含有至少10%的梭形細胞和(或)巨細胞,或完全由梭形細胞和巨細胞組成的癌,是最多見的亞型。梭形細胞癌(SCC)僅由梭形細胞組成的非小細胞肺癌。巨細胞癌(GCC)完全由巨細胞組成。肺母細胞瘤(PB)是一種具有原始上皮成分和原始間質(zhì)的雙相腫瘤,由原始上皮和原始間葉組成,原始上皮成分主要為低級別胎兒型腺癌,部分可出現(xiàn)高級別胎兒型腺癌或完全分化的腺癌。肺癌肉瘤(CS)是一種混合的惡性腫瘤,包括非小細胞癌(鱗癌、腺癌、腺鱗癌和大細胞癌)和含有肉瘤成分(如橫紋肌肉瘤、惡性軟骨瘤或骨肉瘤)混合存在的肉瘤。多形性癌多見,其次是梭形細胞癌和癌肉瘤。PSC多見于中老年患者,男女發(fā)病率為4∶1,長期吸煙者多見[3]。有文獻報道吸煙可能與肺肉瘤樣癌的發(fā)生有關,但吸煙對預后并無明顯影響[4]。PSC患者的臨床癥狀無特異性,臨床癥狀與腫瘤的位置對周圍組織刺激有關。根據(jù)腫瘤位置分為中央型和周圍型。中央型多以咳嗽、咳痰伴痰中帶血為主要表現(xiàn);周圍型以胸痛、胸腔積液等表現(xiàn)為主,多因侵犯胸膜及胸壁出現(xiàn)疼痛。肺肉瘤樣癌惡性程度高,生長迅速,多數(shù)患者就診時已屬局部晚期或遠處轉移,常見的轉移部位有腦、骨、腎上腺、肝[5],少數(shù)也可轉移到食管、空腸、直腸、胰腺、心、腎、皮膚等[6]。PSC也可侵犯胸膜、胸壁。該患者以咳嗽、痰中帶血、胸痛為主要臨床表現(xiàn),腫瘤位于右肺上葉,約3.5 cm×2.2 cm,已侵犯胸膜、膈肌,顱腦轉移,與文獻報道一致[7]。
PSC影像學表現(xiàn)無明顯特異性。胸部CT平掃可見腫瘤邊緣界限不清,可有毛刺或分葉,增強CT可見腫瘤邊緣不規(guī)則環(huán)形或斑片狀強化[8-10];胸壁侵犯和(或)胸腔積液征象[7]。本病例胸部CT顯示右肺上葉實變影內(nèi)可見空洞形成,右側胸腔內(nèi)可見液氣胸,未行增強掃描,與上述報道一致。有文獻報道PSC比NSCLC在PET-CT中有更高的平均SUVmax值[11]。故可以考慮行PET-CT為確定腫物性質(zhì)提供參考,但因PET-CT費用昂貴,臨床應用較為困難。
PSC主要依靠病理學和免疫組織化學診斷。PSC中帶有上皮細胞成分和間質(zhì)細胞成分。PSC的免疫組化檢測主要為上皮生物學標記物和間質(zhì)細胞生物學標記物。上皮生物學標記物主要為細胞角蛋白(cytokeratin,CK)、上皮細胞抗原(EMA)、甲狀腺轉錄因子1(TTF-1)、細胞角蛋白5/6(CK5/6)、P40等。間質(zhì)細胞生物學標記物主要為波形蛋白(vimentin)、結蛋白(desmin)等[12-13]。PSC中可出現(xiàn)上皮標記物及間質(zhì)標記物均呈陽性表達[13]。CD31和CD34免疫組織化學染色顯示腫瘤組織中有豐富的微血管,提示腫瘤血管生成活躍。本例免疫組化檢查顯示,TTF-1、CD34、CD163、CD68均呈陽性表達,Ki-67陽性細胞數(shù)60%,與文獻報道一致[12-13]。

2019-05-24 圖A縱隔窗:右肺上葉實變影內(nèi)可見空洞形成、右側胸腔積液。圖B肺窗:右肺上葉實變影內(nèi)可見空洞形成。


2019-05-28 圖C縱隔窗:右肺上葉腫塊影,與胸膜粘連,其內(nèi)可見空洞形成,大小約3.5 cm×2.2 cm。圖D肺窗:右肺上葉腫塊影,與胸膜粘連,其內(nèi)可見空洞形成,大小約3.5 cm×2.2 cm。

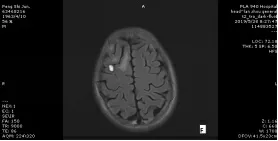
圖E、圖F為顱腦MRI檢查提示:雙側額葉及右側小腦半球見多發(fā)結節(jié)影,T1WI呈高、低混雜信號,T2WI邊緣可見環(huán)形高信號,中心亦呈囊狀高、低混雜信號,較大者直徑約1.2cm,DWI呈高信號,周圍見斑片狀水腫信號影,增強掃描后可見輕度不均勻強化。



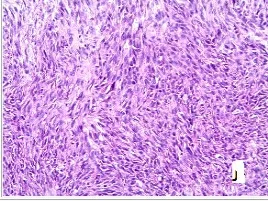
圖G、H、K、J所示為病理HE染色示:腫瘤細胞呈梭形細胞構成,呈束狀排列,嗜酸性,細胞深染,異型性明顯(HE 染色 ×40)。
早期手術是PSC首選的治療方法,術后給予以鉑類為基礎的聯(lián)合化療。新輔助化療或術后輔助化療對患者的遠期生存期并無明顯延長。Martin等[14]報道早期PSC患者的中位生存期為11.54個月,1 a生存率為92%,2 a、3 a、5 a生存率分別為30%、25%、21%。晚期PSC患者應用吉西他濱聯(lián)合順鉑(GP)或紫杉醇聯(lián)合順鉑(TP)方案化療,其客觀緩解率及中位生存時間與同期的NSCLC并無明顯差異,其中位總生存期為6個月[15-16]。顧海艇[17]等研究稱腫瘤大小、有無淋巴結轉移、有無遠處轉移、TNM分期及早期手術是影響患者預后的因素。近年來,有研究報道PSC中以KRAS、TP53、EGFR突變多見。但PSC患者的EGFR突變率低,報道1例PSC術后患者出現(xiàn)復發(fā),EGFR外顯子缺失,接受吉非替尼治療,獲得了35個月的完全緩解[18]。也有1例ALK陽性的PSC患者接受了克唑替尼的治療,獲得了2.4個月的完全緩解。有文獻報道PD-L1在PSC中的表達明顯高于非小細胞肺癌[19]。Hey等[20]比較PD-L1在原發(fā)腫瘤和轉移復發(fā)后的表達,發(fā)現(xiàn)PD-L1在轉移部位的表達是原發(fā)灶的2倍,通過阻斷程序性死亡蛋白-1(programmed cell death 1,PD-1)及其配體 1(PD-1 ligand,PD-L1)構成的PD-1/ PD-L1通路,重現(xiàn)激活機體免疫系統(tǒng)對腫瘤的殺傷作用,已成為一種新的治療方法[21]。報道1例PD-L1高表達并接受了帕博利珠單抗(pembrolicumab)作為二線治療的患者,部分緩解的時間為7個月。該患者未行任何治療,3個月后死亡。
PSC是一種罕見的侵襲性高、預后差的非小細胞肺癌,預后與腫瘤大小、淋巴結是否轉移、有無遠處轉移、TNM分期及早期手術等因素有關[17]。早期治療多以手術切除和圍手術期放化療為主。PSC對放化療均不敏感,對不能手術或術后患者,可行輔助放化療或靶向治療,以延長生存期。隨著分子生物學的發(fā)展,靶向藥物和免疫治療會使該病患者受益。因此,臨床醫(yī)師應提高對本病的認識,做到早發(fā)現(xiàn)、早診斷、早治療,以降低其病死率。

