發酵法提取青稞麩皮中β葡聚糖的工藝優化及其理化性質研究
劉新琦,何先喆,劉潔純,唐慶九,顧飛燕,俞 苓,*
(1.上海應用技術大學香料香精技術與工程學院,上海 201418;2.上海市農業科學院食用菌研究所,上海 201403;3.上海宏度精細化工有限公司,上海 201108)
青稞(Hordeumvulgare)為禾本科植物,大麥屬[1],具有高蛋白質、高膳食纖維、低脂、低糖等特點[2]。青稞由于富含豐富的β-葡聚糖而備受國內外學者的關注[3]。有研究表明β-葡聚糖具有調節血糖[4]、提高免疫力[5-6]、抗腫瘤、抗病毒[7]等功效,除此之外其還具有良好的保濕性[8],可用作保濕化妝品添加劑[9]。
β-葡聚糖常用的提取工藝主要分為三類,分別為水提法[10]、堿提法[11]和酸提法[12]。水提法易操作且提取條件溫和,但β-葡聚糖得率低[13];酸提和堿提法雖使得率有所提高,但要嚴格控制實驗pH,而且實驗過程中產生大量熱量使實驗難度增加[14]。有報道在傳統水提工藝的基礎上利用超聲-微波協同[15]、超高壓[16]等對提取工藝進行優化,可以進一步提高得率,但這些提取方法獲得的β-葡聚糖需要進一步純化[17],實驗步驟較長。發酵法提取青稞麩皮β-葡聚糖,利用酵母菌豐富的酶系統,消耗青稞麩皮中的淀粉和蛋白質,有效釋放青稞麩皮中β-葡聚糖。另外,由于酵母生長過程中不消耗發酵液中的β-葡聚糖,同時還能利用還原糖、蛋白質等其他物質作為營養物進行生長,從而達到對β-葡聚糖去雜純化的效果[18],且提高β-葡聚糖得率。目前發酵法提取β-葡聚糖的報道只見于燕麥[19],尚未見發酵法提取青稞β-葡聚糖。因此本文研究了發酵法提取青稞β-葡聚糖,并通過單因素和正交試驗對其工藝條件進行優化,并對得到的青稞β-葡聚糖進行分離、純化以及理化性質分析,為青稞β-葡聚糖的開發利用提供科學基礎。
1 材料與方法
1.1 材料與儀器
青稞麩皮 市售;高活性干酵母、釀酒干酵母、啤酒干酵母、葡萄酒干酵母 均為安琪酵母有限公司,屬釀酒酵母(Saccharomycescerevisiae)類的不同類產品;β-葡聚糖標準品、無水葡萄糖、牛血清蛋白、酪蛋白、剛果紅、無水乙醇、考馬斯亮藍G250、三氯乙酸、活性炭、硅藻土、碘試液 均為國產分析純,國藥(上海)化學試劑有限公司;標準單糖:D-半乳糖、D-葡萄糖、D-阿拉伯糖、L-巖藻糖、L-鼠李糖、D-甘露糖、D-木糖、三氟乙酸 美國Sigma公司。
L530型離心機、FD50冷凍真空干燥機、旋轉蒸發儀 湘儀儀器公司;UV210紫外分光光度計 棱光技術公司;HPLC MALLS索映儀器設備公司;Waters 2695型高效液相色譜儀、VETEX 70紅外光譜 美國Waters;DMAX-20射線衍射儀 美國TA;ICS2500離子色譜儀 Dionex公司;SK-GEL系列凝膠色譜柱G6000PWXL、G4000PWXL(7.8 mm×300 mm) TOSOH。
1.2 實驗方法
1.2.1 發酵法提取青稞麩皮β-葡聚糖 青稞麩皮糊化液的制備:青稞麩皮經干燥、粉碎后過100目篩,將粉碎后的青稞麩皮粉末以一定的料液比加入一定量的水,58 ℃糊化20 min制成青稞糊化液。市售干酵母活化:將市售干酵母加入2%葡萄糖溶液,32 ℃,水浴20 min進行活化。在接菌發酵之前對青稞糊化液進行高溫滅菌121 ℃,20 min[20]。
將青稞糊化液與活化過的活性干酵母混合攪勻,放入搖床,設置搖床轉速110 r/min進行振蕩發酵。經發酵后將發酵液放入離心機,設置轉速4000 r/min離心10 min,收集上清液,緩慢加入3.5倍體積分數為85%的乙醇,并于4 ℃冰箱里醇沉多糖4 h,收集沉淀進行真空冷凍干燥,得到青稞β-葡聚糖粗品。將青稞β-葡聚糖粗品配制成10 mg/mL的溶液,加入5%活性炭,于45 ℃水浴下20 min,再將硅藻土均勻鋪在濾紙上,抽濾除去溶液中的活性炭,收集濾液。將濾液旋轉蒸發濃縮至原體積的1/3,通過真空冷凍干燥得到青稞β-葡聚糖粉末。真空冷凍干燥條件:冷凍溫度為-85 ℃,真空度為0.95 Pa。
1.2.2 水提法提取青稞麩皮β-葡聚糖 參考董磊[21]關于水提青稞β-葡聚糖條件的優化方法并加以改進。工藝流程如下:料液比1∶22在52 ℃下提取3 h;4000 r/min離心10 min后取上清液后同1.2.1中實驗方法,得到水提β-葡聚糖產品。
1.2.3β-葡聚糖含量測定及得率計算 根據剛果紅法[22]測定β-葡聚糖含量,配制1 mg/mL的β-葡聚糖標準品溶液冷藏待用,將剛果紅溶解于pH8.0的磷酸緩沖液中,配制0.1 mol/L的剛果紅溶液。將β-葡聚糖標準品溶液稀釋為20、40、60、80、100μg/mL,分別取2 mL不同濃度β-葡聚糖標準品溶液加4 mL剛果紅溶液,25 ℃水浴30 min,以2 mL蒸餾水加4 mL剛果紅溶液為空白對照,于545 nm處測定吸光值。吸光值與β-葡聚糖標品含量的線性方程為y=2.83x-0.002(R2=0.9966)。 式中縱坐標y代表吸光度值,橫坐標x代表β-葡聚糖含量(μg/mL)。將冷凍干燥后的β-葡聚糖粉末溶于蒸餾水中,配成1 mg/mL的β-葡聚糖溶液,測定吸光值,計算β-葡聚糖含量,再按以下公式計算β-葡聚糖得率和純度。
青稞β-葡聚糖得率(%)=β-葡聚糖粉末的質量/青稞麩皮粉的質量×100
式(1)
青稞β-葡聚糖純度(%)=β-葡聚糖粉末中β-葡聚糖的質量/β-葡聚糖粉末質量×100
式(2)
1.2.4 蛋白質含量的測定 以牛血清蛋白為標準樣,用考馬斯亮藍法[23]繪制蛋白質標準曲線。配制0.1 mg/mL的蛋白質標準溶液冷藏待用;稱取10 mg考馬斯亮藍G250,加5 mL95%乙醇溶解,再加入10 mL 85%磷酸溶液,最后用蒸餾水定容至100 mL,置于棕色瓶中備用。將蛋白質標準溶液稀釋為20、40、60、80、100 μg/mL,分別取1 mL不同濃度蛋白質標準溶液加5 mL考馬斯亮藍G250溶液混勻,常溫靜置10 min,以1 mL蒸餾水加5 mL考馬斯亮藍G250溶液為空白對照,于595 nm處測定吸光值。吸光值與蛋白質含量的相關性方程為y=8.7171x+0.0225(R2=0.9976),將冷凍干燥后的β-葡聚糖粉末溶于蒸餾水中,配成1 mg/mL的β-葡聚糖溶液,測定吸光值,通過測定樣品吸光度值可計算得蛋白質含量。

式(3)
1.2.5 單因素實驗 固定基本條件為接種量0.05%(酵母/麩皮,g/g),料液比1∶5,發酵時間36 h,發酵溫度32 ℃。研究不同菌種(高活性干酵母、釀酒干酵母、啤酒干酵母、葡萄酒干酵母)、接種量(0.01%、0.03%、0.05%、0.07%、0.09%)、料液比(1∶3、1∶4、1∶5、1∶6、1∶7)、發酵溫度(28、30、32、34、36 ℃)、發酵時間(6、12、18、24、36、42、48 h)等因素對青稞麩皮β-葡聚糖得率的影響。
1.2.6 正交優化試驗 根據單因素實驗結果,選擇料液比(A)、接種量(B)、發酵時間(C)進行L9(33)正交試驗,優化發酵法提取青稞麩皮β-葡聚糖的工藝,因素水平的選擇見表1。

表1 發酵法提取β-葡聚糖正交試驗因素水平表Table 1 Factors and levels table of orthogonal test for extracting β-glucan by fermentation method
1.2.7β-葡聚糖分子量的測定 參考文獻[24-26]通過HPSEC-MALLS-RI聯用分析發酵法優化工藝制備的樣品和1.2.2實驗所得到的兩個樣品的分子量分布。分別稱取兩種樣品5 mg于1 mL流動相,過0.22 μL的水相微孔膜,上樣分析。實驗通過Waters2695型高效液相色譜儀連接MALLS、RI System。TSK-GEL系列凝膠色譜柱G6000PWXL、G4000PWXL串聯使用,柱溫30 ℃,進樣量100 μL,流動相為0.15 mol/L 的硝酸鈉和0.05 mol/L 磷酸二氫鈉(pH=7,0.02%疊氮鈉),流速0.5 mL/min進行等度洗脫分析。8角度激光光散射儀的光源波長選用623.8 nm,溶液中多糖折光指數增量(dn/dc)為0.146 mL/g進行計算。使用Astra(6.1.1版)進行數據分析軟件收集和分析光散射數據,計算分子量。
1.2.8 單糖組成的測定 采用高效陰離子交換色譜分析法對所得的樣品進行單糖組成測定[27-29]。稱取2 mg樣品溶于3 mL濃度為2 mol/L的三氟乙酸,加入反應瓶中。然后放置在110 ℃油浴中水解3 h。冷卻至室溫,加入3 mL甲醇,用氮氣在 40 ℃下吹干,重復4~5次以完全除去三氟乙酸。將反應瓶中的樣品用超純水定容至25 mL待測。標準品:L-海藻糖、L-鼠李糖、D-阿拉伯糖、D-氨基葡萄糖、D-半乳糖、D-葡萄糖、D-木糖、D-甘露糖、D-果糖、D-半乳糖醛酸、D-葡糖醛酸混標。實驗采用帶脈沖安培檢測器的ICS2500 離子色譜儀,連接陰離子交換分析色譜柱Carbo PacTMPA20(3 mm×150 mm),2.5 mmol/L的NaOH溶液和超純水為流動相,流速為0.45 mL/min,上樣量25 μL,柱溫為30 ℃,進行等度洗脫分析。
1.3 數據分析
本研究中的試驗均重復進行3次,運用Microsoft Excel 2003、Origin 8.0和SPSS 18.0數據處理軟件對實驗數據進行整理、圖表繪制和顯著性分析(以P<0.05為差異有統計學意義),實驗結果采用平均值±標準差表示。
2 結果與分析
2.1 不同酵母菌發酵對青稞麩皮β-葡聚糖提取效果的影響
運用四種活性干酵母發酵獲得的β-葡聚糖得率結果如圖1。結果發現,發酵法獲得β-葡聚糖的得率均較水提法高,這是由于酵母中含有豐富的酶系統,使青稞麩皮中的β-葡聚糖更好地溶解出來,四種酵母中高活性干酵母發酵得率最高,β-葡聚糖得率為4.78%±0.03%,較水提法高47.53%,因此選取高活性干酵母為發酵菌種。

圖1 不同酵母菌對β-葡聚糖得率的影響Fig.1 Effects of different yeasts on extraction yield of β-glucan注:不同大寫字母表示差異顯著(P<0.05),圖2~圖5同。
2.2 發酵法提取青稞β-葡聚糖單因素實驗
2.2.1 料液比對青稞麩皮β-葡聚糖提取效果的影響 隨著料液比的提高,β-葡聚糖的得率先增加后穩定(圖2),料液比太小時β-葡聚糖無法充分溶解,料液比增大后得率也隨著增大;當料液比為1∶5時,β-葡聚糖得率為4.98%±0.03%,與料液比為1∶6、1∶7結果無顯著性差異(P>0.05),但顯著高于料液比1∶3、1∶4(P<0.05),根據液固相萃取的基本理論,增大料液比有利于溶質的溶出,但是過大的料液比不僅增加了水的消耗,而且增高了后續的濃縮成本[30],因此選取料液比1∶5。
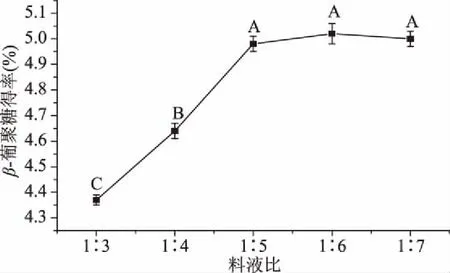
圖2 料液比對β-葡聚糖得率的影響Fig.2 Effects of ratio of material to liquid on extraction yield of β-glucan
2.2.2 接種量對青稞麩皮β-葡聚糖提取效果的影響 接種量為0.01%~0.05%時,β-葡聚糖得率快速增加(圖3),接種量為0.05%時,β-葡聚糖得率為4.48%±0.04%,與接種量為0.07%、0.09%無顯著性差異(P>0.05),但顯著高于接種量為0.01%、0.03%(P<0.05),這是由于0.05%接種量已經使發酵液達到飽和,雖然增加接種量β-葡聚糖還在不斷析出,但是對實際生產意義不大,因此選擇接種量為0.05%。
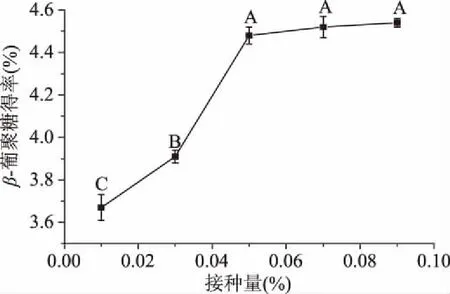
圖3 接種量對β-葡聚糖得率的影響Fig.3 Effects of inoculation amount on extraction yield of β-glucan
2.2.3 發酵時間對青稞麩皮β-葡聚糖提取效果的影響 隨著發酵時間的延長,β-葡聚糖的得率先增加后趨于平緩(圖4),發酵時間為36 h時,β-葡聚糖得率為4.88%±0.03%,與42、48 h試驗結果無顯著性差異(P>0.05),但顯著高于發酵時間為6、12、18、24 h(P<0.05)。這是由于在前18 h內酵母大量繁殖,利用自身酶系統通過發酵分解纖維素,到36 h時反應幾乎完全,因此選取36 h為最適發酵時間。并且在36 h時通過淀粉碘試實驗[28],發酵液未使得碘液變色,說明淀粉已被消耗完,規避了后續除淀粉的操作步驟。

圖4 發酵時間對β-葡聚糖得率的影響Fig.4 Effects of fermentation time on extraction yield of β-glucan
2.2.4 發酵溫度對青稞麩皮β-葡聚糖提取效果的影響 隨著發酵溫度在28~36 ℃升高,β-葡聚糖的得率先升高后略有下降(圖5)。在32 ℃條件下獲得的β-葡聚糖得率為4.76%±0.04%,與在34和36 ℃之間無顯著性差異(P>0.05),但顯著高于28、30 ℃(P<0.05),這可能的原因是在32 ℃時酵母內環境較穩定,新陳代謝所需的酶活性達到較高水平[31],因此選取32 ℃為最適發酵溫度。
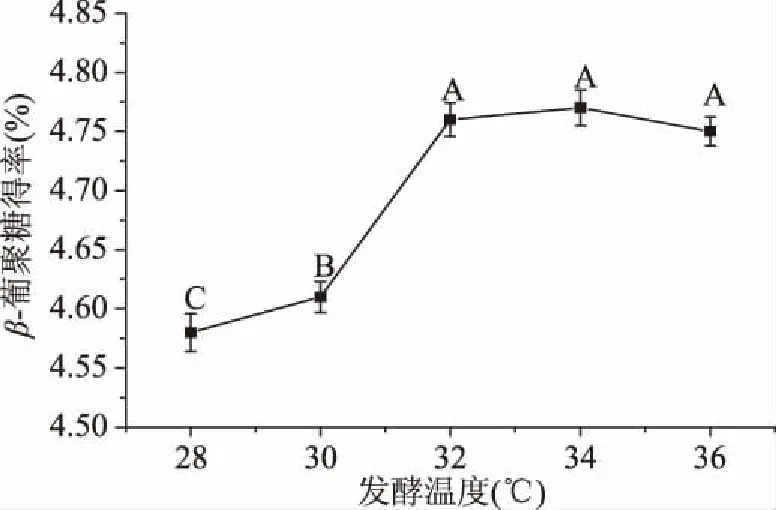
圖5 發酵溫度對β-葡聚糖得率的影響Fig.5 Effects of fermentation temperature on extraction yield of β-glucan
2.3 正交試驗結果分析
基于單因素實驗,進一步進行正交試驗,結果見表2。由表2極差分析可知,影響因素強弱順序為發酵時間>料液比>接種量。青稞β-葡聚糖提取的最佳工藝條件是A3B2C1,即提取效果最佳條件為料液比1∶6,接種量0.05%,發酵時間34 h。方差分析結果見表3,由表3也可以看出,影響青稞β-葡聚糖得率的三個因素排序為發酵時間、料液比和接種量,這與表2分析結論是一致的。通過實驗驗證最佳條件,結果顯示發酵法提取的青稞β-葡聚糖的得率平均為5.21%±0.02%,優化條件可行。
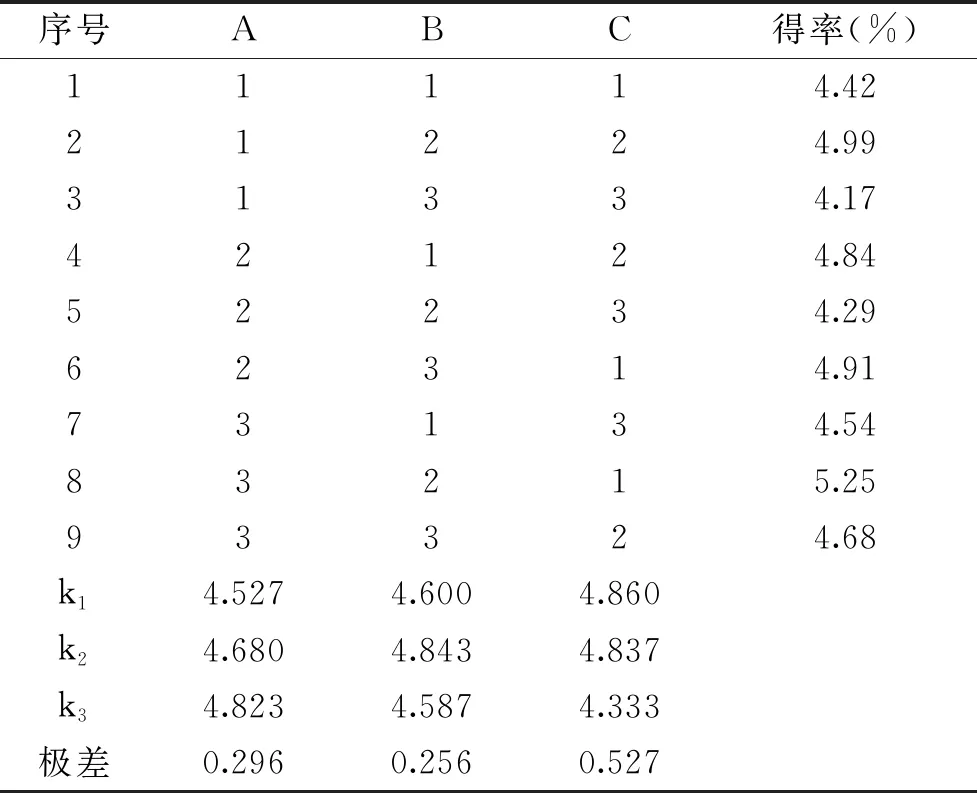
表2 發酵法提取β-葡聚糖正交試驗表及實驗結果Table 2 Orthogonal test table and experimental results of extraction of β-glucan by fermentation method

表3 方差分析表Table 3 Analysis of variance
2.4 發酵法提取β-葡聚糖的理化分析
2.4.1β-葡聚糖的保留率與純度 比較了發酵法與水提法獲得的青稞β-葡聚糖的保留率和蛋白質清除率,其結果見表4。發酵法得到的β-葡聚糖中含的蛋白質含量明顯低于水提法得到的β-葡聚糖。兩種方法得到的β-葡聚糖經過除蛋白處理后的β-葡聚糖保留率均在70%以上。

表4 活性炭吸附后β-葡聚糖保留率、純度及蛋白質清除率Table 4 β-glucan retention,purity and protein clearance rate after activated carbon adsorption
2.4.2β-葡聚糖分子量的測定 用HPSEC-MALLS-RI聯用法測定2種方法提取的β-葡聚糖分子量分布圖(圖6),運用激光檢測器和 Astra 軟件分析后所得結果為:水提的青稞β-葡聚糖平均分子量為7.759×105,與董磊[21]水提法提取青稞麩皮β-葡聚糖中結果相似;發酵法提取的青稞β-葡聚糖平均分子量為1.366×105,較水提法平均分子量小。

圖6 兩種提取方法得到的β-葡聚糖HPSCE圖譜Fig.6 HPSCE profile of β-glucan obtained by two extraction methods
2.4.3β-葡聚糖的單糖組成分析 標準單糖組成(圖7)與水提法β-葡聚糖單糖組成(圖8)、發酵法β-葡聚糖單糖組成(圖9)相比較發現:水提法提取的青稞β-葡聚糖中具有較多的雜糖,如D-阿拉伯糖、D-半乳糖、D-木糖、D-甘露糖,與文獻[21]中結果相符,其產品需要額外加入除雜工藝;而發酵法提取的青稞β-葡聚糖中主要為D-葡萄糖以及少量D-木糖。
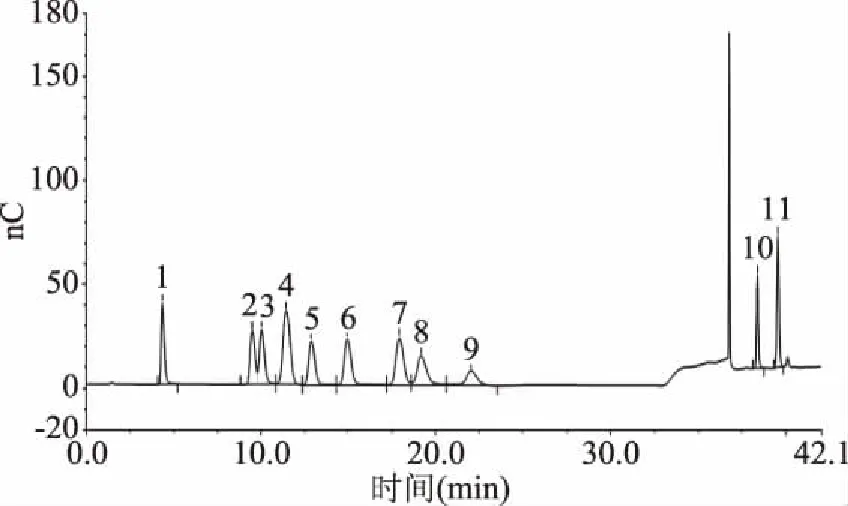
圖7 標準單糖組成Fig.7 Standard monosaccharide composition注:1:L-海藻糖;2:L-鼠李糖;3:D-阿拉伯糖;4:D-氨基葡萄糖;5:D-半乳糖;6:D-葡萄糖;7:D-木糖;8:D-甘露糖;9:D-果糖;10:D-半乳糖醛酸;11:D-葡糖醛酸。
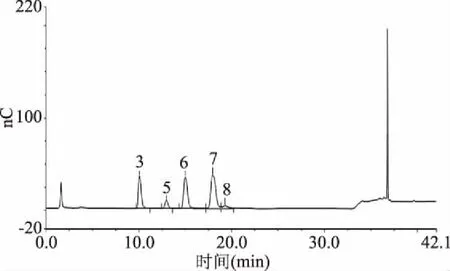
圖8 水提法β-葡聚糖單糖組成Fig.8 Composition of the β-glucan monosaccharide by water extraction

圖9 發酵法β-葡聚糖單糖組成Fig.9 Composition of the β-glucan monosaccharide by fermentation extraction
3 結論
通過單因素和正交實驗得到的發酵法提取β-葡聚糖最佳工藝條件為:高活性干酵母為菌種、接種量0.05%、料液比1∶6,發酵溫度32 ℃,發酵時間34 h,在該條件下β-葡聚糖平均得率為5.21%,與傳統水提法提取的青稞β-葡聚糖相比,得率提高了60.8%。水提法提取的青稞β-葡聚糖單糖組成為D-阿拉伯糖、D-半乳糖、D-葡萄糖、D-木糖以及D-甘露糖。而通過發酵法得到的青稞β-葡聚糖單糖組成主要為D-葡萄糖,且與水提法相比含有更少量的蛋白質,通過活性炭吸附可以清除掉97.81%,純度可達到91.21%。通過理化分析比較發現水提β-葡聚糖平均分子量為7.759×105,發酵法提取的β-葡聚糖平均分子量為1.366×105。

