響應面法優化超聲輔助提取蔓菁多糖工藝及其體外抗氧化性研究
趙 瀅,劉利娥,韓 萍,何志東,趙宵帝
(鄭州大學公共衛生學院營養與食品衛生學教研室,河南鄭州 450001)
多糖是構成生命活動和維持生物功能的四大基本物質之一[1],具有抗腫瘤、抗氧化、提高免疫力、降血糖等生物學作用[2-5]。蔓菁(BrassicarapaL.)又名蕪菁、恰瑪古,是十字花科蕓薹屬兩年生具有藥食兩用價值的草本植物[6],其肉質塊根中多糖含量豐富,是天然植物多糖的理想來源[7-8]。
目前蔓菁多糖的提取工藝主要為水浴提取[9-10],此方法耗時、耗能、提取產物活性低[11],所以需要對現有方法進行優化。新型超聲輔助提取法通過超聲波機械振動產生空化作用促進有效物質與溶劑充分混合,提高傳質速率,減少多糖的降解[12]。響應面法可通過建立數學模型準確找出提取工藝中各影響因素的最佳組合方式,并對多糖得率的最優值進行預測[13]。蔡嘯鏑等[14]使用超聲輔助法提取新疆恰瑪古多糖,與普通水浴提取法相比[15],提取時間縮短了1.41 h,液料比減少了44.33%,省時節能。但此研究并未把超聲溫度這一重要影響因素納入到優化條件當中,所以超聲輔助提取蔓菁多糖工藝還需進一步深入研究。
因此,本文利用響應面優化試驗建立多元回歸方程,以擬合超聲輔助提取過程中各因素與多糖得率之間的相關關系,得到最佳提取條件,多糖含量的測定采用改進的苯酚硫酸法,并對所提取蔓菁多糖的抗氧化性進行研究,旨在為蔓菁多糖進一步開發利用奠定理論基礎。
1 材料與方法
1.1 材料與儀器
蔓菁 購于新鄉市鳳泉區,由鄭州大學潘成學副教授鑒定為蔓菁塊根;正己烷、無水乙醇 分析純,天津市永大化學試劑有限公司;硫酸亞鐵 天津市化學試劑供銷公司;無水葡萄糖(分析標準品,≥98%) 北京索萊寶科技有限公司;30%過氧化氫洛陽昊華化學試劑有限公司;水楊酸 分析純,天津市恒興化學試劑制造有限公司;抗壞血酸 分析純,天津市永大化學試劑有限公司。
KQ-300DE型數控超聲波清洗器 昆山市超聲儀器有限公司;RE-2000型旋轉蒸發器 上海亞榮生化儀器廠;SHB-Ⅲ型循環水式多用真空泵 鄭州長城科工貿有限公司;L420型臺式低速離心機 湖南湘儀實驗室儀器開發有限公司;LGJ-18B型冷凍干燥機 北京四環科學儀器廠有限公司;UV-1601紫外分光光度計 日本島津公司;Spectra Max M2e型多功能微孔板讀數儀 上海美谷分子儀器有限公司。
1.2 實驗方法
1.2.1 蔓菁多糖的提取與精制 將蔓菁塊根洗凈、去皮、切成1 mm薄片、50 ℃烘干、粉碎后過60目篩,于正己烷中回流脫脂,濾渣在通風櫥中干燥過夜。稱取適量脫脂后的蔓菁粉末,按一定液料比加入蒸餾水,在一定超聲功率、一定溫度下提取一定時間,且提取2次,合并濾液后旋轉蒸發濃縮至原體積的1/3,用Sevage法脫蛋白[16],所得上清液每100 mL加入2 g活性炭脫色,60 ℃水浴30 min后抽濾,濾液中加入95%乙醇至醇濃度達80%,4 ℃靜置過夜后離心,沉淀依次用無水乙醇、丙酮、乙醚反復清洗,真空冷凍干燥后即得蔓菁多糖。
1.2.2 單因素試驗
1.2.2.1 液料比對蔓菁多糖得率的影響 稱取5份蔓菁粉末各0.5 g,按液料比20∶1、30∶1、40∶1、50∶1、60∶1 mL/g加入蒸餾水,置于60 ℃水浴中超聲輔助提取50 min,功率為210 W,考察液料比對蔓菁多糖得率的影響。
1.2.2.2 提取溫度對蔓菁多糖得率的影響 稱取5份蔓菁粉末各0.5 g,按液料比40∶1加入蒸餾水,分別置于40、50、60、70、80 ℃水浴中超聲輔助提取50 min,功率為210 W,考察提取溫度對蔓菁多糖得率的影響。
1.2.2.3 提取時間對蔓菁多糖得率的影響 稱取5份蔓菁粉末各0.5 g,按液料比40∶1加入蒸餾水,置于60 ℃水浴中分別超聲輔助提取10、30、50、70、90 min,功率為210 W,考察提取時間對蔓菁多糖得率的影響。
1.2.2.4 超聲功率對蔓菁多糖得率的影響 稱取5份蔓菁粉末各0.5 g,按液料比40∶1加入蒸餾水,置于60 ℃水浴中超聲輔助提取50 min,功率分別為150、180、210、240、270 W,考察超聲功率對蔓菁多糖得率的影響。
1.2.3 響應面優化試驗設計 根據單因素試驗結果,以液料比、提取溫度、提取時間、超聲功率為試驗因素,以蔓菁多糖得率為響應值,運用Design-Expert 8.0.6軟件中Box-Behnken中心組合法則進行4因素3水平的響應面優化試驗,以確定蔓菁多糖的最佳提取條件,試驗4因素3水平編碼見表1。
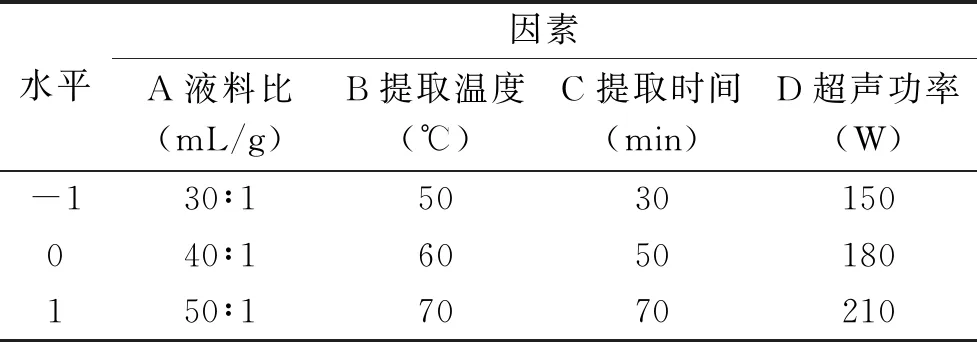
表1 響應面試驗因素與水平Table 1 Factors and levels of response surface methodology
1.2.4 蔓菁多糖得率的測定
1.2.4.1 葡萄糖標準曲線的繪制 精密量取葡萄糖標準液(0.1 mg/L)0、0.2、0.4、0.6、0.8、1.0、1.2、1.6、2.0 mL至25 mL具塞試管中,蒸餾水定容至2.0 mL,分別加入1 mL 5%苯酚溶液和5 mL濃硫酸,混合均勻后靜置10 min,沸水浴加熱15 min,冷卻至室溫,以2.0 mL蒸餾水為空白,于490 nm處測吸光度,以葡萄糖濃度(x)為橫坐標,吸光度(y)為縱坐標繪制標準曲線。所得標準曲線的回歸方程為y=15.5698x-0.0184,R2=0.9988。
1.2.4.2 換算因子的測定 參照吳擁軍等[17]試驗方法,并稍作修改。準確稱取干燥至恒重的蔓菁多糖10 mg,加水定容至100 mL,吸取1 mL,用蒸餾水定容至2 mL,按照1.2.4.1中的步驟顯色并測其吸光度,根據標準曲線所得的回歸方程計算多糖溶液中葡萄糖的濃度,計算換算因子f=m/(c×d×v),式中m為多糖質量(mg),c為多糖溶液中葡萄糖濃度(mg/mL),d為多糖溶液的稀釋倍數,v為體積(mL)。計算得到f=1.4281。
1.2.4.3 樣品中蔓菁多糖得率測定 精密稱取蔓菁粉末0.5 g,按一定液料比、提取溫度、提取時間、功率超聲提取兩次,抽濾、合并濾液,定容于100 mL容量瓶中,取1 mL置于50 mL容量瓶中定容,取2 mL濾液置于具塞試管中,按照“1.2.4.1”中的步驟顯色并測其吸光度,由標準曲線和換算因子計算多糖得率。
多糖得率(%)=(c×d×v×f)/m
式中,c為待測溶液中葡萄糖濃度,mg/mL;d為稀釋倍數;v為待測溶液體積,mL;f為換算因子;m為蔓菁粉末質量,mg。
1.2.5 蔓菁多糖對·OH清除力測定 參照Yu等[18]方法。吸取100 μL 2.00 mg/L的蔓菁多糖溶液于96孔板中,進行2倍梯度稀釋,配成濃度為2.00、1.00、0.50、0.25、0.13 mg/L的溶液。每孔依次加入50 μL 8.98 mmol/L的硫酸亞鐵溶液、50 μL 8.93 mmol/L的水楊酸乙醇溶液、50 μL 9.00 mmol/L的過氧化氫溶液,置37 ℃恒溫箱中30 min。相同濃度冷凍干燥后的蔓菁多糖樣品做3組平行試驗,在波長510 nm處測吸光度Ai,用等量去離子水分別替換過氧化氫溶液和樣品多糖溶液,測定Aj和Ac。以抗壞血酸作為陽性對照,濃度等梯度稀釋為6.00、3.00、1.50、0.75、0.38、0.19、0.09 mg/mL。·OH清除率由以下公式計算獲得,IC50值表示·OH清除率達50%時所需的樣品質量濃度,常用IC50值的大小表示樣品抗氧化性的高低。
式中:Ai為樣品組吸光度;Aj為去離子水代替過氧化氫溶液測得對照組的吸光度;Ac為空白組吸光度。
1.3 數據處理
每組試驗平行測定三次,所得結果以均數±標準差表示,用Microsoft Excel 2016軟件、Origin軟件和Design-Expert 8.0.6軟件進行數據統計分析及繪圖制作。
2 結果與分析
2.1 單因素實驗結果
2.1.1 液料比對蔓菁多糖得率的影響 由圖1可知,當液料比從20∶1 (mL/g)增至40∶1 (mL/g),蔓菁多糖得率逐漸升高,其原因可能是液料比較低時溶液的粘稠度大,超聲波對細胞的空化作用較弱,加之細胞內外溶質的濃度差較小,不利于多糖溶出,隨著蒸餾水量的增加,溶液粘稠度降低,細胞內外多糖的濃度差增大,有利于多糖向溶劑中擴散[19-20]。當液料比增至為40∶1 (mL/g)時,多糖得率達到最大值為64.87%,之后隨著液料比繼續增加,超聲波所產生的能量大多被溶劑吸收,并且雜質溶出較多,多糖得率反而下降[20]。因此,液料比為40∶1 (mL/g)最合適。

圖1 液料比對多糖得率的影響Fig.1 Effect of liquid-to-solid ratio on yield of polysaccharides
2.1.2 提取溫度對蔓菁多糖得率的影響由圖2可知,隨著溫度從40 ℃升高到60 ℃,多糖得率顯著提高,60 ℃達到最大值65.19%,一方面可能是因為在適當范圍內升高溫度可降低溶液的粘稠度,增加多糖在溶液中的溶解度和擴散性,從而提高了多糖得率。另一方面,適當升溫可增加超聲所產生的空化作用,加大細胞損傷,促使細胞內多糖向外界溶出,從而使多糖得率升高[21]。當溫度達到60 ℃時繼續升溫,高溫不僅會造成多糖的分解還會使溶液中的大量水分蒸發,從而使多糖得率降低[22]。因此,適宜的提取溫度為60 ℃。

圖2 提取溫度對多糖得率的影響Fig.2 Effect of extraction temperature on yield of polysaccharides
2.1.3 提取時間對蔓菁多糖得率的影響 由圖3可知,隨著提取時間的增加,蔓菁多糖的得率逐漸升高,在50 min時達到最大值64.78%,繼續延長提取時間,多糖得率反而下降。這種現象可以解釋為,在提取的早期,超聲波產生的空化作用使蔓菁細胞逐漸破裂,增加了提取液與細胞內物質的接觸面積,促進了多糖的溶出,從而得率升高。但隨著提取時間的延長,提取液蒸發減少,蔓菁多糖溶出趨于飽和,并且會造成多糖的降解[23]。因此,從節約時間和提取效果的角度考慮,適宜的提取時間為50 min。

圖3 提取時間對多糖得率的影響Fig.3 Effect of extraction time on yield of polysaccharides
2.1.4 超聲功率對蔓菁多糖得率的影響由 圖4可知,超聲功率在150~270 W之間時,蔓菁多糖的得率隨功率的增加先升高后降低。隨著功率的增大,超聲波對細胞的作用越強,使細胞膜和細胞壁的通透性增加,從而增加多糖傳質速率,使多糖產量增加[21]。當功率超過180 W,過大的超聲功率會破壞多糖結構,從而使得率降低[14]。因此,超聲功率為180 W較合適。

圖4 超聲功率對多糖得率的影響Fig.4 Effect of ultrasonic power on yield of polysaccharides
2.2 響應面試驗結果
2.2.1 試驗設計結果 以單因素試驗結果為依據,選取液料比(mL/g)、提取溫度(℃)、提取時間(min)和超聲功率(W)為自變量,蔓菁多糖得率為響應值,通過Design-Expert 8.0.6軟件進行4因素3水平的響應面分析,所得試驗組合和結果如表2所示。

表2 Box-Behnken試驗設計及響應值Table 2 Design and response value of Box-Behnken experiment
2.2.2 模型的建立與統計分析 利用Design-Expert 8.0.6軟件對表2中的數據進行多元回歸擬合,得到蔓菁多糖得率Y(%)對編碼自變量液料比A(mL/g)、提取溫度B(℃)、提取時間C(min)和超聲功率D(W)的四元二次回歸方程:Y=65.39+0.4A-0.044B+0.21C-0.032D-0.18AB-0.05AC+0.42AD-0.42BC-0.065BD+0.015CD-0.6A2-0.48B2-0.48C2-0.74D2。

表3 回歸模型方差分析表Table 3 Variance analysis of regression model
2.2.3 響應面交互作用分析 通過Design-Expert 8.0.6軟件繪制響應面圖和等高線圖可以直觀反映研究因素及其交互作用對蔓菁多糖得率的影響,響應面圖中曲線越彎曲說明研究因素對多糖得率影響越大,等高線呈橢圓形說明研究因素之間的交互作用顯著[24]。如圖5所示,液料比與提取溫度之間存在顯著交互作用,固定液料比,多糖得率隨溫度的升高先緩慢增加后有降低趨勢,在同一溫度下,多糖得率隨液料比的增加先升高后降低。圖6顯示,液料比與超聲功率之間的交互作用極顯著,在一定液料比下,多糖得率隨超聲功率的增加先升高后降低,對于同一超聲功率,多糖得率隨液料比的增加先升高后趨于平穩,由響應面圖兩側彎曲程度可以看出液料比對多糖得率的影響大于超聲功率。由圖7可知,溫度與時間之間的交互作用極顯著,當溫度固定時,多糖得率隨時間增加先升高后降低,當時間固定時,多糖得率的變化趨勢隨溫度的升高也呈現出相同的變化。

圖5 液料比和提取溫度的交互作用對多糖得率影響的響應面圖和等高線圖Fig.5 Response surface and contour plots of the interaction effect between liquid-solid ratio and extraction temperature on yield of polysaccharides
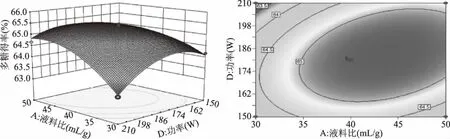
圖6 液料比和超聲功率的交互作用對多糖得率影響的響應面圖和等高線圖Fig.6 Response surface and contour plots of the interaction effect between liquid-solid ratio and ultrasonic power on yield of polysaccharides
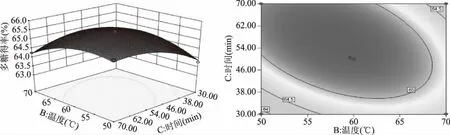
圖7 提取溫度和時間的交互作用對多糖得率影響的響應面圖和等高線圖Fig.7 Response surface and contour plots of the interaction effect between extraction temperature and time on yield of polysaccharides
2.2.4 驗證實驗 通過響應面優化分析結果顯示,超聲輔助提取蔓菁多糖的最佳提取工藝為液料比44.04∶1 (mL/g),提取溫度57.28 ℃,提取時間56.43 min,超聲功率183.27 W。根據儀器的實際操作范圍將此條件稍作修改,最佳提取參數設定為液料比44∶1 (mL/g),提取溫度57 ℃,提取時間56 min,超聲功率為180 W,在此條件下蔓菁多糖得率的預測值為65.51%,進行三次平行試驗得到實際值為65.43%,兩者的相對誤差為0.12%,說明該擬合模型具有可靠性。
2.3 對·OH的清除作用
通過Fenton體系產生·OH與水楊酸混合后的產物在510 nm處有特殊吸收。加入自由基清除劑后,·OH數量減少,與水楊酸的反應產物減少,吸光度值降低[25]。因此,可以根據吸光度值降低的程度判斷蔓菁多糖對·OH的清除情況。如圖8所示,隨著蔓菁多糖的濃度增加,·OH的清除率隨之增加,說明蔓菁多糖對·OH的清除能力具有濃度依賴性,當蔓菁多糖濃度為2 mg/mL時,對·OH清除率達到最大為95.78%。蔓菁多糖對·OH清除率的回歸方程為y=23.212lnx+70.412,其R2=0.9078。根據回歸方程可知蔓菁多糖IC50=0.415 mg/mL,而抗壞血酸IC50=0.883 mg/mL,一般認為IC50值小于10 mg/mL,該物質具有較好的抗氧化性[26]。可見蔓菁多糖對于·OH的清除能力大于抗壞血酸對·OH的清除能力,蔓菁多糖具有較強的抗氧化性。

圖8 蔓菁多糖對·OH的清除作用Fig.8 ·OH scavenging activity of polysaccharides from turnip
3 結論與討論
本研究采用超聲法輔助提取蔓菁中天然多糖成分,并對提取工藝進行響應面優化。得到最佳提取工藝:液料比44∶1 (mL/g),提取溫度57 ℃,提取時間56 min,超聲功率180 W。經驗證,蔓菁多糖得率的實際值為65.43%,與模型預測值偏差較小,說明此優化工藝參數具有實際參考價值。王偉等用響應面法優化新疆蕪菁多糖的提取工藝,確定了提取工藝的最優條件:液料比75∶1 (mL/g),提取溫度93 ℃,提取時間4.3 h,提取次數3次,多糖得率為23.72%[10]。對比可知,本研究采用超聲輔助提取法在很大程度上減少了液料比、降低了提取溫度、使提取時間縮短3.4 h、多糖得率大幅度提高。蔡嘯鏑等[14]用超聲輔助法提取恰瑪古多糖,對液料比、提取時間、乙醇體積分數、超聲功率進行優化,多糖得率為6.86%。與該研究結果相差較大,原因可能有三個方面:一是提取工藝的優化參數不同,有研究表明提取溫度對多糖得率的影響大于乙醇體積分數[27],而本實驗將提取溫度納入到提取工藝的優化條件當中,顯示提取溫度對多糖得率有重要影響;二是與測定方法有關,本試驗采用改進的苯酚硫酸法測定溶液中蔓菁多糖的含量,以葡萄糖為標準品,用精制蔓菁多糖計算換算因子,減少了單純用葡萄糖濃度來推算蔓菁多糖含量所引起的系統誤差,此外,直接測定提取液中蔓菁多糖含量并計算多糖得率,比從提取液中通過脫蛋白、脫色素、冷凍干燥后計算多糖與蔓菁原材料的質量之比的方式更為精確,減少了純化過程中造成的多糖損失;三是不同產地的蔓菁多糖含量差別較大[28]。
·OH是體內活性最強、毒性最大、半衰期最短的強氧化劑,幾乎可以和體內所有分子發生反應[25],因此研究蔓菁多糖對·OH的清除作用對研究其抗氧化性具有指導意義。體外抗氧化試驗表明,本研究所采用的新鄉蔓菁提取的多糖對·OH的清除能力較強,IC50=0.415 mg/mL。數據結果優于張謙筱等所研究的新疆蔓菁多糖對·OH的清除作用,IC50=0.7 mg/mL[29]。因此,新鄉蔓菁多糖具有較好的抗氧化活性,進一步增加了其開發利用的經濟價值。
綜上所述,本研究通過響應面法優化超聲輔助提取蔓菁多糖工藝,所得最優提取參數有效可行,有益于蔓菁多糖作為天然抗氧化劑在食品、藥品、化妝品、保健品等領域中的推廣應用。

