莽草酸衍生物的合成及其對紫杉醇耐藥人乳腺癌細胞的逆轉作用研究
張璐 陳思穎 王謙 張錦 黃麗英 任樂 田會萍 王楠 董亞琳
摘 要 目的:對莽草酸進行結構修飾,并探討其衍生物對紫杉醇耐藥人乳腺癌細胞MCF-7/PTX的逆轉作用。方法:以莽草酸為先導結構,通過酯化、酰胺化、氫化、還原等方法對其1位羧基進行結構修飾,合成一系列莽草酸衍生物;以非耐藥細胞MCF-7為參照,采用MTT法篩選具有抑制活性的衍生物,并同法考察活性衍生物對MCF-7/PTX細胞的半數抑制濃度(IC50)和逆轉倍數(RI);以耐藥相關蛋白轉膠蛋白2為靶點,采用Glide 1.0計算機輔助設計軟件將活性衍生物與轉膠蛋白2進行分子對接。結果:共合成得到15個衍生物(T1~T15),其中T4~T15為首次合成所得。MTT試驗結果顯示,(3R,4S,5R)-N-芐基-3,4,5-三羥基-1-環己烯-1-甲酰胺(T7)、(3R,4S,5R)-N-(3,4,5-三羥基-1-環己烯甲基)-芐胺(T14)、(3R,4S,5R)-3,4-O-異亞丙基-5-O-乙酰基-1-環己烯-1-甲酸甲酯(T15)對MCF-7和MCF-7/PTX細胞均具有一定的抑制作用,且各劑量T7、T14、T15+紫杉醇聯用組對MCF-7/PTX細胞的IC50值均顯著低于陰性對照(紫杉醇單用)組(P<0.05);T14、T15的RI較高,其最高劑量的RI已達8.8、9.3,與陽性對照藥物維拉帕米(10.8)相當。分子對接結果顯示,T7 3、4位上的羥基可與轉膠蛋白2催化區域的Arg625、Asp627形成多個氫鍵;T14除上述氫鍵外,其1位上的二級胺側鏈還可與轉膠蛋白2的Glu657形成氫鍵;T15母核上的羥基被供電基團衍生化后,其與轉膠蛋白2的結合更為緊密,抑制作用有所增強。結論:衍生物T7、T14、T15對紫杉醇耐藥人乳腺癌細胞均具有一定的逆轉活性。母核上的多羥基結構是莽草酸及其衍生物與轉膠蛋白2形成氫鍵的主要結構區域,對其進行供電基團衍生化或在莽草酸1位羧基引入二級胺、疏水基團等均可有利于增強衍生物的耐藥逆轉活性。
關鍵詞 莽草酸衍生物;轉膠蛋白2;乳腺癌;紫杉醇耐藥;逆轉作用
ABSTRACT? ?OBJECTIVE: To structurally modify shikimic acid, and to investigate the reversal effects of its derivatives on paclitaxel-resistant? human breast cancer cells MCF-7/PTX. METHODS: Using shikimic acid as the lead structure, 1-position carboxyl group was structurally modified to synthesize a series of shikimic acid derivatives through esterification, amidation, hydrogenation and reduction, etc. Using non-drug resistant cells MCF-7 as reference, MTT assay was used to screen derivatives with inhibitory activity as well as half-inhibitory concentration (IC50) and reversal index (RI) of derivatives to MCF-7/PTX. With the drug resistance-related transgelin 2 as the target, the molecular docking of the active derivatives with the drug resistance-related protein was carried out by using Glide 1.0 computer-aided design software. RESULTS:Totally 15 derivatives were obtained(T1-T15), of which T4-T15 were obtained for the first time. MTT assay showed that (3R, 4S, 5R)-N-benzyl-3,4,5-trihydroxy-1-cyclohexene-1-formamide (T7), (3R, 4S, 5R)-N-(3,4,5-trihydroxy-1-cyclohexenylmethyl)-benzylamine (T14), (3R, 4S, 5R)-3, 4-O-isopropyl-5-O-acetyl-1-cyclohexene-1-methyl formate (T15) inhibited MCF-7 and MCF-7/PTX cells to a certain extent; IC50 values of T7, T14 and T15 combined with pacliaxel to MCF-7/PTX cells were significantly lower than that in negative control (Paclitaxel alone) group (P<0.05). RIs of T14 and T15 were higher, and RIs of the highest dose were 8.8 and 9.3, which were equivalent to positive control verapamil (10.8). The results of molecular docking showed that the hydroxyl groups at positions 3, 4 of T7 could form multiple hydrogen bonds with Arg625 and Asp627 in the catalytic region of transgelin 2. In addition to the hydrogen bond mentioned above at T7, the secondary amine side chain at position 1 of T14 could also form hydrogen bond with Glu657 of transgelin 2. When the hydroxyl group on the T15 mother nucleus was derived from the donor group, the binding of the hydroxyl group to transgelin 2 was closer and the inhibition was enhanced. CONCLUSIONS: The derivatives T7, T14 and T15 have certain reverse activity to paclitaxel-resistant human breast cancer cells. The polyhydroxy structure of the mother nucleus is the main structural region of the hydrogen bond between shikimic acid and its derivatives and transgelin 2. The derivation of its power supply group or the introduction of secondary amines and hydrophobic groups into the 1-carboxyl group of shikimic acid is benifit for enhancing the drug resistance reversal effect of derivative.
KEYWORDS? ?Shikimic acid derivative; Transgelin 2; Breast cancer; Paclitaxel resistance; Reversal effect
乳腺癌是女性常見的惡性腫瘤之一,發病率占惡性腫瘤總數的23%,病死率可達14%[1]。紫杉醇(Pacli- taxel,PTX)是治療乳腺癌的一線化療藥物,在臨床上通常與鉑類和/或蒽環類藥物聯用。但是乳腺癌細胞容易對PTX產生耐藥性,使得患者療效欠佳,從而導致該藥的臨床應用受到嚴重限制[2]。因此,尋找新的PTX耐藥逆轉藥物是目前乳腺癌治療藥物研發的熱點之一。
轉膠蛋白2是一種重要的細胞骨架蛋白,可通過與肌動蛋白相互作用而參與平滑肌細胞的骨架重構和表型調節[3]。近年來有研究報道,高表達的轉膠蛋白2可促進乳腺癌細胞侵襲、轉移,并誘導細胞對PTX產生耐藥性,該蛋白的過量表達是乳腺癌發生、發展和PTX耐藥的關鍵因素[4]。此外有研究指出,轉膠蛋白2在PTX耐藥乳腺癌細胞生存和轉移通路中具有重要作用,已成為逆轉乳腺癌PTX耐藥的重要靶點[5]。由此可見,抑制轉膠蛋白2的過量表達可能成為逆轉PTX耐藥的新策略之一。本課題前期已成功建立了PTX誘導的乳腺癌多藥耐藥(MDR)細胞模型MCF-7/PTX,并發現該細胞模型中轉膠蛋白2的表達較野生型細胞株明顯上調,且其基因與蛋白表達特征一致;同時,發現該蛋白對多種常用化療藥物均具有交叉耐藥性,并可參與乳腺癌細胞PTX耐藥的發生,使細胞表現出MDR表型;此外,本課題組前期還通過蛋白質組學技術分析了該耐藥細胞與親本細胞之間的差異表達蛋白,挖掘了乳腺癌治療及預后的潛在分子靶標,初步證實了轉膠蛋白2可作為乳腺癌耐藥機制研究的新靶點[6-7]。
莽草酸(Shikimic acid,SA,化學結構見圖1)是從木蘭科植物八角茴香(Illicium verum Hook. f.)中提取的多羥基環己烯甲酸化合物。研究表明,SA及其衍生物具有抗凝血、抗炎、抗病毒等作用[8-9]。此外,SA能有效抑制L1210白血病模型小鼠腫瘤細胞的增殖,并延長小鼠的存活時間[10],且其衍生物亦具有良好的抗腫瘤活性[11]。鑒于SA的抗腫瘤活性及其良好的成藥性,本研究擬以轉膠蛋白2為靶點、SA為先導化合物,于1位羧基合成一系列衍生物;在篩選具有乳腺癌細胞耐藥逆轉活性衍生物的基礎上,進行分子對接,以期為MDR逆轉劑的篩選提供候選化合物,為乳腺癌治療效果的提高和個體化治療的開展提供參考。
1 材料
1.1 儀器與軟件
X-5型顯微熔點測定儀(北京泰克儀器有限公司);AVANCE Ⅱ300型核磁共振(NMR)儀(德國Bruker公司);API-QTRAP 3200型液相色譜-質譜聯用儀(美國Thermo Fisher Scientific公司);Erocell 240型細胞培養箱(上海潤度生物科技有限公司);ELx 808型全自動酶標儀(美國BioTek公司);Glide 1.0計算機藥物輔助設計軟件(美國Schr?dinger公司)。
1.2 藥品與試劑
SA對照品(上海寶曼生物科技有限公司,批號:SH201707331,純度:99.99%);PTX對照品(南京思科藥業有限公司,批號:C1080101,純度:99.99%);鹽酸維拉帕米對照品(中國食品藥品檢定研究院,批號:100223- 200102,純度:供含量測定用);胰蛋白酶(北京華美生物工程有限公司,批號:90090620);MTT試劑(美國Sigma公司,批號:SS6A7401);胎牛血清(FBS,中美合資蘭州民海生物工程有限公司);RPMI 1640培養基(美國Gibco公司,批號:7540713);合成用試劑O-苯并三氮唑-N,N,N′,N′-四甲基脲四氟硼酸(TBTU)、N,N-二異丙基乙胺(DIPEA)、N,N-二甲基甲酰胺、氫化鋁鋰(LiAlH4)、對甲苯胺、對三氟甲基苯胺、對氟苯胺、2-氨基噻唑、2-氨基吡啶、對甲苯磺酸、芐氯、正丙胺、正丁胺、苯胺、芐胺、正丁醇等試劑均為市售分析純或化學純,水為蒸餾水。
1.3 細胞
細胞株MCF-7細胞由中國科學院上海細胞庫提供;MCF-7/PTX細胞為本實驗室自制。
2 方法與結果
2.1 目標化合物的合成及其結構鑒定
以SA為原料,分別采用酯化、酰胺化、氫化、還原等方法合成SA衍生物,并根據其理化性質和波譜數據(質譜、氫譜、碳譜等)對其結構進行鑒定。
2.1.1 目標化合物T1~T3 合成方法參考已有文獻[12-15]:以SA為起始原料,在對甲苯磺酸催化和加熱回流條件下分別與甲醇、正丁醇進行酯化反應得目標化合物T1和T2(見圖2A);以SA為起始原料,以濃硫酸溶液為脫水劑,與過量丙酮于室溫下攪拌制得(3R,4S,5R)-3,4-O-異亞丙基莽草酸(中間體b);以乙腈為溶劑,在三乙胺催化下,中間體b與芐氯于80 ℃回流下反應得到(3R,4S,5R)-3,4-O-異亞丙基-5-羥基-1-環己烯-1-甲酸芐酯(中間體p);將中間體p溶于甲醇,加入10%鹽酸溶液,于室溫下攪拌,停止反應后用碳酸氫鈉溶液將pH調至7,于50 ℃下蒸干后,即得目標化合物T3(見圖2B)。目標化合物T1~T3的理化性質及波譜數據如下。
目標化合物T1——白色固體,熔點(mp):110~111 ℃,電噴霧(ESI)-MS:m/z 189.06[M+H]+。1H-NMR(300 MHz,D2O)δ:2.19(dd,1H,J=18.0,7.0 Hz,H-6ax),2.67(dd,1H,J=18.0,6.9 Hz,H-6eq),3.68(m,1H,H-5),3.73(s,3H,-CO2CH3),3.97(m,1H,H-4),4.36(m,1H,H-3),6.77(d,1H,J=6.0 Hz,H-2);13C-NMR(100 MHz,D2O)δ:31.2(C-6),52.0(C-2′),68.3(C-4),68.5(C-5),69.8(C-3),130.1(C-1),136.2(C-2),167.2(C-1′)。根據上述波譜數據確定T1為(3R,4S,5R)-3,4,5-三羥基-1-環己烯-1-甲酸甲酯。
目標化合物T2——白色固體,mp:64~65 ℃,ESI-MS:m/z 231.11[M+H]+。1H-NMR(300 MHz,DMSO- d6)δ:0.87~0.93(t,3H,J=9.0 Hz,H-5′),1.31~1.40(m,2H,H-4′),1.54~1.61(m,2H,H-3′),2.03~2.09(dd,1H,J=18.0,7.0 Hz,H-6ax),2.40~2.46(dd,1H,J=18.0,7.1 Hz,H-6eq),3.56~3.58(m,1H,H-5),3.84~3.86(m,1H,H-4),4.06~4.10(t,2H,J=6.4 Hz,H-2′),4.23(m,1H,H-3),4.60~4.62(d,1H,J=7.2 Hz,5-OH),4.80~4.83(m,2H,3-OH,4-OH),6.61(d,1H,J=6.0 Hz,H-2);13C-NMR(100 MHz,CDCl3)δ:128.3(C-1),137.7(C-2),69.8(C-3),68.3(C-4),68.5(C-5),31.2(C-6),167.2(C-1′),65.3(C-2′),31.2(C-3′),18.9(C-4′),13.8(C-5′)。根據上述波譜數據確定T2為(3R,4S,5R)-3,4,5-三羥基-1-環己烯-1-甲酸正丁酯。
目標化合物T3——白色固體,mp:98~100 ℃,ESI-MS:m/z 265.09[M+H]+。1H-NMR(300 MHz,DMSO- d6)δ:2.01~2.07(dd,1H,J=18.0,7.1 Hz,H-6ax),2.50~2.56(dd,1H,J=18.0,7.0 Hz,H-6eq),3.52(m,1H,H-5),3.85(m,1H,H-4),4.21(m,1H,H-3),4.32(s,2H,-O-CH2-),4.52(d,1H,J=7.3 Hz,5-OH),4.67~4.70(d,1H,J=7.2 Hz,4-OH),4.78(d,1H,J=7.2 Hz,3-OH),6.36(d,1H,J=6.0 Hz,H-2),7.23~7.30(m,5H,Ar-H);13C-NMR(100 MHz,CDCl3)δ:130.1(C-1),136.2(C-2),69.8(C-3),68.3(C-4),68.5(C-5),31.2(C-6),167.2(C-1′),66.2(C-2′),136.1(C-3′),127.1(C-4′,8′),128.9(C-5′,7′),127.6(C-6′)。根據上述波譜數據確定T3為(3R,4S,5R)-3,4,5-三羥基-1-環己烯-1-甲酸芐酯。
2.1.2 目標化合物T4~T12 以SA為原料,按“2.1.1”項下方法制得中間體b,然后以TBTU為縮合劑、二氯甲烷和N,N-二甲基甲酰胺為溶劑,分別與正丙胺、正丁胺、苯胺、芐胺、對甲苯胺、對氟苯胺、對三氟甲基苯胺和2-氨基噻唑反應后,得(3R,4S,5R)-3,4-O-異亞丙基-5-羥基-N-正丙基-1-環己烯-1-甲酰胺(中間體c4)、(3R,4S,5R)-3,4-O-異亞丙基-5-羥基-N-正丁基-1-環己烯-1-甲酰胺(中間體c5)、(3R,4S,5R)-3,4-O-異亞丙基-5-羥基-N-苯基-1-環己烯-1-甲酰胺(中間體c6)、(3R,4S,5R)-3,4-O-異亞丙基-5-羥基-N-芐基-1-環己烯-1-甲酰胺(中間體c7)、(3R,4S,5R)-3,4-O-異亞丙基-5-羥基-N-對甲苯基-1-環己烯-1-甲酰胺(中間體c8)、(3R,4S,5R)-3,4-O-異亞丙基-5-羥基-N-對氟苯基-1-環己烯-1-甲酰胺(中間體c9)、(3R,4S,5R)-3,4-O-異亞丙基-5-羥基-N-對三氟甲基苯基-1-環己烯-1-甲酰胺(中間體c10)和(3R,4S,5R)-3,4-O-異亞丙基-5-羥基-N-(2′-噻唑基)-1-環己烯-1-甲酰胺(中間體c11);上述中間體與冰醋酸、水于90℃下加熱回流反應,分別得到目標化合物化合物T4~T11(見圖3A)。以SA為起始原料,與醋酐、吡啶于室溫下攪拌反應得到三乙酰化莽草酸(中間體h),中間體h于冰浴條件下滴加氯化亞砜,滴加完畢后加熱回流,抽濾得到酰氯粗品;將此粗品用二氯甲烷溶解,在冰浴下逐滴加入2-氨基吡啶、二氯甲烷、吡啶的混合溶液,攪拌反應,得到(3R,4S,5R)-N-(2′-吡啶基)-3,4,5-O-三乙酰基-1-環己烯-1-甲酰胺(中間體i);將中間體i溶于甲醇后,加入甲醇鈉,于室溫下攪拌得目標化合物T12(見圖3B)。目標化合物T4~T12的理化性質及波譜數據如下。
目標化合物T4——白色固體,mp:90~92 ℃,ESI-MS:m/z 216.11[M+H]+。1H-NMR(400 MHz,DMSO- d6)δ:0.80~0.84(t,3H,J=8.0 Hz,H-4′),1.39~1.45(m,2H,H-3′),1.95~2.00(dd,1H,J=16.0,7.0 Hz,H-6ax),2.46~2.50(dd,1H,J=16.0,7.0 Hz,H-6eq),3.01~3.07(m,2H,H-2′),3.48~3.50(m,1H,H-5),3.80(m,1H,H-4),4.17(m,1H,H-3),4.54~4.56(d,1H,J=7.0 Hz,5-OH),4.68~4.70(d,1H,J=7.3 Hz,4-OH),4.77~4.78(d,1H,J=7.2 Hz,3-OH),6.27(d,1H,J=6.3 Hz,H-2),7.81~7.84(t,1H,J=6.0 Hz,-NH-);13C-NMR(100 MHz,CDCl3)δ:139.9(C-1),136.5(C-2),69.4(C-3),67.9(C-4),68.1(C-5),30.0(C-6),168.2(C-1′),40.9(C-2′),23.1(C-3′),11.2(C-4′)。根據上述波譜數據確定T4為(3R,4S,5R)-N-正丙基-3,4,5-三羥基-1-環己烯-1-甲酰胺。
目標化合物T5——白色固體,mp:103~104 ℃,ESI-MS:m/z 230.13[M+H]+。1H-NMR(400 MHz,DMSO- d6)δ:0.84~0.89(t,3H,J=7.5 Hz,H-5′),1.24~1.32(m,2H,H-4′),1.35~1.43(m,2H,H-3′),1.93~2.00(dd,1H,J=18.0,7.0 Hz,H-6ax),2.46~2.48(dd,1H,J=18.0,7.0 Hz,H-6eq),3.05~3.10(t,2H,J=7.5 Hz,H-2′),3.46~3.50(m,1H,H-5),3.79~3.82(m,1H,H-4),4.16(m,1H,H-3),4.64~4.69(m,2H,4-OH,5-OH),6.26(d,1H,J=6.0 Hz,H-2),7.76(s,1H,-NH-);13C-NMR(100 MHz,CDCl3)δ:139.9(C-1),136.5(C-2),69.4(C-3),67.9(C-4),68.1(C-5),30.0(C-6),168.2(C-1′),40.3(C-2′),32.2(C-3′),19.8(C-4′),13.8(C-5′)。根據上述波譜數據確定T5為(3R,4S,5R)-N-正丁基-3,4,5-三羥基-1-環己烯-1-甲酰胺。
目標化合物T6——白色固體,mp:136~138 ℃,ESI-MS:m/z 250.10[M+H]+。1H-NMR(400 MHz,DMSO- d6)δ:2.06~2.13(dd,1H,J=18.0,7.0 Hz,H-6ax),2.58~2.64(dd,1H,J=18.0,7.2 Hz,H-6eq),3.56~3.58(m,1H,H-5),3.87~3.80(m,1H,H-4),4.27(m,1H,H-3),4.59~4.60(d,1H,J=7.0 Hz,5-OH),4.74~4.76(d,1H,J=7.0 Hz,4-OH),4.81~4.83(d,1H,J=7.0 Hz,3-OH),6.45(d,1H,J=6.0 Hz,H-2),7.01~7.07(d,1H,J=8.0 Hz,H-5′),7.26~7.32(t,2H,J=8.1 Hz,H-4′,6′),7.65~7.69(d,2H,J=8.0 Hz,H-3′,7′),9.67(s,1H,-NH-);13C-NMR(100 MHz,CDCl3)δ:139.9(C-1),136.5(C-2),69.4(C-3),67.9(C-4),68.1(C-5),30.0(C-6),163.1(C-1′),137.6(C-2′),121.6(C-3′,7′),128.9(C-4′,6′),128.0(C-5′)。根據上述波譜數據確定T6為(3R,4S,5R)-N-苯基-3,4,5-三羥基-1-環己烯-1-甲酰胺。
目標化合物T7——白色固體,mp:86~88 ℃,ESI-MS:m/z 264.11[M+H]+。1H-NMR(300 MHz,DMSO- d6)δ:2.01~2.07(dd,1H,J=18.0,7.0 Hz,H-6ax),2.50~2.56(dd,1H,J=18.0,7.0 Hz,H-6eq),3.53(m,1H,H-5),3.84(m,1H,H-4),4.20(m,1H,H-3),4.31(s,2H,2′-CH2),4.53(d,1H,J=7.0 Hz,5-OH),4.68~4.70(d,1H,J=7.0 Hz,4-OH),4.77(s,1H,J=7.0 Hz,3-OH),6.37(d,1H,J=6.0 Hz,H-2),7.23~7.30(m,5H,Ar-H),8.40(s,1H,-NH-);13C-NMR(100 MHz,CDCl3)δ:139.9(C-1),136.5(C-2),69.4(C-3),67.9(C-4),68.1(C-5),30.0(C-6),168.5(C-1′),43.9(C-2′),137.9(C-3′),126.9(C-4′,8′),128.5(C-5′,7′),126.7(C-6′)。根據上述波譜數據確定T7為(3R,4S,5R)-N-芐基-3,4,5-三羥基-1-環己烯-1-甲酰胺。
目標化合物T8——白色晶體,mp:179~180 ℃,ESI-MS:m/z 264.11[M+H]+。1H-NMR(400 MHz,DMSO- d6)δ:2.05~2.10(dd,1H,J=16.0,7.0 Hz,H-6ax),2.25(s,3H,-CH3),2.58~2.62(dd,1H,J=18.0,7.0 Hz,H-6eq),3.53~3.57(m,1H,H-5),3.86~3.88(m,1H,H-4),4.26(m,1H,H-3),4.65~4.66(d,1H,J=7.0 Hz,5-OH),4.78~4.80(d,1H,J=7.0 Hz,4-OH),4.85~4.86(d,1H,J=7.0 Hz,3-OH),6.43(d,1H,J=6.0 Hz,H-2),7.08~7.10(d,2H,J=8.0 Hz,H-3′,7′),7.54~7.56(d,2H,J=8.0 Hz,H-4′,6′),9.63(s,1H,-NH-);13C-NMR(100 MHz,CDCl3)δ:39.9(C-1),136.5(C-2),69.4(C-3),67.9(C-4),68.1(C-5),30.0(C-6),163.1(C-1′),134.6(C-2′),121.5(C-3′,7′),129.2(C-4′,6′),136.8(C-5′),21.3(C-8′)。根據上述波譜數據確定T8為(3R,4S,5R)-N-對甲苯基-3,4,5-三羥基-1-環己烯-1-甲酰胺。
目標化合物T9——白色固體,mp:132~133 ℃。ESI-MS:m/z 268.09[M+H]+。1H-NMR(400 MHz,DMSO- d6)δ:2.06~2.11(dd,1H,J=16.0,6.0 Hz,H-6ax),2.58~2.62(dd,1H,J=16.0,6.0 Hz,H-6eq),3.56~3.59(m,1H,H-5),3.88~3.90(m,1H,H-4),4.27(m,1H,H-3),4.67~4.68(d,1H,J=7.0 Hz,5-OH),4.81~4.83(d,1H,J=7.0 Hz,4-OH),4.87~4.88(d,1H,J=7.0 Hz,3-OH),6.45(d,1H,J=6.0 Hz,H-2),7.12~7.16(d,2H,J=8.0 Hz,H-4′,6′),7.67~7.71(d,2H,J=8.0 Hz,H-3′,7′),9.78(s,1H,-NH-);13C-NMR(100 MHz,CDCl3)δ:139.9(C-1),136.5(C-2),69.4(C-3),67.9(C-4),68.1(C-5),30.0(C-6),163.1(C-1′),133.2(C-2′),126.1(C-3′,7′),115.7(C-4′,6′),162.9(C-5′)。根據上述波譜數據確定T9為(3R,4S,5R)-N-對氟苯基-3,4,5-三羥基-1-環己烯-1-甲酰胺。
目標化合物T10——黃色固體,mp:68~70 ℃,ESI-MS:m/z 318.09[M+H]+。1H-NMR(400 MHz,DMSO- d6)δ:2.09~2.13(dd,1H,J=16.0,7.0 Hz,H-6ax),2.58~2.62(dd,1H,J=16.0,7.0 Hz,H-6eq),3.59(m,1H,H-5),3.89(m,1H,H-4),4.29(m,1H,H-3),4.70~4.72(d,1H,J=7.0 Hz,5-OH),4.85~4.87(d,1H,J=7.0 Hz,4-OH),4.90~4.91(d,1H,J=7.0 Hz,3-OH),6.51(d,1H,J=6.0 Hz,H-2),7.56~7.58(d,2H,J=8.0 Hz,H-4′,6′),7.91~7.93(d,2H,J=8.0 Hz,H-3′,7′),10.1(s,1H,-NH-);13C-NMR(100 MHz,CDCl3)δ:139.9(C-1),136.5(C-2),69.4(C-3),67.9(C-4),68.1(C-5),30.0(C-6),163.1(C-1′),140.9(C-2′),121.9(C-3′,7′),125.3(C-4′,6′),132.1(C-5′),124.1(C-8′)。根據上述波譜數據確定T10為(3R,4S,5R)-N-對三氟甲基苯基-3,4,5-三羥基-1-環己烯-1-甲酰胺。
目標化合物T11——白色固體,mp:218~220 ℃,ESI-MS:m/z 257.05[M+H]+。1H-NMR(400 MHz,DMSO- d6)δ:2.09~2.14(dd,1H,J=16.0,7.0 Hz,H-6ax),2.60~2.64(dd,1H,J=16.0,7.0 Hz,H-6eq),3.58~3.59(m,1H,H-5),3.88~3.90(m,1H,H-4),4.26(m,1H,H-3),4.71~4.72(d,1H,J=7.0 Hz,5-OH),4.84~4.86(d,1H,J=7.0 Hz,4-OH),4.90~4.91(d,1H,J=7.0 Hz,3-OH),6.70(d,1H,J=6.0 Hz,H-2),7.21~7.22(d,1H,J=7.5 Hz,H-4′),7.50~7.51(d,1H,J=7.5 Hz,H-3′),12.1(s,1H,-NH-);13C-NMR(100 MHz,CDCl3)δ:139.9(C-1),136.5(C-2),69.4(C-3),67.9(C-4),68.1(C-5),30.0(C-6),163.1(C-1′),165.0(C-2′),132.6(C-3′),112.1(C-4′)。根據上述波譜數據確定T11為(3R,4S,5R)-N-(2′-噻唑基)-3,4,5-三羥基-1-環己烯-1-甲酰胺。
目標化合物T12——白色固體,mp:231~232 ℃,ESI-MS:m/z 251.09[M+H]+。1H-NMR(400 MHz,DMSO- d6)δ:2.06~2.11(dd,1H,J=16.0,7.0 Hz,H-6ax),2.61~2.65(dd,1H,J=16.0,7.0 Hz,H-6eq),3.55~3.57(m,1H,H-5),3.87~3.88(m,1H,H-4),4.24(m,1H,H-3),4.67(d,1H,J=7.0 Hz,5-OH),4.78(d,1H,J=7.0 Hz,4-OH),4.86(d,1H,J=7.0 Hz,3-OH),6.56(d,1H,J=6.0 Hz,H-2),7.10~7.13(t,1H,J=6.0 Hz,H-6′),7.76~7.80(dd,1H,J=8.0,5.0 Hz,H-4′),8.02~8.04(dd,1H,J=8.0,6.0 Hz,H-5′),8.33~8.34(d,1H,J=5.0 Hz,H-3′),10.1(s,1H,-NH-);13C-NMR(100 MHz,CDCl3)δ:139.9(C-1),136.5(C-2),69.4(C-3),67.9(C-4),68.1(C-5),30.0(C-6),163.1(C-1′),149.9(C-2′),148.1(C-3′),117.9(C-4′),138.3(C-5′),114.2(C-6′)。根據上述波譜數據確定T12為(3R,4S,5R)-N-(2′-吡啶基)-3,4,5-三羥基-1-環己烯-1-甲酰胺。
2.1.3 目標化合物T13 將目標化合物T1溶于四氫呋喃,于冰浴條件下緩慢加入LiAlH4,加完后緩慢升至室溫,然后在氮氣保護下加熱回流,冷卻至室溫后,即得目標化合物T13,詳見圖4。其理化性質和波譜數據如下。
目標化合物T13——白色固體,mp:32~33 ℃,ESI-MS:m/z 161.07[M+H]+。1H-NMR(400 MHz,DMSO- d6)δ:2.04~2.08(dd,1H,J=16.0,7.0 Hz,H-6ax),2.40~2.44(dd,1H,J=16.0,7.0 Hz,H-6eq),3.57~3.59(m,1H,H-5),3.67(s,2H,1′-CH2),3.85~3.87(m,1H,H-4),4.22(m,1H,H-3),4.67~4.69(d,1H,J=7.0 Hz,5-OH),4.86~4.87(d,1H,J=7.0 Hz,4-OH),4.88(d,1H,J=7.0 Hz,3-OH),6.62(d,1H,J=6.0 Hz,H-2);13C-NMR(100 MHz,CDCl3)δ:137.1(C-1),122.1(C-2),68.0(C-3),68.6(C-4),67.6(C-5),30.8(C-6),67.3(C-1′)。根據上述波譜數據確定T13為(3R,4S,5R)-1-羥甲基-1-環己烯-3,4,5-三醇。
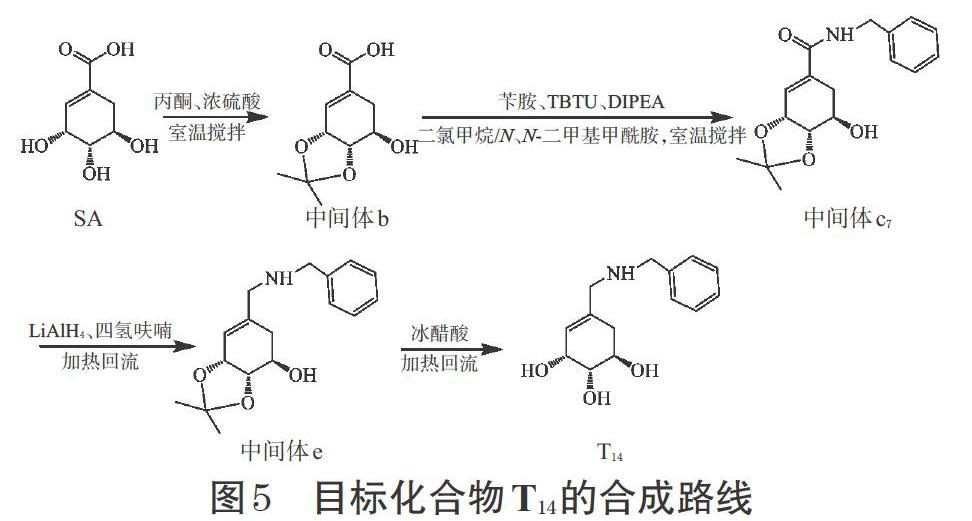
2.1.4 目標化合物T14 將中間體b與適量二氯甲烷、N,N-二甲基甲酰胺混合后,于冰浴條件下慢慢加入TBTU、DIPEA,攪拌反應后加入芐胺,室溫攪拌反應過夜,得到中間體c7;將中間體c7溶于四氫呋喃,并且慢慢滴入到LiAlH4中,冰浴攪拌后升溫并回流,反應過夜得到(3R,4S,5R)-N-(3,4-O-異亞丙基-5-羥基-1-環己烯甲基)-芐胺(中間體e);將中間體e溶于冰醋酸中,加熱回流后降至室溫,即得目標化合物T14,詳見圖5。其理化性質及波譜數據如下。
目標化合物T14——白色固體,mp:72~73 ℃,ESI-MS:m/z 250.13[M+H]+。1H-NMR(400 MHz,DMSO- d6)δ:2.01~2.07(dd,1H,J=18.0,7.0 Hz,H-6ax),2.35~2.37(s,2H,1′-CH2),2.60~2.66(dd,1H,J=18.0,7.0 Hz,H-6eq),3.67~3.69(m,2H,H-4,5),3.74~3.76(m,1H,H-3),4.20~4.32(s,2H,2′-CH2),4.64~4.65(d,1H,J=7.0 Hz,5-OH),5.42~5.46(d,1H,J=7.0 Hz,4-OH),5.56~5.59(d,1H,J=7.0 Hz,3-OH),6.61(d,1H,J=6.0 Hz,H-2),7.21(d,1H,J=7.8 Hz,H-6′),7.21~7.32(m,4H,H-4′,5′,7′,8′);13C-NMR(100 MHz,CDCl3)δ:139.0(C-1),121.9(C-2),67.7(C-3),68.6(C-4),67.3(C-5),32.2(C-6),53.1(C-1′),54.8(C-2′),140.2(C-3′),127.9(C-4′,8′),128.5(C-5′,7′),127.0(C-6′)。根據上述波譜數據確定T14為(3R,4S,5R)-N-(3,4,5-三羥基-1-環己烯甲基)-芐胺。
2.1.5 目標化合物T15 將目標化合物T1分散于丙酮后,逐滴加入濃硫酸溶液并于室溫下攪拌過夜后,用碳酸氫鈉溶液將pH調至7,得(3R,4S,5R)-3,4-O-異亞丙基-5-羥基-1-環己烯-1-甲酸甲酯(中間體j);將中間體j與適量醋酐、吡啶混合,于室溫下攪拌,用乙酸乙酯稀釋,取有機層依次用10%鹽酸溶液、水萃取后,再以無水硫酸鈉干燥,得目標化合物T15,詳見圖6。其理化性質及波譜數據如下。
目標化合物T15——白色晶體,mp:59~60 ℃,ESI-MS:m/z 229.09[M+H]+。1H-NMR(300 MHz,DMSO- d6)δ:1.28~1.32(s,6H,8-CH3,9-CH3),1.98(s,3H,11-CH3),2.24~2.32(dd,1H,J=18.0,7.0 Hz,H-6ax),2.59~2.66(dd,1H,J=18.0,7.8 Hz,H-6eq),3.71(s,3H,2-CH3),4.23~4.27(m,1H,H-5),4.80(m,1H,H-4),4.87~4.91(m,1H,H-3),6.80(d,1H,J=6.0 Hz,H-2);13C-NMR(100 MHz,CDCl3)δ:130.1(C-1),133.8(C-2),73.9(C-3),76.0(C-4),69.9(C-5),28.3(C-6),121.1(C-7),26.6(C-8,9),170.2(C-10),21.0(C-11),167.2(C-1′),52.3(C-2′)。根據上述波譜數據確定T15為(3R,4S,5R)-3,4-O-異亞丙基-5-O-乙酰基-1-環己烯-1-甲酸甲酯。所得目標化合物中,T4~T15均未見文獻報道,為首次通過上述合成方法獲得的化合物。
2.2 SA衍生物耐藥逆轉活性的檢測
本課題組前期采用MTT法檢測了化合物T1~T15對MCF-7和MCF-7/PTX細胞的抑制作用。結果發現,化合物T1~T6、T8~T13均無明顯的抑制作用,故選擇化合物T7、T14、T15進行后續研究。
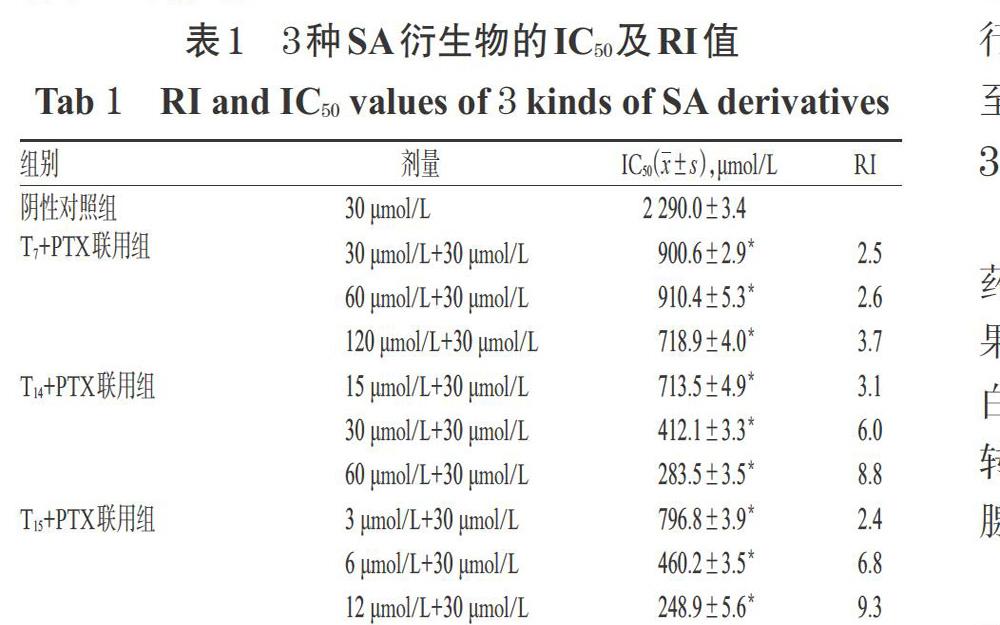
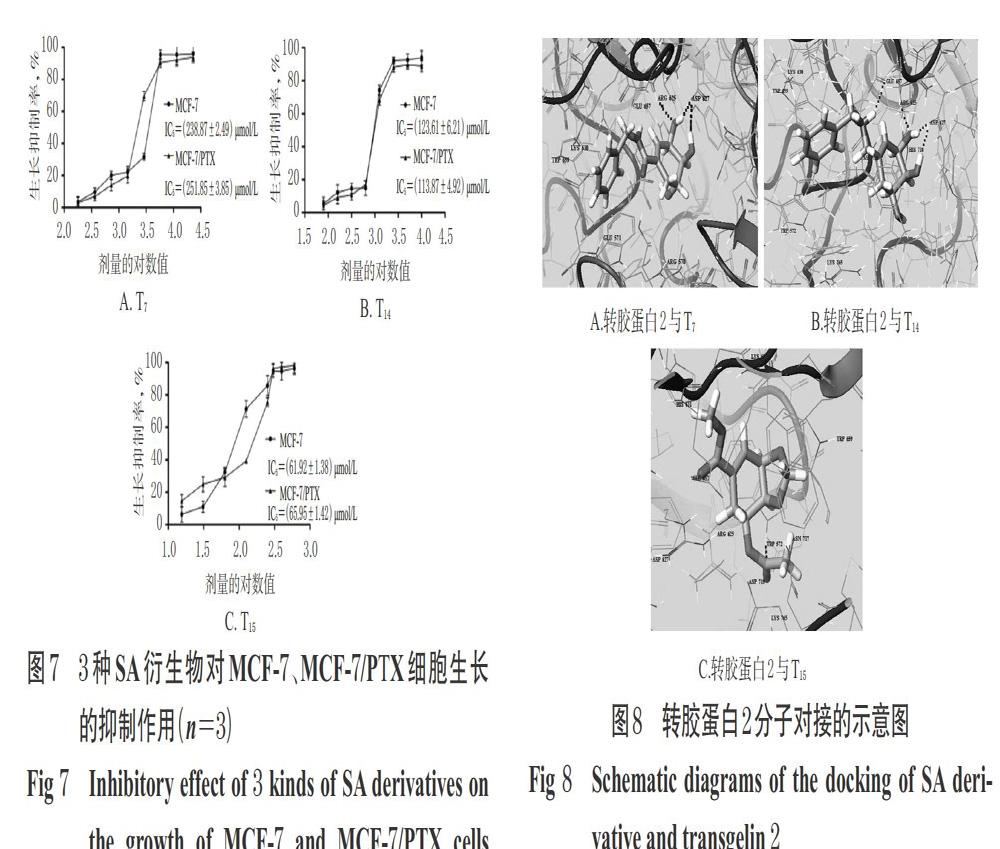
分別取對數生長期的MCF-7、MCF-7/PTX細胞,經胰蛋白酶消化后計數,用完全培養基(即含5%FBS的RPMI 1640培養基,下同)調整細胞密度至1×105個/mL,按每孔100 μL接種于96孔板中,將其隨機分為PTX組以及T7、T14、T15不同劑量組,并設置不含細胞的空白對照組,每組設6個復孔。于37 ℃、5%CO2條件下(下同)培養24 h,待細胞貼壁后,吸棄培養基,空白對照組加入完全培養基180 μL,各給藥組加入含相應藥物的完全培養基180 μL(其中,PTX的劑量為30 μmol/L,T7的劑量分別為3、6、12、24、48、96、192、384 μmol/L,T14的劑量分別為37、74、148、296、592、1 184、2 368、4 376 μmol/L,T15的劑量分別為23.5、46.9、93.8、187.5、375.0、750.0、1 500.0、3 000.0 μmol/L,各藥物劑量設置參考文獻[6])。培養72 h后,吸棄培養基,加入RPMI 1640培養基180 μL和5 mg/mL的MTT試劑20 μL,孵育4 h后,棄去上清液,加入二甲基亞砜150 μL,振搖15 min后,使用酶標儀于490 nm波長處檢測吸光度(A)值,并計算細胞生長抑制率[生長抑制率(%)=(1-藥物組A值/空白對照組A值)×100%]和5%抑制濃度(IC5)。上述試驗重復3次。3種SA衍生物對MCF-7、MCF-7/PTX細胞生長的抑制作用見圖7。
結合圖7,本研究設定T7的逆轉劑量分別為30、60、120 μmol/L,T14的逆轉劑量分別為15、30、60 μmol/L,T15的逆轉劑量分別為3、6、12 μmol/L。參照上述MTT法,以維拉帕米(10 μmol/L,劑量設置參考文獻[16])為陽性對照、以PTX單用為陰性對照,檢測各化合物/陽性對照與PTX聯用對MCF-7/PTX細胞的半數抑制濃度(IC50),并計算逆轉倍數(RI,RI=陰性對照組IC50/聯用組IC50)。以RI作為評價指標,其值越大,表明相應化合物對耐藥細胞的逆轉活性越強[3]。上述試驗重復3次。
采用SPSS 21.0軟件對數據進行統計分析。數據以x±s表示,組間比較采用單因素方差分析或LSD檢驗。P<0.05為差異有統計學意義,結果見表1。由表1可見,各劑量T7、T14、T15+PTX聯用組對MCF-7/PTX細胞的IC50值均顯著低于陰性對照組(P<0.05);其中,T14、T15的RI較高,其最高劑量的RI分別為8.8、9.3,與陽性對照藥物(10.8)相當。
2.3 分子對接
通過Glide 1.0計算機輔助藥物設計軟件將“2.2”項下的逆轉活性成分與轉膠蛋白2的催化區域進行分子對接分析,初步探討SA衍生物對轉膠蛋白2抑制作用的構效關系,結果見圖8。
由圖8A可見,SA衍生物T7的3、4位上的羥基通過提供氫鍵受體(HBA)和氫鍵供體(HBD)與轉膠蛋白2催化區域內的Arg625和Asp627形成氫鍵,可見母核上的多羥基結構是其與酶分子間形成氫鍵的主要結構區域。由圖8B可見,當1位側鏈引入二級胺時,除母核上的多個羥基能形成多個氫鍵外,側鏈氨基也可與轉膠蛋白2催化區域的酸性氨基酸殘基Glu657形成氫鍵;但酰胺鍵和酯鍵取代基則無法形成類似氫鍵,可見二級胺結構對抑制轉膠蛋白2較為有利;此外,若1位連有其他HBD取代基時,對轉膠蛋白2的抑制活性會比無取代的羥甲基強,提示此區域取代基的疏水作用有利于增強衍生物對轉膠蛋白2活性的抑制作用。由圖8C可見,當SA母核上的羥基被供電基團衍生化后,衍生物對轉膠蛋白2的抑制作用明顯增強,提示對母核上的多羥基進行親水性結構衍生化對增強分子的轉膠蛋白2抑制活性至關重要。
3 討論
PTX是臨床乳腺癌標準化療方案中最常用的化療藥之一,然而MDR的發生極大地限制了該藥的治療效果[2]。因此,設計、合成靶向耐藥分子標志物(如轉膠蛋白2)的先導化合物將有助于研究者們研發新的耐藥逆轉藥物,從而提高乳腺癌的臨床治療效果,現已成為乳腺癌相關研究的熱點之一。
本研究以SA為原料,通過酯化反應合成衍生物T1~T3;將SA與丙酮脫水合成縮酮中間體,再通過酰化和水解反應合成酰胺類衍生物T4~T11;將SA中間體三乙酰化,再通過胺酰化、水解反應獲得目標化合物T12;將莽草酸甲酯催化、還原,得到目標化合物T13;將SA中間體酰胺化后,再進行還原、水解反應,獲得目標化合物T14;將莽草酸甲酯與丙酮脫水形成縮酮中間體,再通過乙酰化反應得到目標化合物T15。其中,T4~T15為首次通過上述合成方法獲得的化合物。
隨后本研究在抑制活性初篩的基礎上,通過MTT法對衍生物T7、T14、T15的活性進行了初步評價,發現上述化合物對MCF-7和MCF-7/PTX細胞的生長均具有明顯的抑制作用。在確定其逆轉劑量的基礎上,本研究以維拉帕米為陽性對照(該藥可逆轉腫瘤細胞的MDR[16]),同法考察了上述3種衍生物的IC50和RI值。結果顯示,各劑量T7、T14、T15+PTX聯用組對MCF-7/PTX細胞的IC50值均顯著低于陰性對照組;其中,T14、T15的RI值較高,兩者最高劑量的RI值已達8.8、9.3,與陽性對照藥物相當。這提示,T7、T14、T15可作為MDR逆轉劑的候選化合物。
本研究進一步將上述活性衍生物與轉膠蛋白2的催化區域進行分子對接分析。結果顯示,SA母核上的羥基是SA及其衍生物與酶分子間形成氫鍵的主要結構區域,1位的取代基則可影響1位衍生物的耐藥逆轉活性。當1位側鏈為親酯性基團時,該類衍生物無法與細胞中的轉膠蛋白2結合;而當1位側鏈取代基為酰亞胺和亞胺基團時,衍生物(如T14、T15)則表現出良好的耐藥逆轉活性。筆者認為,在1位側鏈引入二級胺結構或其他HBD取代基除有利于氫鍵的形成外,還可增強分子與酶催化區域的親和性,從而使得衍生物分子更易進入到酶分子的空腔內,進一步有利于衍生物與酶的分子間相互作用。由此可見,堿性側鏈和疏水基團的引入有利于增強衍生物對轉膠蛋白2的抑制活性。分子對接結果還顯示,當SA母核上的羥基被供電基團衍生化后,所得衍生物(T15)對轉膠蛋白2的抑制活性也有所增強,這提示以氫鍵為主的親水性結構衍生化也是增強抑制活性的因素之一。筆者認為,這可能與空間構象較大的化合物更容易進入酶的空腔結構內,使得二者結合更緊密有關。在后續化合物設計中,本課題組將進一步考慮目標化合物HBA和HBD的位置、數量,并充分考慮化合物的空間構象。以上結果從分子水平為SA衍生物對轉膠蛋白2的抑制作用研究提供了參考,也為此類化合物的進一步的結構優化奠定了基礎。
綜上所述,本研究以SA為先導化合物,通過酯化、乙酰化等反應合成了15個SA衍生物,其中12個為首次合成所得化合物。MTT篩選及分子對接結果均顯示,化合物T7、T14、T15對PTX耐藥人乳腺癌細胞均具有一定的逆轉活性,且在1位引入二級胺及疏水基團或對母核羥基進行供電基團衍生化等均可有助于提高衍生物的耐藥逆轉活性。本研究可為乳腺癌PTX耐藥逆轉劑的研發提供候選化合物,但關于上述衍生物的具體耐藥逆轉作用機制還有待進一步的研究。
參考文獻
[ 1 ] JEMAL A,BRAY F,CENTER MM,et al. Global cancer statistics[J]. CA Cancer J Clin,2011,61(2):69-90.
[ 2 ] 蔡江霞,陳思穎,張蔚鵬,等.中藥單體逆轉腫瘤多藥耐藥研究進展[J].中國藥房,2013,24(35):3342-3345.
[ 3 ] ZHANG Y,YE Y,SHEN D,et al. Identification of transgelin-2 as a biomarker of colorectal cancer by laser capture microdissection and quantitative proteome analysis[J]. Cancer Sci,2010,101(2):523-529.
[ 4 ] YOSHINO H,CHIYOMARU T,ENOKIDA H,et al. The tumour-suppressive function of miR-1 and miR-133a targeting TAGLN2 in bladder cancer[J]. Br J Cancer,2011,104(5):808-818.
[ 5 ] CAI J,CHEN S,ZHANG W,et al. Paeonol reverses paclitaxel resistance in human breast cancer cells by regulating the expression of transgelin 2[J]. Phytomedicine,2014,21(7):984-991.
[ 6 ] CHEN S,DONG Q,HU S,et al. Proteomic analysis of the proteins that are associated with the resistance to paclitaxel in human breast cancer cells[J]. Mol Biosyst,2014,10(2):294-303.
[ 7 ] CARBAIN B,HITCHCOCK PB,STREICHER H. New aspects of the Hunsdiecker-Barton halodecarboxylation- syntheses of phospha-shikimic acid and derivatives[J]. Tetrahedron Letters,2010,51(20):2717-2719.
[ 8 ] 徐從立,黃山.紫杉烷衍生物制備方法及應用:中國,CN101386607A[P].2018-3-18.
[ 9 ] 孫快麟,李潤蓀,雷興翰.若干莽草酸衍生物的合成和生物活性研究[J].藥學學報,1990,25(1):73-76.
[10] JUNG M. Conversion of shikimic acid into 2-crotonyloxymethyl-(4R,5R,6S)-4,5,6 -trihydroxy-cyclohex-2 gene analogous Ⅰ inhibitor[J]. J Antibiot:Tokyo,1987,40(5):720-723 .
[11] HUANG FY. Anti-platelet and anti-thrombotic ffects of triacetylshikimic acid in rats[J]. J Cardiovasc Pharmacol,2002,39(2):262-270.
[12] KOVALEV AA,TSVETAEVA DA,GRUDINSKAJA TV. Role of ABC-cassette transporters(MDR1,MRP1,BCRP)in the development of primary and acquired multiple drug resistance in patients with early and metastatic breast cancer[J]. Exp Oncol,2013,35(4):287-290.
[13] BIANCO A,BRUFANI M,MANNA F,et al. Synthesis of a carbocyclic sialic acid analogue for the inhibition of influenza virus neuraminidase[J]. Carbohydr Res,2001,332(1):23-31.
[14] 祝洪艷,孟祥穎,鮑永利,等.北五味子中一種新的莽草酸衍生物的分離純化及其含量測定[J].高等學校化學學報,2010,31(4):679-683.
[15] 王曉強,郭亞健,劉旭英,等. 3,4-O-異亞丙基莽草酸晶體結構分析[J].北京中醫藥大學學報,2001,24(2):46- 48.
[16] 陳曉飛,付良青,劉澤源.維拉帕米逆轉腫瘤多藥耐藥性的研究進展[J].國外醫學藥學分冊,2007,34(6):190- 193.
(收稿日期:2019-07-10 修回日期:2020-02-13)
(編輯:張元媛)

