小鼠股骨遠端缺損植入模型的構建
孫瑩霄,廖 赟,歐陽麗萍,宋文剛
(1.北華大學 藥學院,吉林 吉林 132013;2.上海交通大學醫學院附屬同仁醫院 藥學部,上海 200336)
骨缺損人工植入材料是在出現不能自愈的骨缺損問題后植入患處起修復、填充、固定和支撐等作用的醫用材料[1].目前,科研人員一直致力于開發具有能夠滿足細胞及血管生長要求的人工植入材料,不斷提高其生物性能[2].高分子材料在生產實踐中應用廣泛[3],聚醚醚酮(PEEK)是一種高分子半晶體聚合物[4],其彈性模量介于3~4 GPa之間,相較于傳統鈦合金更接近骨組織[5-6].PEEK具有良好的耐腐蝕性、射線可透過性,對影像學評估影響較小[7-8].課題組前期研究發現,經濃硫酸處理后的磺化PEEK具有三維孔道結構,對PEEK材料的抗菌和成骨性能均有所改善,需進一步進行臨床前動物試驗評價[9].目前,以長骨為植入位置的骨缺損模型研究較少,操作難度較大,提供一種用來評價植入材料骨修復性能的小鼠股骨遠端骨缺損模型.
骨損傷修復涉及一系列復雜的生理和病理過程.骨骼是高度血管化的器官,骨修復與血管生成密不可分.2014年Ralf Adams團隊[10]在Natrue發文提出,骨組織的血管系統存在兩種血管亞型,即H型和L型,并證實H型血管(CD31hiendomucinhivessel,HV)與機體成骨功能存在明顯的正相關.HV具有獨特的形態結構和功能特性,主要分布在脛骨干骺端和股骨內膜附近的小梁骨周圍[11],而股骨遠端與脛骨相比具有更大的直徑,更有利于作為植入位置評價植入材料的生物相容性.
選用具有抗菌性且透射線性的磺化PEEK做為植入材料,應用C57BL/6J雌性小鼠為模型動物,以H型血管豐富的股骨遠端為植入部位,構建一種適用于評價植入材料生物性能的股骨遠端骨缺損植入模型,為新型植入材料的開發及應用提供合適的動物模型.
1 材料與方法
1.1 實驗動物
由上海南方模式動物實驗中心提供雌性7周齡C57BL/6J小鼠3只,體重為18~20 g,小鼠自由進食并觀察一周,無異常后進行實驗.
1.2 實驗材料與設備
電子天平(上海精天FA200),micro-CT成像儀(Scanco viva40,瑞士),電鉆(Dremel Sty-LusTM 1100-01,美國),掃描電子顯微鏡(FE-SEM,Hitachi S-4800,Japan),磁力攪拌器,聚醚醚酮(江蘇君華),戊巴比妥鈉(北京普博斯生物),75%乙醇,生理鹽水(上海現代哈森藥業有限公司),注射用青霉素鈉(華北制藥).
1.3 實驗材料與設備
使用濃硫酸對PEEK進行磺化處理,具體步驟如下:在燒杯中加入適量濃硫酸,并置于磁力攪拌器上.將PEEK棒材(直徑1 mm、長度5 mm)放入燒杯,打開磁力攪拌器調節至合適轉速(確保PEEK在磺化過程中不黏連),室溫下處理10 min.用超純水清洗磺化后的材料3遍,晾干備用.將磺化聚醚醚酮置于容積為200 mL的反應釜中,加入70 mL超純水,120 ℃水熱處理4 h.水熱處理后,磺化聚醚醚酮取出并用超純水清洗3遍,晾干備用.植入前,使用酒精滅菌24 h后置于無菌器皿內備用.
1.4 植入模型的構建
手術器械消毒:手術用鑷子,剪刀,持針器,鉆頭,等手術器械高溫消毒2 h后置于無菌器皿內備用.麻醉:配制1%的戊巴比妥鈉備用.用天平稱量小鼠體重,并按20 mg/kg劑量腹腔注射1%戊巴比妥鈉麻醉小鼠.備皮:用剃毛器剃除小鼠手術部位及周邊的被毛;用75%的酒精棉球和碘伏分別擦拭手術部位及周邊皮膚3次.暴露股骨遠端:將小鼠截石位屈膝置于手術操作臺上.沿股骨方向剪開膝關節外皮膚,并適當撐開.在膝關節髕韌帶內側斜上方將股三頭肌向外側翻開暴露股骨遠端.開孔:先用低速骨鉆在股骨遠端髁間鉆直徑0.4 mm的圓孔缺損,更換0.8 mm鉆頭進一步將圓孔擴大至1.0 mm直徑.植入材料:將滅菌后的磺化聚醚醚酮材料由上述圓孔小心地置入股骨骨髓腔內.消毒縫合:無菌生理鹽水沖洗傷口,滴加青霉素鈉溶液(8萬單位)消毒,縫合傷口.小鼠給予充足的食物和水喂養.術后肌肉注射青霉素8萬單位/d,連續3 d.
1.5 觀察項目與檢測方法
術后觀察小鼠健康情況和后肢膝關節活動情況.2周后,處死小鼠,并分離小鼠股骨,觀察小鼠股骨遠端外觀.采用micro-CT成像技術分析小鼠股骨缺損模型:使用三維重建觀察材料的植入位置和骨小梁微結構的改變,并分析計算骨小梁參數.
1.6 統計學處理
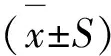
2 結果與分析
2.1 磺化PEEK掃描電鏡的形貌表征
如圖1左所示,在掃描電鏡下觀察PEEK表面平坦致密無孔洞;圖1右所示磺化PEEK表面呈均勻疏松多孔的網狀結構.掃描電鏡結果表明應用濃硫酸成功將PEEK磺化.
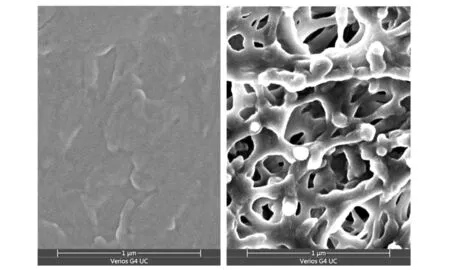
圖1 材料表面形貌
2.2 股骨遠端植入模型的構建
小鼠截石位屈膝在膝關節處沿股骨方向剪開皮膚,皮膚開口長度約0.5 cm,如圖2a所示,白色長條組織為髕韌帶.由膝關節內側向外側翻開肌肉見股骨遠端,股骨遠端兩側突起結構為股骨髁,見圖2b中黑色箭頭所示.如圖2c~d所示,兩側骨股髁中點為圓點用電鉆鉆開1 mm直徑的圓孔缺損,圓孔缺損在股骨遠端中央位置,除股骨位置以外未造成其他缺損.如圖2e所示,將材料置入圓孔內,復位側翻的股三頭肌及髕骨,如圖2f所示,小鼠膝關節無異常錯位現象,如圖2g所示,關閉小鼠創口后,小鼠創面無出血.
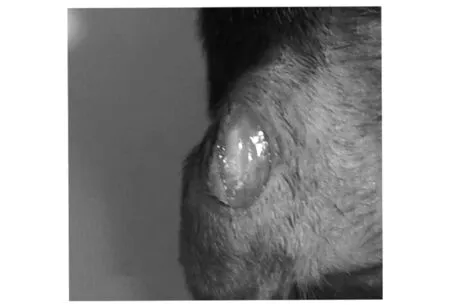
(a)剪開皮膚
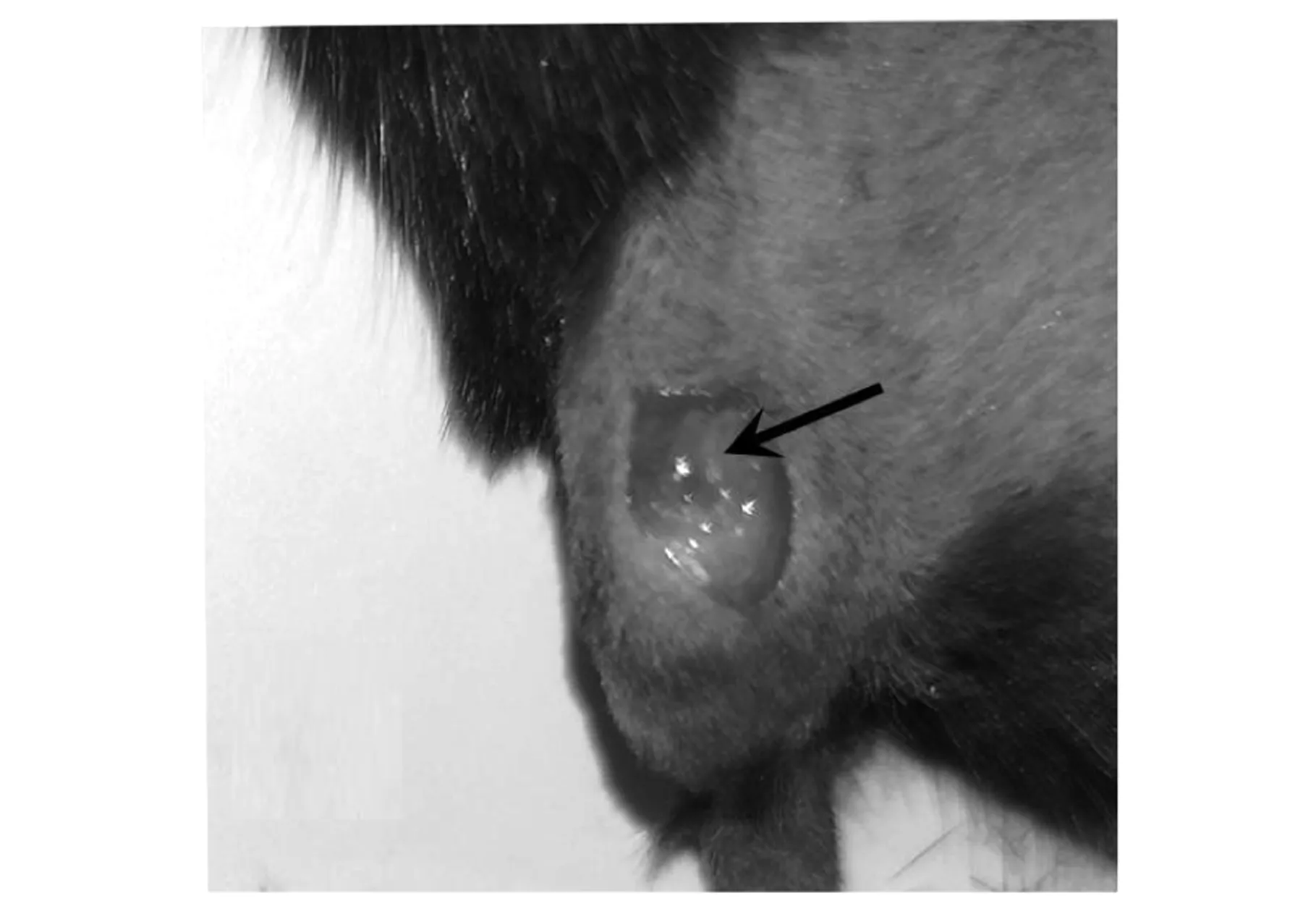
(b)暴露股骨遠端
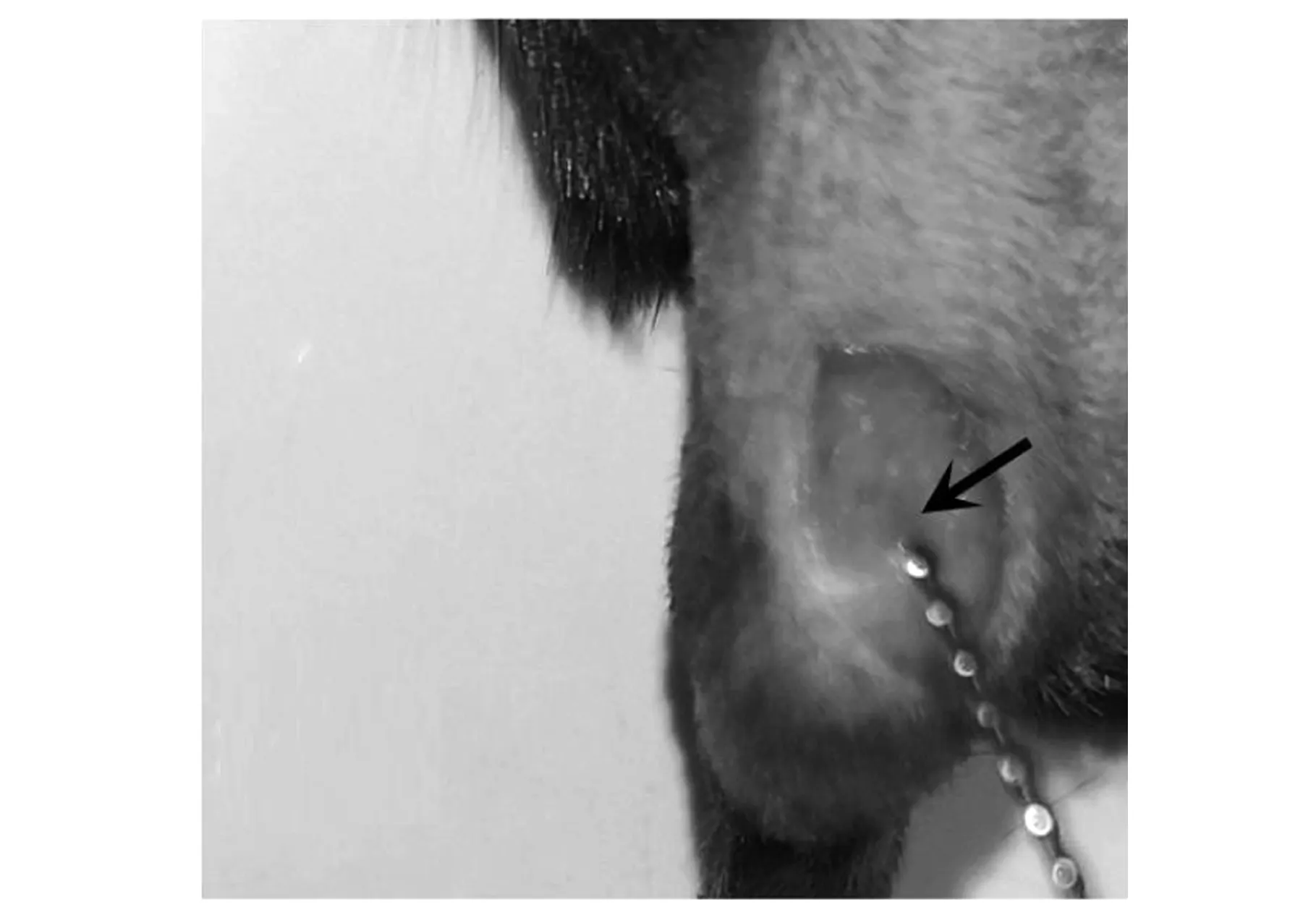
(c)鉆孔

(d)鉆孔
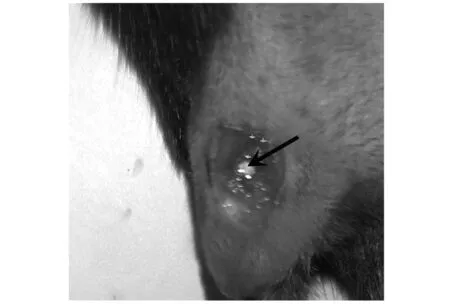
(e)植入材料
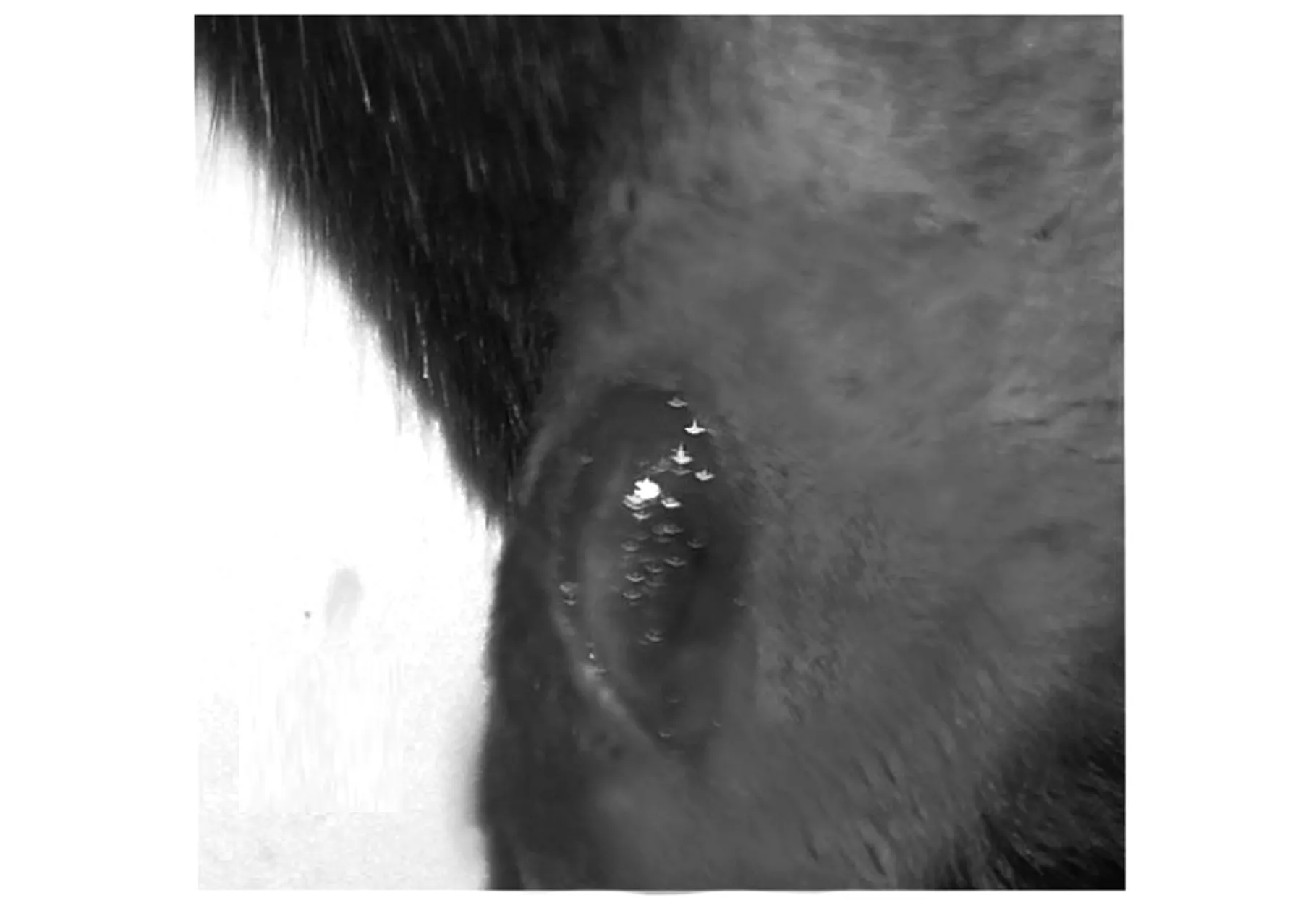
(f)復位
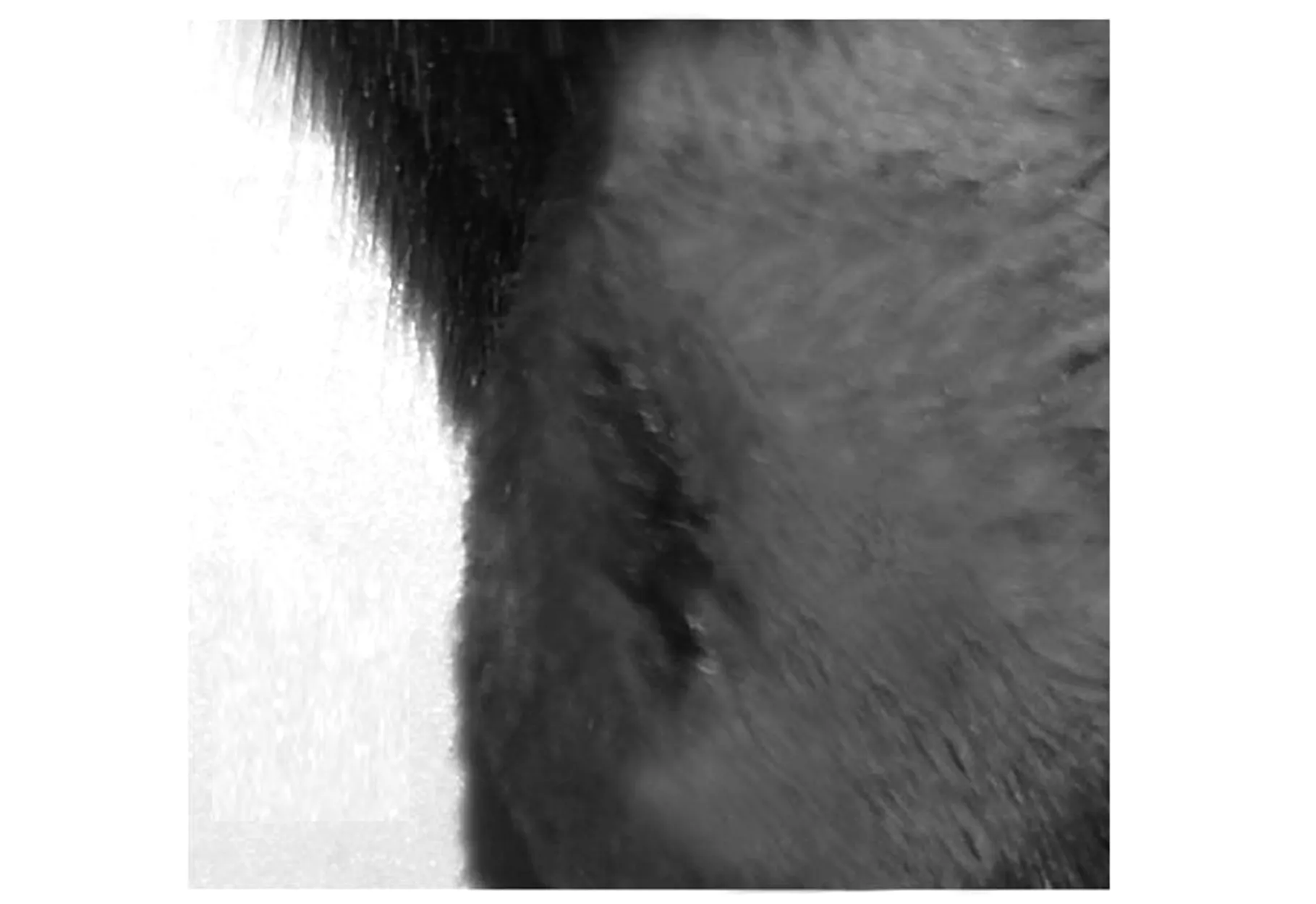
(g)關閉創口圖2 小鼠股骨遠端骨缺損模型的構建
2.3 小鼠術后活動情況
在小鼠股骨遠端造成開放性創傷,若造成小鼠腿部活動受限,將影響小鼠正常飲食,造成植入材料的體內評估出現誤差.觀察發現實驗小鼠行單側股骨遠端植入模型手術后小鼠膝關節活動正常,小鼠飲食行動均正常,所有小鼠存活至取材.
2.4 鼠股骨骨缺損模型外觀形態
植入2周后,將小鼠處死并分離取出股骨.如圖3所示,右側為股骨遠端,黑框內所示為植入材料位置,植入區域的顏色較淺.小鼠股骨骨干完整,股骨遠端組織結構無明顯缺損,植入材料位于股骨遠端骨髓腔內.

圖3 股骨骨缺損模型外觀照片
2.5 micro-CT掃描三維骨結構
micro-CT掃描結果如圖4所示.
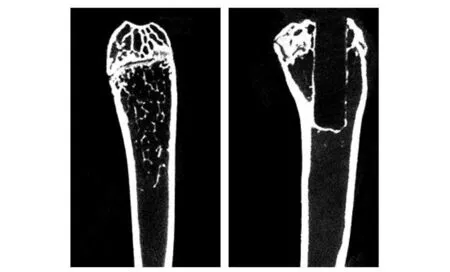
圖4 股骨遠端micro-CT三維圖片
圖4右顯示,植入材料位于股骨遠端至小鼠股骨骨髓腔內,兩組骨小梁結構相對比,圖4左圖像顯示對照組股骨不規則細絲狀的骨小梁結構,模型組股骨內有隱約可見的骨小梁結構.
2.6 骨小梁分析
骨小梁數量分析結果如圖5所示,模型組小鼠骨小梁數量較對照組骨小梁數量顯著性降低(t檢驗,P<0.05).骨小梁體積分析結果如圖6所示,模型組骨小梁體積與對照組骨小梁體積比較,模型組骨小梁體積低于對照組(t檢驗,P<0.001).
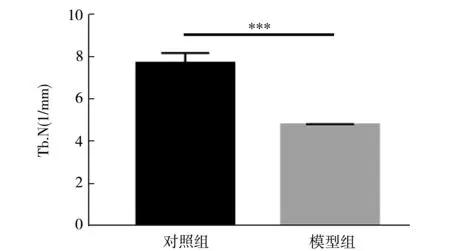
圖5 骨小梁數量
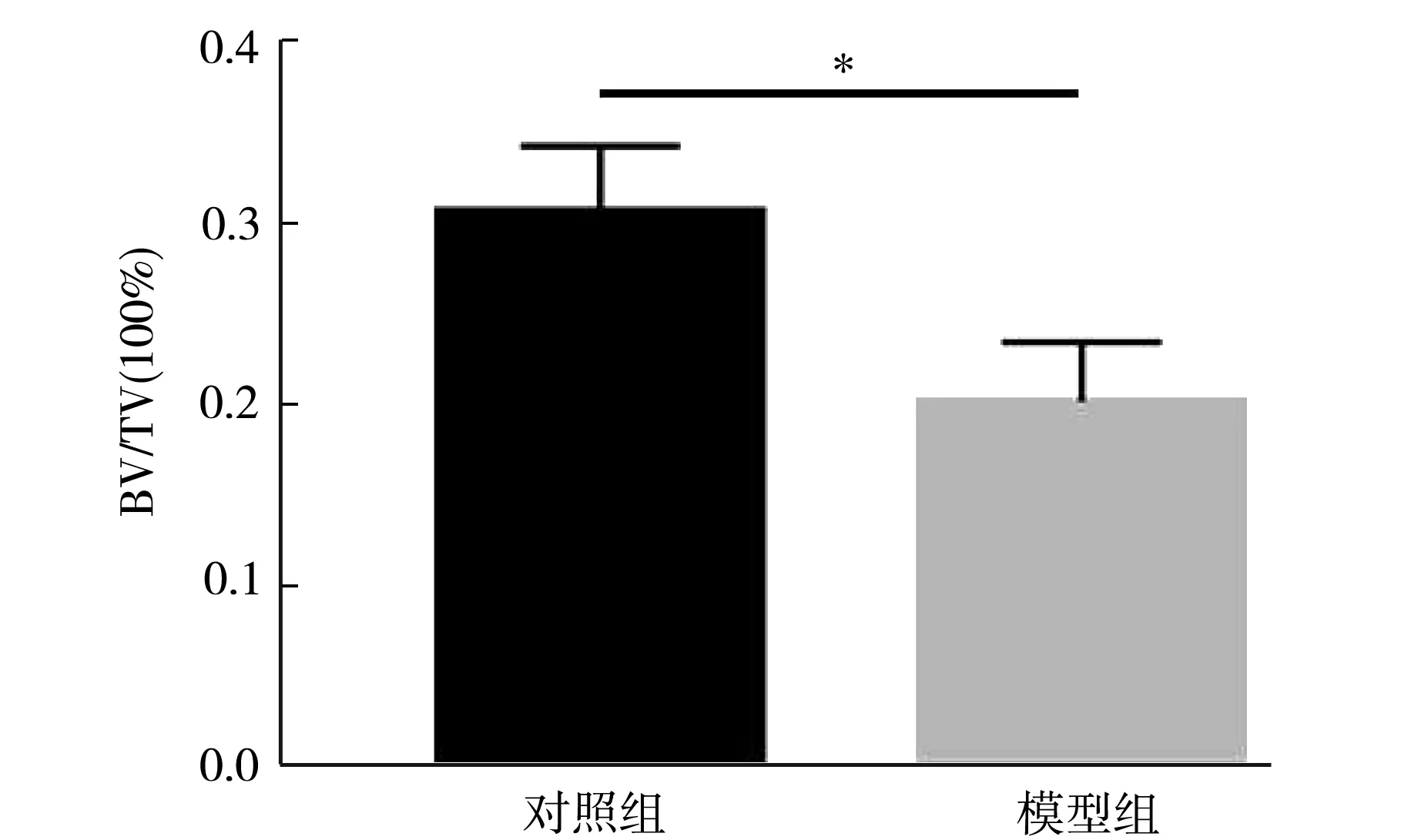
圖6 骨小梁體積
3 結 論
理論上大型動物如犬、豬、羊等與人體骨組織結構類似,是研究骨骼愈合機制的理想實驗動物.然而,大型動物實驗成本高,并且其骨組織愈合能力慢,實驗周期長.常用來構建骨缺損模型的小型動物主要有小鼠、大鼠、兔等.鼠科動物不僅具有較強的抗感染能力,且圍手術期易于管理[12],因此鼠科動物常被用來研究材料對骨缺損的修復能力.實驗動物的年齡也是影響實驗結果準性的因素.為避免生長情況對實驗結果準確性的影響,本實驗選用8周齡雌性C57BL /6J小鼠作為實驗動物.
動物模型是醫藥產業發展的支撐條件,構建合適的動物模型是準確評價植入材料生物相容性的關鍵[13].評價植入材料的體內生物性能常選取的模型部位主要有牙槽骨、顱骨、脛骨、椎骨、股骨等[14-15].本實驗選擇股骨遠端作為損傷部位主要有兩方面原因:小鼠顱骨、脛骨、牙槽骨等部位手術操作困難;研究發現,H血管在股骨遠端含量豐富[6],因此選取股骨遠端作為損傷植入部位不僅利于材料對骨影響的評價,而且可對骨特異性H血管進行分析.
PEEK具有耐腐蝕,彈性模量與骨相近的特點已作為醫用材料應用于臨床[16-17].然而,PEEK的生物相融性、骨整合能力等方面仍有待進一步提高.研究發現濃硫酸處理后的磺化PEEK具有三維孔道結構[18-19],對PEEK材料的抗菌和成骨性能均有所改善[7].其表面的三維孔道結構又可以作為促成骨藥物載體進一步提高生物活性及成骨性能[20-21],需開展有效的動物實驗為磺化PEEK的臨床應用提供研究基礎.
為避免開孔造成股骨斷裂,采用多尺寸鉆頭循序漸進的方式進行開孔.先用0.4 mm直徑的鉆頭在股骨遠端中間位置初步鉆一個圓孔缺損,再使用0.8 mm鉆頭擴大到1.0 mm.術后觀察顯示,小鼠活動自由未發生感染;micro-CT掃描成像分析結果顯示植入材料位于股骨骨髓腔內,模型組小鼠骨小梁數量及骨小梁體積較對照組有明顯差異.上述結果表明使用多尺寸鉆頭循序漸進的方式進行開孔可成功構建小鼠股骨遠端骨缺損模型且不會造成股骨斷裂.
綜上所述:使用多尺寸鉆頭循序漸進的方式進行開孔可在8周齡雌性C57BL /6J小鼠股骨遠端成功構建骨缺損.植入磺化PEEK棒,小鼠股骨未發生骨折現象,術后小鼠活動飲食均未受影響,說明股骨遠端骨缺損模型構建成功.

