生物法合成α-酮戊二酸及其衍生物的研究進展
朱福周,董解榮,陳 寧,張成林,2*
(1.天津科技大學 生物工程學院,天津 300457;2.菱花集團有限公司,山東 濟寧 272073)
α-酮戊二酸(α-ketoglutarate,α-KG)是三羧酸循環的重要中間產物之一,參與生物體內氨基酸、維生素和有機酸的合成及能量代謝[1-2]。α-酮戊二酸經轉氨基作用形成L-谷氨酸進入氮代謝中,是連接細胞內碳代謝和氮代謝的關鍵節點[1]。常見的α-酮戊二酸衍生物包括γ-氨基丁酸(γ-aminobutyric acid,GABA)、5-氨基乙酰丙酸(5-aminolevulinic acid,5-ALA)以及由α-酮戊二酸依賴的羥化酶催化生成的羥化物如4-羥基異亮氨酸(4-hydroxyisoleucine,4-HIL)等。迄今為止,α-酮戊二酸及其衍生物已被廣泛應用于化工、食品、醫藥、日化等諸多領域[3-6],具有非常廣泛的應用前景。
工業化生產α-酮戊二酸、γ-氨基丁酸及5-氨基乙酰丙酸主要采用化學合成法,4-羥基異亮氨酸主要采用是提取法。然而,上述工藝多存在生產工藝復雜、分離困難收率低、易引起環境污染等不足,限制其大規模生產和應用[2,7-9]。相比而言,生物合成法具備成本低、效率高、環境友好等優勢。但總體而言,生物法合成α-酮戊二酸及其衍生物尚處于起步階段。基于此,本文從α-酮戊二酸及其衍生物的應用、生物合成途徑及其代謝調控、生物法合成策略等方面進行了綜述,以期為其生產菌株的代謝工程構建和工藝開發提供借鑒。
1 α-酮戊二酸的應用
1.1 α-酮戊二酸在醫藥領域中的應用
α-酮戊二酸作為合成多種藥物的重要前體物質被廣泛應用于醫藥領域。α-酮戊二酸可與5-羥甲基糠醛合成抗氧化劑,具有提高抗氧壓的功能[10];能與丙三醇、1,2,4-丁三醇或1,2,6-己三醇通過聚合反應生成三醇-α-酮戊二酸聚合物,從而增強其機械性能和化學特性,廣泛應用于組織工程學和藥物傳遞等領域[11]。此外,α-酮戊二酸還具有緩解尿毒癥、有效促進術后傷口愈合、治療營養不良以及控制血脂水平等功能[6,12]。
1.2 α-酮戊二酸在食品領域中的應用
α-酮戊二酸作為運動類飲料的營養成分可用于提供能量,其被吸收后與運動員體內過多的氨結合以防止氨中毒,同時還用作飲料中的抗菌劑。α-酮戊二酸還可與精氨酸結合形成精酮合劑,具有補充能量、抗疲勞、提高其訓練時表現的功能[13]。此外,α-酮戊二酸鹽還具有增強奶酪和臘腸等發酵食品風味的功能,被廣泛應用于食品工業中[5]。
1.3 α-酮戊二酸在畜牧業和農業中的應用
α-酮戊二酸具有促進牲畜生長、增加骨骼密度、增強免疫功能、提高抗應激能力以及提高繁殖率等功能,因此作為營養強化劑應用于動物飼料中[14]。α-酮戊二酸是植物氨同化必需的碳架及信號分子,廣泛參與碳和氮代謝及其調節。在農業中,α-酮戊二酸常用于增強農作物抗干旱性能[15]。
除用于上述領域外,α-酮戊二酸還可用作化妝品的主要成分,具有清除自由基、緩解褐斑等功效。
2 α-酮戊二酸的合成方法
目前α-酮戊二酸的合成方法主要包括化學合成法、酶法和微生物發酵法。但工業上主要采用化學合成法,該方法是以琥珀丁二酸二乙酯、草酸二乙酯等為原料,經縮合、水解、蒸餾濃縮、結晶等工藝合成α-酮戊二酸,收率最高為75%[16-17]。該技術在多步復雜的合成反應過程中會產生大量副產物,其中包括氰化物等劇毒品、重金屬污染物以及易爆物等,不僅加大了分離難度、降低了生產率,同時也增加了生產的危險性[16-17]。
早期酶催化法生產α-酮戊二酸是利用谷氨酸脫氫酶(glutamate dehydrogenase,GDH)以谷氨酸為底物合成,但由于谷氨酸脫氫酶對α-酮戊二酸的親和力高于谷氨酸且該反應需要輔酶煙酰胺腺嘌呤二核苷磷酸(nicotinamide adenine dinucleotide phosphate,NADP+),因此未被工業化應用[18]。近年來,有研究者利用L-谷氨酸氧化酶(L-glutamate oxidase,GLOD)以谷氨酸為底物合成α-酮戊二酸[19],但該方法在反應過程中產生的過氧化氫嚴重抑制酶活性[20]。盡管添加過氧化氫酶(catalase,CAT)可消除過氧化氫,但因生產工藝復雜化并增加生產成本未被工業化應用[20]。
與化學合成法、酶催化法相比,微生物發酵法具有成本低、收率高、污染輕及副產物少等優點,具有很大的工業化生產的潛力[21]。目前已發現熒光假單胞菌(Pseudomonas fluorescens)、銅綠假單胞菌(P.aeruginosa)、粘質沙雷氏菌(Serratia marcescenss)、石蠟節桿菌(Arthrobacter paraffineus)、谷氨酸棒桿菌(Corynebacterium glutamicum)、解脂亞洛酵母(Yarrowia lipoytica)及光滑球擬酵母(Torulopsis glabrata)等多種微生物能夠過量合成α-酮戊二酸,其中谷氨酸棒桿菌、解脂亞洛酵母及光滑球擬酵母生產性能最好。解脂亞洛酵母發酵生產α-酮戊二酸具有發酵周期長、產酸速率低、副產物過高等不足,限制了其工業化應用[17]。谷氨酸棒桿菌因具有安全穩定及遺傳背景清晰的特性被廣泛用于氨基酸、有機酸及核苷的發酵生產。谷氨酸棒桿菌因三羧酸循環(tricarboxylic acid cycle,TCA)中檸檬酸至α-酮戊二酸代謝流較強的性能[2]。盡管利用該菌株合成α-酮戊二酸的發酵周期大幅度縮短,但其生產效率還需進一步提高。
3 α-酮戊二酸的生物合成途徑及其代謝調控
3.1 α-酮戊二酸的生物合成途徑
α-酮戊二酸是微生物三羧酸循環中的中間代謝產物,葡萄糖進入細胞后經糖酵解途徑生成丙酮酸,其在丙酮酸脫氫酶復合體(pyruvate dehydrogenase complex,PDHC)的作用下形成乙酰輔酶A。后者與草酰乙酸依次在檸檬酸合酶(citrate synthase,CS)、順烏頭酸酶(cis-aconitase,ACO)、異檸檬酸脫氫酶(isocitrate dehydrogenase,IDH)的作用下生成α-酮戊二酸。α-酮戊二酸可在α-酮戊二酸脫氫酶復合體(α-ketoglutarate dehydrogenase complex,OGDC)的作用下生成琥珀酰輔酶A以完成三羧酸循環[22];亦可在谷氨酸脫氫酶的作用下生成谷氨酸[23];此外還可與谷氨酰胺經谷氨酸合酶(glutamate synthase,GOGAT)催化生成谷氨酸(見圖1)。
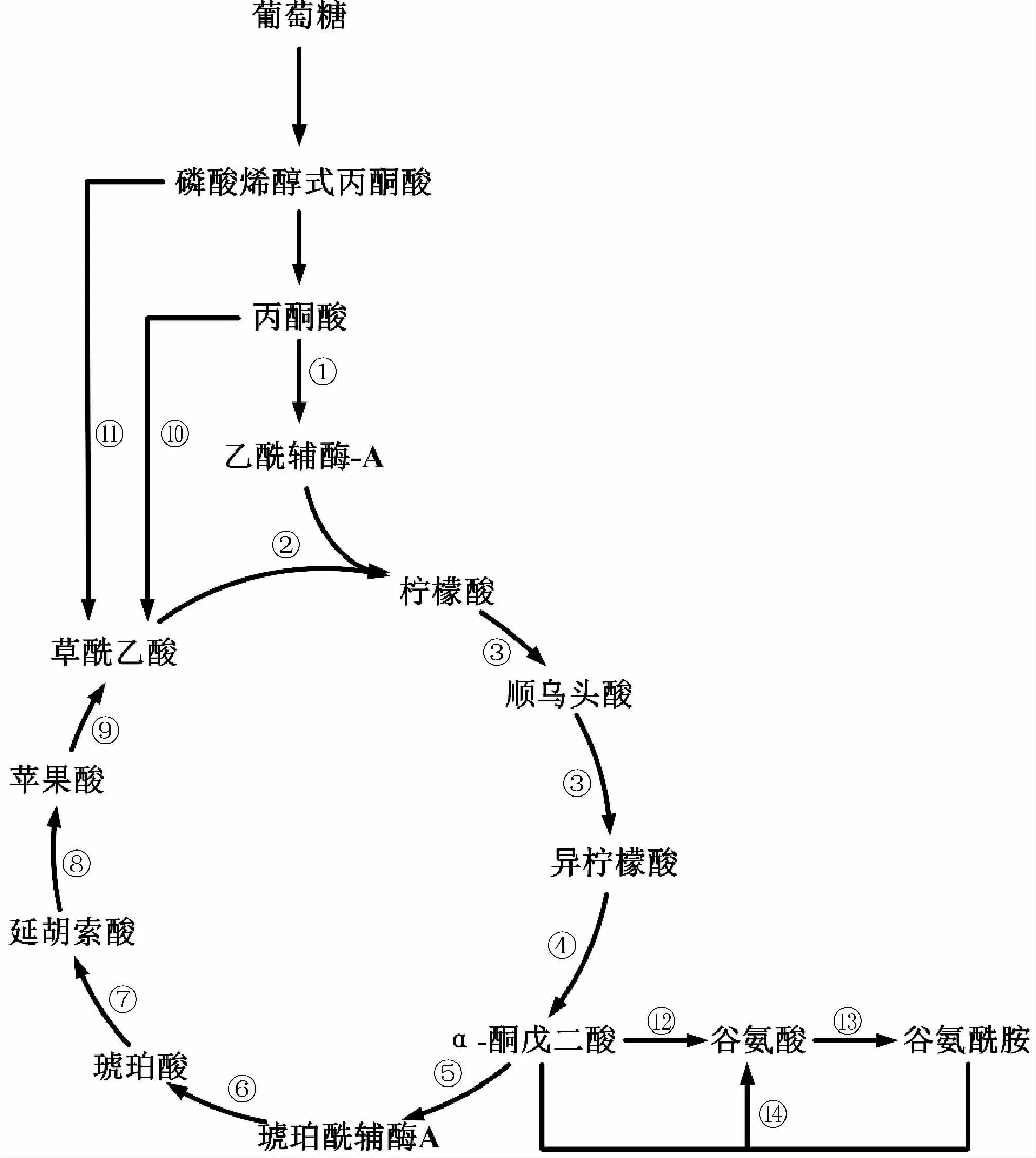
圖1 α-酮戊二酸的生物合成途徑Fig.1 Biosynthetic pathway of α-ketoglutarate
3.2 α-酮戊二酸生物合成的代謝調控
α-酮戊二酸的生物合成途徑中有3個重要代謝節點,分別為磷酸烯醇式丙酮酸-丙酮酸-草酰乙酸節點、檸檬酸節點和α-酮戊二酸節點[23]。草酰乙酸是合成α-酮戊二酸的重要前體物質,除來源于三羧酸循環外,還可通過回補途徑(replenishment pathway,RP)獲得,分別由丙酮酸經丙酮酸羧化酶(pyruvate carboxylase,PC)和磷酸烯醇式丙酮酸經磷酸烯醇式丙酮酸羧化酶(phosphoenolpyruvate carboxylase,PEPC)催化生成。其中前者以生物素為輔酶,后者通常受天冬氨酸和α-酮戊二酸的反饋抑制。不同微生物含有上述1種或2種羧化酶,如大腸桿菌僅含磷酸烯醇式丙酮酸羧化酶、枯草芽孢桿菌及解脂亞洛酵母僅含丙酮酸羧化酶、谷氨酸棒桿菌同時含有磷酸烯醇式丙酮酸羧化酶和丙酮酸羧化酶。
檸檬酸節點是控制三羧酸循環代謝流量的重要代謝節點,檸檬酸合酶是該節點的關鍵酶,其活性往往受檸檬酸、腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)及NADP的反饋抑制[24]。α-酮戊二酸節點決定其代謝去向,α-酮戊二酸分別在α-酮戊二酸脫氫酶和谷氨酸脫氫酶的催化下合成琥珀酰輔酶A和谷氨酸。α-酮戊二酸脫氫酶以硫胺素為輔酶。因此,當培養基中硫銨素不足時,α-酮戊二酸會因三羧酸循環代謝流減弱而流向谷氨酸。在谷氨酸棒桿菌中,α-酮戊二酸脫氫酶的活性除受硫銨素調節外,還受抑制蛋白(oxoglutarate dehydrogenase inhibitor,OdhI)的抑制作用。OdhI與α-酮戊二酸脫氫酶結合后使其喪失活性,但OdhI第14位蘇氨酸被絲氨酸/蘇氨酸蛋白激酶PknG磷酸化后不能與α-酮戊二酸脫氫酶結合,從而該抑制作用被解除。但當培養基中生物素充足時,OdhI不能被PknG磷酸化從而恢復其抑制作用[24]。
目前共發現3種谷氨酸脫氫酶,分別以NADH(EC 1.4.1.2)、NADPH(EC 1.4.1.4)以及NADPH或NADH(EC 1.4.1.3)為輔酶。不同微生物含谷氨酸脫氫酶種類不同,如大腸桿菌含EC 1.4.1.4、枯草芽孢桿菌含EC 1.4.1.2、谷氨酸棒桿菌含EC 1.4.1.3和EC 1.4.1.4、解脂亞洛酵母含EC 1.4.1.2和EC 1.4.1.4。研究發現,谷氨酸棒桿菌中EC 1.4.1.4起主要作用,但其對α-酮戊二酸的米氏常數(Km值)(5.7 mmol/L)高于α-酮戊二酸脫氫酶(0.02~0.13 mmol/L)[25]。前期研究發現,在谷氨酸棒桿菌培養過程中減少生物素或NH4+后,α-酮戊二酸脫氫酶和谷氨酸脫氫酶活性被抑制,α-酮戊二酸大量積累[26]。
4 發酵法生產α-酮戊二酸的研究進展
4.1 α-酮戊二酸生產菌種的選育
發酵法生產α-酮戊二酸最早始于LOCKWOOD L B等[27]利用熒光假單胞菌生物合成α-酮戊二酸的研究,隨后多種微生物均被發現可以過量合成α-酮戊二酸[4,28]。谷氨酸棒桿菌及解脂亞洛酵母和光滑球擬酵母等酵母菌因具有生理和遺傳特性清晰、生長快速、底物譜寬等特性被認為是發酵法生產α-酮戊二酸的理想菌株。因此,α-酮戊二酸生產菌種的選育研究主要集中在上述3種微生物,其主要策略包括增強α-酮戊二酸前體物的供應以及弱化競爭代謝支路。
4.1.1 增強α-酮戊二酸前體物的供應
陳堅等[29]于解脂亞洛酵母(Y.lipoytica)WSH-Z06過表達丙酮酸脫氫酶E1編碼基因PDA1以提高其活性。結果表明PDA1過表達菌株胞內丙酮酸含量顯著降低,經發酵144 h,其α-酮戊二酸產量由37.6 g/L提高至43.3 g/L。VENELINA Y等[30]于解脂亞洛酵母(Y.lipolytica)H355過量表達了NADP+依賴型的異檸檬酸脫氫酶編碼基因IDP,以增強α-酮戊二酸前體物異檸檬酸的供應。經發酵117 h,重組菌株Y.lipolyticaH355Aα-酮戊二酸產量達到167.6 g/L,較出發菌株提高6.8%,副產物丙酮酸的積累量顯著下降。孫蘭超等[31]于谷氨酸棒桿菌(C.glutamicum)GDK-10過表達磷酸烯醇式丙酮酸羧化酶編碼基因ppc以增加其草酰乙酸供應,重組菌株GDK-12的單位菌體產量出發菌株提高38.59%。
4.1.2 弱化競爭代謝支路
JO J H等[32]以谷氨酸棒桿菌(C.glutamicum)HH109為出發菌株,敲除其異檸檬酸裂解酶編碼基因aceA、谷氨酸脫氫酶編碼基因gdh和谷氨酸合酶編碼基因gltB,以阻斷異檸檬酸的消耗及α-酮戊二酸向谷氨酸的代謝,獲得的重組菌株谷氨酸棒桿菌(C.glutamicum)JH107α-酮戊二酸產量達到51.1 g/L,較出發菌株提高68%。趙巖等[33]以谷氨酸棒桿菌(C.glutamicum)GDK-10為出發菌株,通過敲除乳酸脫氫酶編碼基因ldh、乙酸激酶編碼基因ackA、丙酮酸醌氧化還原酶編碼基因pqo,以減少副產物乳酸、乙酸和丙酮酸積累量。結果表明,ldh和pqo基因敲除菌株C.glutamicumGDK-14和C.glutamicumGDK-15的α-酮戊二酸產量分別為40.18 g/L和31.94 g/L,較出發菌株降低8.54%和27.9%;ackA基因敲除菌株(C.glutamicum)GDK-16的α-酮戊二酸產量為47.88g/L,較出發菌株提高8.99%。LIY等[26]以谷氨酸棒桿菌C.glutamicumGKG-047為出發菌株,敲除其谷氨酸脫氫酶編碼基因gdh1和gdh2,獲得的重組菌(C.glutamicum)GKGDα-酮戊二酸產量達到45.6 g/L。薛寧等[34]以谷氨酸棒桿菌C.glutamicumGKGD為出發菌株,分別敲除異檸檬酸裂解酶編碼基因aceA和谷氨酸合酶編碼基因gltB,以減少異檸檬酸向乙醛酸循環的代謝流量及α-酮戊二酸的消耗。獲得的重組菌株GKGD-1和GKGD-2搖瓶條件下α-酮戊二酸產量分別為12.86 g/L和13.81 g/L,較出發菌株提高14.72%和7.39%,轉化率分別提高9.76%和5.43%。
4.2 發酵法生產α-酮戊二酸的工藝優化
4.2.1 培養基優化
韓洪軍等[35]向培養基中添加玉米漿和表面活性劑吐溫60以增加生長因子供應并增強細胞膜通透性,并考察其對谷氨酸棒桿菌GKGD發酵生產α-酮戊二酸的影響。結果表明,在初始發酵培養基中添加6 mL/L的玉米漿、在發酵10 h添加1 mL/L的吐溫60,α-酮戊二酸的產量達到17.9 g/L,較未優化前提高了198%。
ZENG W等[36]研究了不同初始濃度甘油對解脂亞洛酵母(Y.lipolytica)WSH-Z06細胞生長和α-酮戊二酸合成的影響。發現當培養基中初始甘油質量濃度為50 g/L時,α-酮戊二酸的產量為67.4 g/L,丙酮酸產量達到39.1 g/L,較優化前分別提高了9.6%和176.8%,實現了α-酮戊二酸和丙酮酸聯產。彭小雨等[37]考察了氮源濃度以及硫銨素濃度對解脂亞洛酵母(Y.lipolytica)WSH-Z06 C3聯產酮酸的影響。結果表明,大豆蛋白粉和硫銨素質量濃度分別為4 g/L和0.2 μg/L時,α-酮戊二酸和丙酮酸的總產量最高(78.2 g/L),較優化前提高了57.9%。
4.2.2 發酵條件優化和過程控制
CHERNYAVSKAYA O G等[38]以乙醇為碳源,考察了溶氧對解脂亞洛酵母(Y.lipolytica)N1發酵生產α-酮戊二酸的影響。發現低溶氧(5%)時菌株對NH4+的利用速率比高溶氧(50%)時快,低溶氧條件下的產量為49 g/L,較高溶氧條件下提高了22.5%。進一步發現溶氧水平極大的影響Y.lipolyticaN1對NH4+的利用速率,進而影響α-酮戊二酸的積累。
YU Z等[39]考察了pH對解脂亞洛酵母(Y.lipolytica)WSH-Z06合成α-酮戊二酸的影響。發現低pH有利于α-酮戊二酸的合成,當pH維持在3.0時,α-酮戊二酸的產量達到53.4 g/L,較優化前提高了142%。王炫等[40]對α-酮戊二酸生產菌谷氨酸棒桿菌(C.glutamicum)KGA-3的發酵條件進行系統優化,分別研究了pH控制方式、初始糖質量濃度、發酵溫度、搖瓶裝液量等因素對α-酮戊二酸產量的影響,最終確定培養基初始pH為7.0,初始糖質量濃度為90 g/L,發酵溫度為32 ℃,搖瓶裝液量為25 mL/500 mL,優化后α-酮戊二酸的產量和轉化率分別為25.8 g/L和35.1%,較優化前分別提高了45.5%和11.5%。張海林等[41]通過動力學分析確定了通過調控pH控制菌體濃度促進α-酮戊二酸積累的策略,發酵初期控制pH值為6.0,菌體質量濃度達到10 g/L后pH自然降至3.0并保持至發酵結束,α-酮戊二酸產量為54 g/L,產量和生產強度分別較未優化前提高19.3%和17.8%。
5 α-酮戊二酸主要衍生物的應用及生物合成進展
5.1 γ-氨基丁酸及其生物合成
γ-氨基丁酸是天然非蛋白質氨基酸,廣泛存在于動物、植物以及微生物中。γ-氨基丁酸可以抑制大腦中神經遞質的傳遞,進而影響到對壓力的應激反應[42]。此外,γ-氨基丁酸還可以提高生長激素水平,參與大腦中蛋白質的合成,具有降血壓、利尿、治療糖尿病等功能[43]。
目前已報道的生物法合成γ-氨基丁酸的菌株主要包括乳酸菌、大腸桿菌和谷氨酸棒桿菌。α-酮戊二酸在谷氨酸脫氫酶和谷氨酸脫羧酶的催化下生成γ-氨基丁酸。其生產菌株的代謝工程改造策略包括過表達磷酸烯醇式丙酮酸羧化酶或丙酮酸羧化酶編碼基因及敲除蘋果酸脫氫酶編碼基因以增強草酰乙酸供應[7]、過表達谷氨酸脫羧酶編碼基因以促進γ-氨基丁酸的合成[44-45]、敲除γ-氨基丁酸轉氨酶編碼基因以阻止其降解以及過表達轉氨酶透過酶編碼基因以增強其輸出[46]。
5.2 5-氨基乙酰丙酸及其生物合成
5-氨基乙酰丙酸亦屬于天然非蛋白質氨基酸,是亞鐵血紅素、葉綠素、微生素B12合成的重要前體。5-氨基乙酰丙酸被廣泛應用于癌癥的光動力學診斷和治療,還可用作殺蟲劑和植物生長調節劑[8,47]。
5-氨基乙酰丙酸的生物合成包括C4途徑和C5途徑。其中C5途徑以α-酮戊二酸為前體物質依次在谷氨酸脫氫酶(glutamte dehydrogenase,GDH)、谷氨酰-轉移核糖核酸合成酶(glutamyl-transfer ribonucleic acid synthetase,GluRS)、谷氨酰-轉移核糖核酸還原酶(glutamyl-tRNA reductase,GluRR)以及谷氨酸-1-半醛氨基轉移酶(glutamate-1-semialdehyde aminotransferase,GluSA)催化作用下生成5-氨基乙酰丙酸。目前已報道的利用C5途徑合成5-氨基乙酰丙酸的菌株主要包括大腸桿菌和谷氨酸棒桿菌。其生產菌株的代謝工程改造策略包括過表達檸檬酸合酶編碼基因以增強檸檬酸供應[48]、弱化α-酮戊二酸脫氫酶編碼基因以減少α-酮戊二酸消耗[48]、過表達谷氨酰-tRNA還原酶和谷氨酸-1-半醛氨基轉移酶編碼基因以強化5-氨基乙酰丙酸的合成[49-51]、弱化5-氨基乙酰丙酸脫水酶編碼基因以減少5-氨基乙酰丙酸降解[52]、過表達輸出蛋白編碼基因以增強其輸出[50]、敲除乳酸脫氫酶和乙酸激酶編碼基因以減少副產物乳酸和乙酸的積累等[53]。
5.3 4-羥基異亮氨酸及其生物合成
羥基氨基酸是重要的氨基酸衍生物,可由α-酮戊二酸和Fe2+依賴的氨基酸羥化酶催化氨基酸和α-酮戊二酸生成。4-羥基異亮氨酸是常見的羥基氨基酸,由異亮氨酸和α-酮戊二酸經異亮氨酸羥化酶催化生成[54]。4-羥基異亮氨酸具有血糖濃度依賴的促進胰島素分泌的活性以及增加葡萄糖耐受性、促進脂肪代謝和保護肝臟等功能[55]。
目前已報道的生物法合成4-羥基異亮氨酸的菌株主要包括大腸桿菌和谷氨酸棒桿菌。其生產菌株的代謝工程改造策略包括過表達異亮氨酸羥化酶以構建4-羥基異亮氨酸合成途徑[56]、過表達磷酸烯醇式丙酮酸羧化酶或丙酮酸羧化酶編碼基因以增強草酰乙酸供應[54]、過表達檸檬酸合酶和異檸檬酸脫氫酶編碼基因以增強α-酮戊二酸供應[57]、敲除異檸檬酸裂解酶編碼基因以減少異檸檬酸的消耗[57]、敲除(或弱化)α-酮戊二酸脫氫酶編碼基因以減少α-酮戊二酸消耗[58]、過表達NAD激酶和6-磷酸葡萄糖脫氫酶編碼基因為異亮氨酸合成提供NADPH[9]等。
6 展望
近年來,隨著生物技術尤其是生物信息學、合成生物學及酶工程技術的不斷進步,α-酮戊二酸及其衍生物的生物合成水平逐漸提高,工業化進程也在加快,其應用范圍和領域逐漸擴大。如前所述,α-酮戊二酸脫氫酶和谷氨酸脫氫酶競爭α-酮戊二酸,其產物琥珀酰-輔酶A(coenzyme A,CoA)和谷氨酸參與多種生物反應,因此動態調節其活性以平衡其合成代謝將是實現α-酮戊二酸高效合成的關鍵。隨著成簇的規律間隔的短回文重復序列干擾(clustered regularly interspaced short palindromic repeats interference,CRISPRi)技術的應用以及生物感應器(biosensor)的開發和應用,將為解決該關鍵問題提供重要支撐。

