大曲中氯氟氰菊酯降解菌的分離篩選及特性研究
王若瑜,曹 明,陳晶瑜*
(中國農業大學 食品科學與營養工程學院 食品質量與安全北京實驗室,北京 100083)
據聯合國糧食及農業組織統計,世界糧食生產因病蟲鼠草害常年損失高達35%,農藥作為重要的農業生產資料,在減少作物損失、保障糧食安全上貢獻巨大[1]。然而,過量使用農藥造成嚴重的農藥殘留,不僅會影響地表植被及土壤微觀成分,還會通過地下及地表徑流流入海洋,影響水生生物圈的安全,通過蒸發影響大氣成分,甚至通過食物鏈影響人類健康[2]。高效氯氟氰菊酯(cyhalothrin)是一種高效、廣譜、速效擬除蟲菊酯類殺蟲劑、殺螨劑,以觸殺和胃毒作用為主,無內吸作用[3]。主要抑制昆蟲神經軸突部位的傳導,對昆蟲具有趨避、擊倒及毒殺的作用,殺蟲譜廣,藥效迅速,對刺吸式口器的害蟲及害螨有一定防效,持效期長,是一種典型的農藥殺蟲劑[4]。隨著有機氯、有機磷等高毒農藥禁用,高效氯氟氰菊酯由于擁有較高的生物活性和光譜型,被廣泛應用于農業生產、害蟲控制和公共衛生方面,因此,安全性問題也隨之而來[5-6]。
降解環境中殘留的農藥,一方面要開發高效、低毒、低殘留的化學農藥或生物農藥,另一方面則是要找到能夠高效、快速降解農藥殘留的制劑[7]。微生物降解農藥相較于其他方式,成本低、見效快、安全性高,被認為是最有效的降解方式[8]。目前已分離有許多可降解農藥的微生物,這些微生物大多數來源于土壤,主要包括細菌、真菌、放線菌和藻類,細菌由于適應能力強在降解農藥的微生物中占有重要地位,主要種屬有假單胞菌屬(Pseudomonas)、芽孢桿菌屬(Bacillus)、黃單孢桿菌屬(Xanthomonas)、硫桿菌屬(Thiobacillus)、固瘤細菌屬(Azotomonus)等。由于這些菌株都來自農藥污染嚴重的土壤以及水體污泥中,篩選得到的菌株安全性受到質疑,應用也受到限制[9-11]。因此,尋求安全可靠的菌株來源成為降解農藥殘留的關鍵[12]。
大曲作為我國傳統白酒和醋的糖化發酵劑,微生物種類繁多,安全性高,能為白酒提供風味物質[13-14]。HAN Y T等[15-16]研究發現,在白酒發酵過程中,敵敵畏、殺螟硫磷、馬拉硫磷、溴氰菊酯等農藥質量濃度顯著下降,說明白酒發酵過程中的一些微生物對低質量濃度農殘有顯著的降解作用。因此,以傳統食品發酵劑大曲中的微生物作為菌株來源,針對農作物中常見農藥殘留的降解情況進行探究,既可以保證低質量濃度農藥殘留的高效降解,又可以確保菌株來源的安全可靠。
本研究以傳統食品發酵劑大曲中的微生物資源為研究對象,篩選具有強降解氯氟氰菊酯能力的菌株,并探究氯氟氰菊酯質量濃度變化與菌株生長情況的關聯性,最后,采用模擬混合農殘體系驗證其農殘降解能力。
1 材料與方法
1.1 材料與試劑
1.1.1 材料
汾酒大曲:山西杏花村汾酒廠股份有限公司。
1.1.2 培養基
基礎鹽培養基(minimal salt medium,MSM)[17]:NH4NO31.5 g/L,KH2PO40.5 g/L,K2HPO41.5 g/L,MgSO4·7H2O 0.2 g/L,NaCl 1.0 g/L,121 ℃高壓滅菌15 min。固體培養基中添加20 g/L瓊脂。
LB培養基:北京奧博星生物技術有限公司。
1.1.3 化學試劑
瓊脂(生化試劑):北京奧博星生物技術有限公司;細菌基因組脫氧核糖核酸(deoxyribonucleic acid,DNA)提取試劑盒:天根生化科技(北京)有限公司;ExTaq酶(5 U/μL):日本TAKARA公司;三唑酮、氰戊菊酯、氯氟氰菊酯、溴氰菊酯、吡蟲啉、硫丹、甲霜靈農藥標準品(純度>98%):北京百靈威科技有限公司;乙腈(色譜純)、氯化鈉、無水乙醇、硝酸銨、磷酸二氫鉀、磷酸氫二鉀、七水合硫酸鎂、葡萄糖、無水硫酸鎂(均為分析純):北京北化精細化學有限責任公司。
1.2 儀器與設備
3K15冷凍離心機:德國Sigma公司;2800UV紫外分光光度計:尤尼科(上海)儀器有限公司;AG223B1聚合酶鏈式反應(polymerase chain reaction,PCR)儀:德國EPPENDORF公司;GC-MS-QP 2010 Plus氣相色譜-質譜聯用(gas chromatography-massspectrometer,GC-MS)儀:日本島津公司;毛細管柱HP-5(30 m×0.25 mm×0.25 μm):美國安捷倫公司。
1.3 實驗方法
1.3.1 氯氟氰菊酯降解菌的富集、分離與篩選
稱取10 g大曲樣品于90 mL無菌生理鹽水中,置于漩渦混勻器上振蕩40 min,充分混勻后制成菌懸液。吸取1 mL菌懸液于含有10 mg/L氯氟氰菊酯的MSM中,30 ℃、150 r/min條件下培養7 d。取1 mL菌液轉接至含有50 mg/L氯氟氰菊酯的MSM中,相同條件下繼續培養7 d后轉接,逐步提高氯氟氰菊酯的質量濃度至400 mg/L。將得到的菌液在超凈工作臺內以10倍稀釋法進行梯度稀釋。選取原液及稀釋度為10-1、10-2、10-3的菌懸液分別涂布于含有100 mg/L氯氟氰菊酯的固體MSM上,37 ℃條件下培養2~3 d。挑取生長較快、生長狀況較好的不同形態的菌落,在含有100 mg/L氯氟氰菊酯的固體MSM上轉接3代,驗證菌株的氯氟氰菊酯耐受性,以篩選耐受性較好的菌株。
1.3.2 氯氟氰菊酯降解菌生長曲線的測定
挑取單菌落于LB液體培養基,于37 ℃、180 r/min條件下培養至OD600nm值為1.0±0.1,使菌株處于對數生長期,得到種子液。按5%(V/V)的接種量將種子液接種于LB液體培養基中,于37 ℃、180 r/min條件下培養20 h,每2 h測定菌株OD600nm值,以篩選生長狀況較好的菌株。
1.3.3 氯氟氰菊酯降解菌的分子生物學鑒定
采用細菌基因組DNA提取試劑盒提取氯氟氰菊酯降解菌的基因組DNA,以其為模板,采用細菌16S rRNA基因擴增通用引物Be-for(5'-AGAGTTTGATCCTGGCTCAG-3')和Be-rev(5'-AAGGAGGTGATCCAGCCGCA-3')進行PCR擴增[18]。PCR擴增體系:上下游引物分別1 μL、菌液2 μL、脫氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)4 μL、ExTaq酶0.25 μL、10×ExTaqBuffer 5 μL,用雙蒸水(ddH2O)補齊至50 μL。PCR擴增條件:94 ℃預變性5 min;94 ℃變性30 s,54 ℃退火30 s,72 ℃延伸1 min,共循環35次;72 ℃再延伸7 min。PCR擴增產物用1%瓊脂糖凝膠電泳檢測并由華大基因(北京)有限公司進行純化并測序。將測序結果提交至美國國立生物技術信息中心的GenBank數據庫中進行Blast比對搜索,選取同源性較高的模式菌株的16S rRNA序列,采用MEGA中的鄰接法構建系統發育樹,確定菌株的種屬。
1.3.4 菌株的培養
將處于對數生長期的種子液在5000×g條件下離心5min,棄上清,采用MSM洗滌菌體沉淀后混勻,重復洗滌2次后加入MSM,振蕩重懸以制備菌懸液。添加5%菌懸液與1%葡萄糖至含有不同質量濃度農藥的MSM中,降解率對照組中不加入菌懸液,生長對照組中不加入農藥,與處理組同時在37 ℃、180 r/min條件下培養7 d。每組作3個平行。
1.3.5 氯氟氰菊酯降解率的測定
田間噴灑氯氟氰菊酯的質量濃度一般為4~10 mg/L[7],考慮到氯氟氰菊酯的自然降解等情況,考察菌株在含2mg/L、5 mg/L、10 mg/L氯氟氰菊酯的MSM中培養7 d后氯氟氰菊酯的降解率,確定最優菌株。
1.3.6 混合農藥對菌株生長及農藥降解率的影響
典型的農藥代表有三唑酮、氰戊菊酯、氯氟氰菊酯、溴氰菊酯、吡蟲啉、甲霜靈、硫丹,采用以上7種農藥模擬混合農殘體系進行研究。在MSM中添加質量濃度均為5 mg/L的三唑酮、氰戊菊酯、氯氟氰菊酯、溴氰菊酯、吡蟲啉、甲霜靈、硫丹[19],按照方法1.3.4培養菌株,考察混合農藥對菌株生長及農藥降解率的影響。
1.3.7 農藥含量的測定方法
吸取2 mL菌液于12 000×g條件下離心5 min,收集上清液1.5 mL,加入等體積乙腈,劇烈振蕩1 min,加入1.5 g氯化鈉振蕩1 min,3 800 r/min離心5 min,取1 mL上清液于裝有150 mg無水硫酸鎂的2 mL離心管中,振蕩1 min,10 000 r/min離心1 min,取上清液,經0.22 μm有機系濾膜過濾后,采用GC-MS法[20]測定農藥的含量。
GC條件:HP-5毛細管柱(30 m×0.25 mm×0.25 μm);載氣為氦氣(He),柱流速1.0 mL/min;進樣口溫度280 ℃,不分流進樣模式,進樣量1 μL;色譜柱升溫程序為初始溫度100 ℃,以20 ℃/min升至220 ℃,再以10 ℃/min升至300 ℃,保持8 min。
MS條件:載氣為氦氣(He);碰撞器為氬氣(Ar);傳輸線溫度為290 ℃;離子源為電子電離(electron ionization,EI)源;離子源溫度為250 ℃;電子能量為70 eV;溶劑延遲時間為2.5 min;多選擇離子存儲(selective ion storage,SIS)檢測。
定性定量:采用保留時間定性,外標法定量。
1.3.8 農藥降解率的計算
通過GC-MS法得到各農藥含量后計算其降解率,計算公式如下:
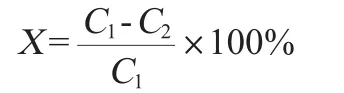
式中:X為農藥降解率,%;C1為培養7 d后對照組中農藥殘留質量濃度,mg/L;C2為培養7 d后處理組中農藥殘留質量濃度,mg/L。
2 結果與分析
2.1 氯氟氰菊酯降解菌的篩選結果
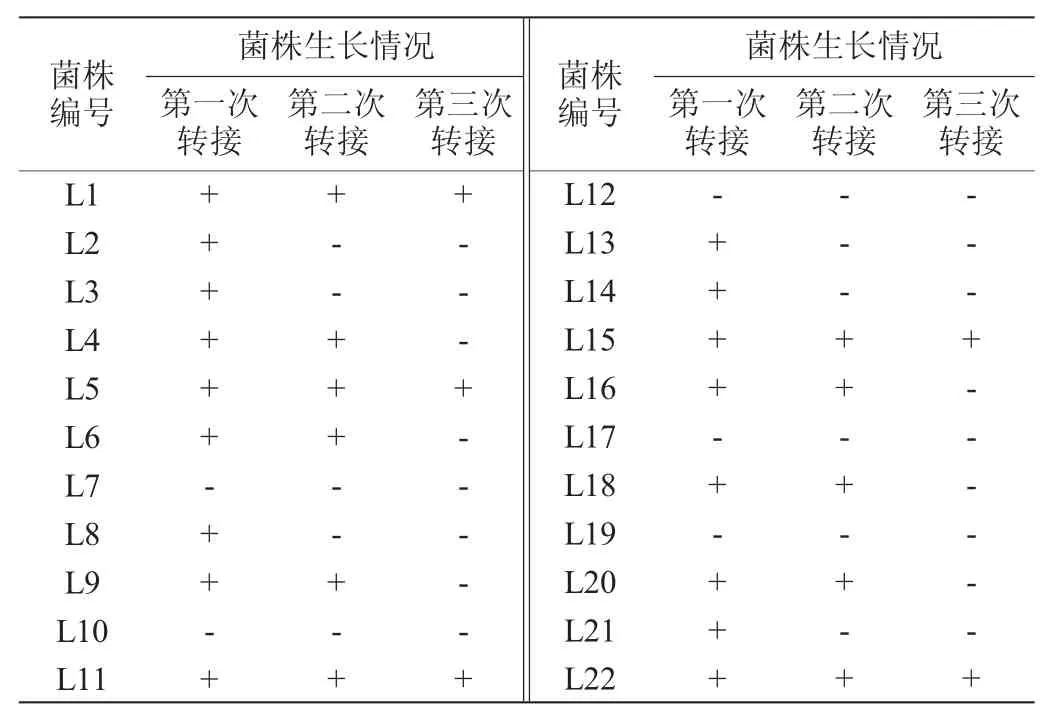
表1 篩選菌株的氯氟氰菊酯耐受性Table 1 Cyhalothrin tolerance of screened strains
農藥降解菌的酶系可利用農藥生長繁殖,將其代謝,達到農藥降解的目的。因此,在以農藥為碳氮源的培養基中生長繁殖能力越強的菌株,對于農藥的代謝能力越強,農藥降解速度越快。無氮源、碳源等生長因子的環境條件對菌株生長是不利的,因此,農藥降解菌篩選過程中需嚴格控制除農藥外的碳源[21]。通過富集培養,在含有100 mg/L氯氟氰菊酯的固體MSM上初步篩選出22個生長較快、生長狀況較好的不同形態的菌落,編號為L1~L22。經含有100 mg/L氯氟氰菊酯的固體MSM轉接3代后,驗證各篩選菌株的氯氟氰菊酯耐受性,結果見表1。
由表1可知,菌株L1、L5、L11、L15、L22可耐受氯氟氰菊酯并繼續生長,進一步對這5株菌的生長能力進行測定,結果見圖1。
由圖1可知,菌株L1、L5的生長比較旺盛,在LB培養基中很快突破延滯期,進入對數生長期,且生長情況顯著優于菌株L11、L15、L22,故選取菌株L1、L5作為目標菌株。
2.2 氯氟氰菊酯降解菌的鑒定結果
菌株L1、L5的分子生物學鑒定系統發育樹見圖2~圖3。
由圖2~圖3可知,菌株L1和L5分別與駒形白色桿菌(Leucobacter komagatae)和玫瑰紅紅球菌(Rhodococcus rhodochrous)聚于一支,親緣關系最近。因此,確定菌株L1為駒形白色桿菌(Leucobacter komagatae),菌株L5為玫瑰紅紅球菌(Rhodococcus rhodochrous)。
2.3 氯氟氰菊酯降解率的測定
菌株L1和L5在含2 mg/L、5 mg/L、10 mg/L氯氟氰菊酯的MSM中培養7 d后氯氟氰菊酯的降解率見圖4。
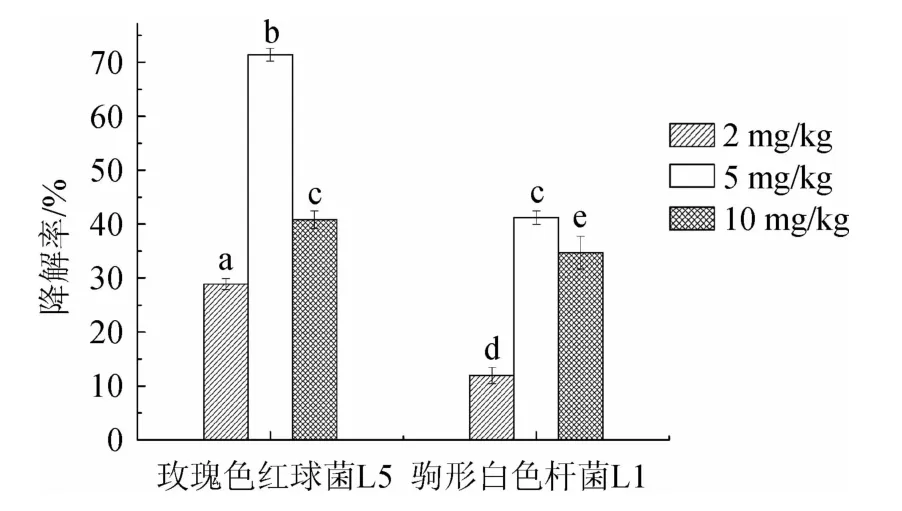
圖4 菌株L1和L5對氯氟氰菊酯的降解率Fig.4 Degradation rates of cyhalothrin by strain L1 and L5
由圖4可知,菌株L1和L5均對質量濃度為2mg/L、5mg/L、10 mg/L的氯氟氰菊酯具有一定的降解能力。兩株菌降解氯氟氰菊酯總體規律相同,當氯氟氰菊酯質量濃度為5 mg/L時,降解率均最高,菌株L5降解率達到71.44%,說明質量濃度為5 mg/L趨近于菌株最適生長質量濃度。同時研究發現,菌株L5的降解效果更佳,玫瑰色紅球菌具有代謝多樣性的特點,能有效去除多種化合物,比如石油污染修復、降解有機農藥等[22]。此外,紅球菌屬還能作為某些水產養殖動物的益生菌,可提供水產養殖動物必須的類胡蘿卜素[23],是一株具有應用前景的安全菌株。因此,后續對菌株L5的氯氟氰菊酯降解特性進行進一步分析。
2.4 菌株L5的生長與氯氟氰菊酯降解動態的相關性
為進一步探究發酵過程中菌株L5對氯氟氰菊酯的降解動態、菌株L5的生長動態及二者之間的相關性,在質量濃度為5 mg/L氯氟氰菊酯培養體系下測定了菌株L5的生長和氯氟氰菊酯降解情況,結果見圖5。
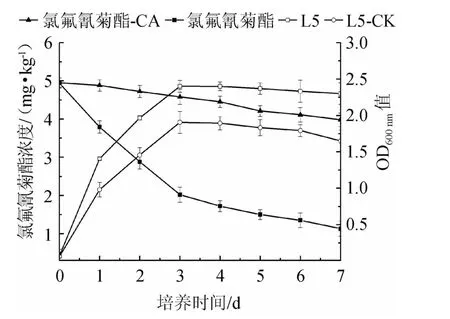
圖5 菌株L5的生長曲線和氯氟氰菊酯降解動態曲線Fig.5 Growth curve of strain L5 and degradation dynamic curve of cyhalonthrin
由圖5可知,發酵0~7 d,在未接種菌株L5的對照組中,氯氟氰菊酯質量濃度從4.95 mg/L下降至3.98 mg/L,而接種菌株L5組中,氯氟氰菊酯質量濃度從4.94 mg/L下降至1.13 mg/L,且在0~3 d內變化量最多,說明菌株L5對氯氟氰菊酯降解能力較強。在MSM中加入質量濃度為5 mg/L的氯氟氰菊酯,菌株L5的OD600nm值高于未添加氯氟氰菊酯MSM,說明氯氟氰菊酯的添加對菌株L5的生長有促進作用。說明氯氟氰菊酯的濃度變化與菌株生長密度有關。
2.5 混合農藥對菌株L5生長及農藥降解率的影響
為了確定菌株L5在實際生產時的實用性,對菌株L5在混合農藥中的生長情況與農藥降解率進行探究,結果見圖6。
由圖6可知,與無農藥添加MSM中菌株L5的生長情況相比,菌株L5在含有混合農藥MSM中的生長有明顯的促進作用,同時,7種農藥均被降解,可能由于菌株L5對混合農藥具有很高的耐受性,可以利用混合農藥作為碳源生長或在有葡萄糖作為初級能源的條件下,對農藥進行共代謝,既促進了菌株L5的生長,同時又加快了自然條件下混合農藥的降解速度,提高了混合農藥的降解率。在含有混合農藥MSM中,菌株L5對菊酯類農藥氯氟氰菊酯、氰戊菊酯與溴氰菊酯的降解率分別達到52.8%、44.6%、37.5%,占絕對優勢,同時,對吡蟲啉、硫丹、甲霜靈等其他類型殺蟲劑類農藥的降解率也較高,具有較寬的降解譜。
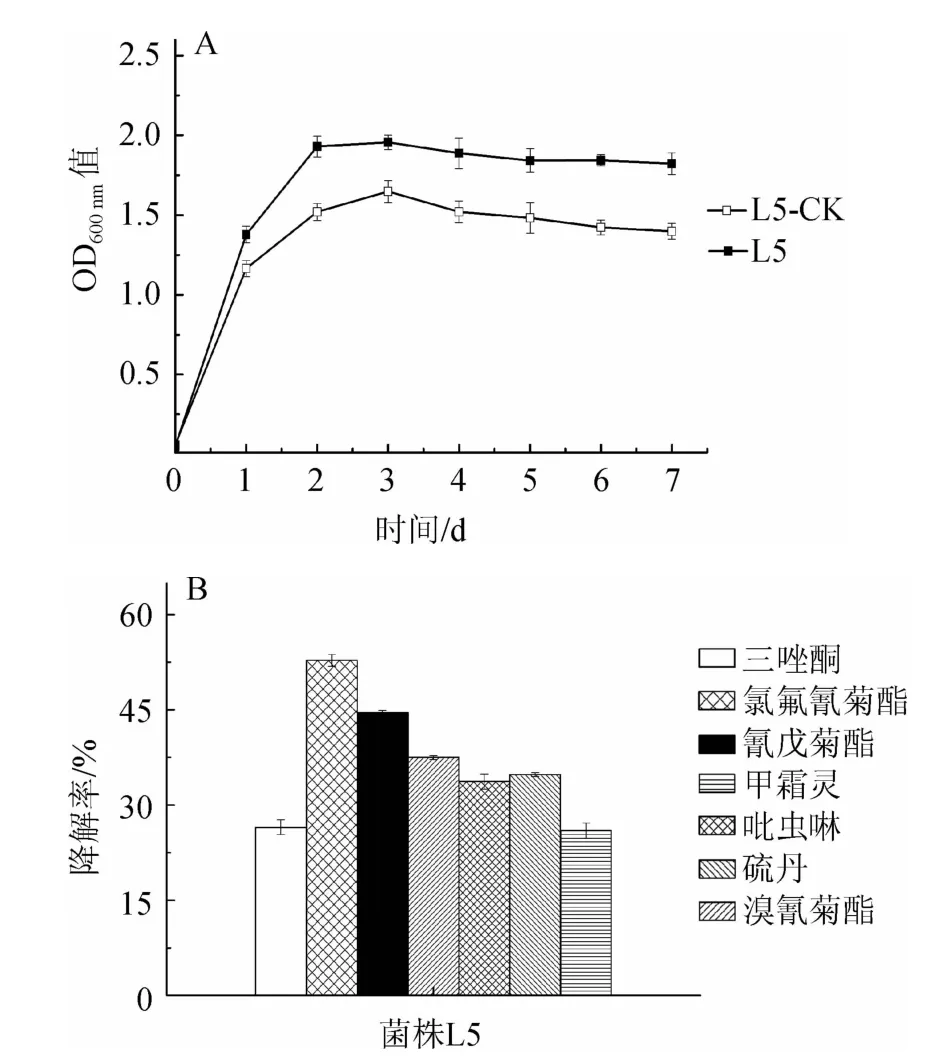
圖6 菌株L5在含混合農藥基礎鹽培養基中的生長情況(A)及農藥降解率(B)Fig.6 Strain L5 growth (A) and pesticide degradation rate (B) in minimal salt medium with mixed pesticides
3 結論
本研究從大曲中分離得到5株能夠高效降解氯氟氰菊酯的菌株,其中菌株L1和L5生長旺盛且氯氟氰菊酯降解率高,通過分子生物學技術分別鑒定為駒形白色桿菌(Leucobacter komagatae)與玫瑰紅紅球菌(Rhodococcus rhodochrous)。兩株菌對5 mg/L氯氟氰菊酯的降解效果最好,且玫瑰紅紅球菌L5降解率最高,達到71.44%。氯氟氰菊酯的添加能促進玫瑰紅紅球菌L5的生長,且玫瑰紅紅球菌L5的生長能促進氯氟氰菊酯的降解,氯氟氰菊酯的濃度變化與菌株生長密度有關。在混合農殘體系中,玫瑰紅紅球菌L5有較強降解能力,其中對氯氟氰菊酯的降解率最高,降解率達到52.8%。對其他農藥氰戊菊酯、溴氰菊酯、吡蟲啉、硫丹、甲霜靈等其他類型殺蟲劑類農藥的降解率較高,達20%以上,具有較寬的降解譜。綜上,玫瑰紅紅球菌L5是一株性能優異、生長旺盛、降解譜較寬的功能菌株,對高效氯氟氰菊酯單一或混合農殘體系具有潛在的應用前景。

