釀酒酵母工程菌產青蒿酸的發酵動力學研究
陳 偉,于文文,2,陳亞軍,徐 彬,滕 云
(1.浙江海正藥業股份有限公司 浙江省抗真菌藥物重點實驗室,浙江 臺州 318000;2.浙江工業大學 藥學院,浙江 杭州 310000)
青蒿素是現今針對瘧疾相關疾病最為有效的藥物[1-2],青蒿素及其相關的系列衍生物在抗炎、預防及提高人類自身免疫等方面也具有一定的積極效果[3],因此在生物醫藥領域的應用前景較為廣闊[4]。青蒿素可以通過三種不同的方法進行制備與獲得,分別是從種植的黃花蒿中提取[5-6]、全化學合成[7-8]以及利用基因工程手段構建可產青蒿酸的微生物,通過發酵獲得青蒿酸,然后再經過化學合成獲得[9]。
PADDON C J等[10-14]首創了青蒿酸的微生物發酵技術,通過基因改造技術得到直接產青蒿酸的釀酒酵母(Saccharomyces cerevisiae)工程菌,并通過系列優化,不斷提高青蒿酸發酵產量。王冬等[15]研究發現,青蒿酸的發酵制備存在成本偏高的問題。目前,國內的研究主要集中在通過對菌種的基因工程改造,實現青蒿酸前體-紫橞槐二烯的微生物合成,但尚未實現青蒿酸的體內合成[16-17]。于文文等[18]在搖瓶發酵的基礎上,通過響應面優化確定了S.cerevisiae工程菌1211產青蒿酸較為適宜的發酵工藝并提高了青蒿酸的產量。本研究首先在50 L發酵罐中對S.cerevisiae工程菌1211發酵產青蒿酸的溶氧參數進行優化。在確定最佳溶氧水平的基礎上,對S.cerevisiae工程菌1211分批發酵過程中菌體生長、青蒿酸合成以及基質消耗隨發酵時間的變化規律進行分析,明確發酵過程中基質濃度變化對釀酒酵母工程菌1211代謝以及青蒿酸發酵產量的影響。在此基礎上,利用Logistic方程和Luedeking-Piret方程,研究S.cerevisiae工程菌1211發酵過程變化規律,建立S.cerevisiae工程菌1211產青蒿酸分批發酵動力學模型,為發酵過程的預測和控制提供理論基礎。
1 材料與方法
1.1 材料與試劑
1.1.1 菌種
釀酒酵母(S.cerevisiae)工程菌1211:保存于本實驗室。
1.1.2 試劑
葡萄糖(分析純):山東西王糖業有限公司;蔗糖、琥珀酸、KH2PO4、MgSO4·7H2O、(NH4)2SO4、CuSO4·5H2O、生物素、泛酸鈣、煙酸、肌醇、維生素B1、吡哆醛、對氨基苯甲酸、ZnSO4·7H2O、MnCl2·4H2O、CoCl2·6H2O、NaMoO4·2H2O、CaCl2·2H2O、FeSO4·7H2O、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)等(均為分析純):國藥集團化學試劑有限公司。
1.1.3 培養基
種子培養基[18]:葡萄糖19.5 g/L,KH2PO48 g/L,(NH4)2SO415 g/L,MgSO4·7H2O 6.2 g/L,維生素溶液12 mL/L,金屬離子溶液10 mL/L,CuSO4·5H2O 40 μg/L,琥珀酸緩沖液(0.5 mol/L,pH 5.0)100 mL/L。
固體培養基:在種子培養基的基礎上加20 g/L瓊脂。
發酵培養基[18]:蔗糖91.8 g/L,KH2PO48.7 g/L,(NH4)2SO410.3 g/L,MgSO4·7H2O 6.2 g/L,維生素溶液12 mL/L,金屬離子溶液10 mL/L,CuSO4·5H2O 24 mg/L。
以上培養基在121 ℃條件下滅菌25 min。
1.2 儀器與設備
15 L發酵罐和50 L發酵罐:上海國強生化工程裝備有限公司;JH3102稱量天平:上海精密科學儀器有限公司;ZWYR-C2112C型雙層真彩觸摸屏搖床:上海智城分析儀器制造有限公司;1290型高效液相色譜(high performance liquid chromatography,HPLC)儀:美國Agilent公司;FE20實驗室pH計:梅特勒托利多儀器(上海)有限公司;M-100型生物傳感器分析儀:深圳西爾曼科技有限公司;SL 40型臺式離心機:美國Thermo公司。
1.3 實驗方法
1.3.1 發酵罐培養方法
菌株的活化、搖瓶一級種子培養制備:參照文獻[18]。
15 L種子罐中S.cerevisiae工程菌1211種子的擴大培養:裝液量8 L/15 L,發酵溫度30 ℃,菌種接種量10%(V/V),通氣比1.0 vvm,起始攪拌轉速200 r/min,發酵溶氧(dissolved oxygen,DO)≥35%,溶氧<35%時,系統自動提高攪拌轉速,最高攪拌轉速≤800r/min,以維持溶氧>35%,培養周期24h。
50 L發酵罐中S.cerevisiae工程菌1211的發酵培養:裝液量20 L/50 L,培養溫度30 ℃,菌種接種量10%(V/V),起始攪拌轉速200 r/min,攪拌轉速的設定范圍為200~450 r/min,發酵過程中通過流加28%氨水使培養基的pH值維持在5.5,通氣比1.6 vvm,發酵周期96 h。
1.3.2 溶氧對釀酒酵母工程菌1211發酵產青蒿酸的影響
S.cerevisiae工程菌1211發酵制備青蒿酸過程中,溶氧是最為關鍵的參數。菌體在生長代謝過程中,菌體的生長代謝和目標產物的積累很大程度上受限于菌體所在發酵罐內溶氧水平的高低。采用溶氧與轉速聯動,固定空氣進氣量,考察不同溶氧水平(10%~15%、15%~20%、20%~25%、25%~30%、30%~35%、35%~40%)對S.cerevisiae工程菌1211的生長和青蒿酸產量的影響。
1.3.3 生物量測定
OD600nm值:采用紫外分光光度計在波長600 nm處測定發酵液的吸光度值。
細胞干質量:取發酵液10mL于15mL離心管中,3000r/min離心15 min,棄去上清液,使用去離子水重復洗滌3次,最終獲得的濕菌體放入80 ℃的烘箱內烘干至恒質量,稱質量。
1.3.4 殘糖量的測定
發酵液經3 000 r/min離心15 min,取上清液,采用高效液相色譜-蒸發光散射檢測法(evaporative light scattering detection,ELSD)測定殘糖(蔗糖)含量[19]。
1.3.5 青蒿酸產量的測定
樣品前處理:取1 mL待測發酵液樣品和9 mL甲酸甲醇溶液(甲醇溶液中加入0.5%(V/V)純度為98%的甲酸)置于10 mL試管,充分混合均勻后,在超聲溫度45~50 ℃、功率200 W的條件下超聲破碎30 min,取混合液1 mL,12 000 r/min高速離心5 min,取上清液經0.2 μm膜過濾獲得待測樣品。
青蒿酸含量:采用高效液相色譜法進行測定[18]。
1.3.6 動力學模型的建立
(1)S.cerevisiae工程菌1211生長動力學模型的建立
因S.cerevisiae工程菌1211的生長曲線為較標準的S型生長曲線,故選擇Logistic方程(式(1))[20-21]擬合菌體的生長規律。

式中:dX/dt為S.cerevisiae工程菌1211生長繁殖的速度,g/(L·h);μm為S.cerevisiae工程菌1211菌體的最大比生長速率,h-1;X為S.cerevisiae工程菌1211的生物量,g/L;Xm為S.cerevisiae工程菌1211的最大生物量,g/L;t為相應的發酵時間,h。下同。
將Logistic方程通過積分處理,獲得相應的代數方程,見式(2)。

式中:X0為S.cerevisiae工程菌1211的初始菌體生物量,g/L。
(2)青蒿酸合成動力學模型的建立
采用Luedeking-Piret方程[22]對菌體的生長繁殖與目標產物的積累之間的相關關系進行描述,其方程式見式(3)。

式中:dP/dt為青蒿酸發酵積累的速度,g/(L·h);P為青蒿酸發酵產量,g/L;α為生長偶聯系數;β為非生偶聯系數。
其中,α≠0、β=0表示為生長相關型;α≠0、β≠0表示為生長部分相關型;α=0、β≠0表示為非生長相關型。結合公式(2)和公式(3),對Luedeking-Piret方程進行積分處理,得到相應的代數方程,見式(4)。

式中:P0為青蒿酸初始產量,g/L。由于青蒿酸初始含量為0,因此P0可忽略不計。
(3)基質消耗動力學模型的建立[23-24]
碳源基質的消耗可以由類似Luedeking-Piret的式(5)來表示。
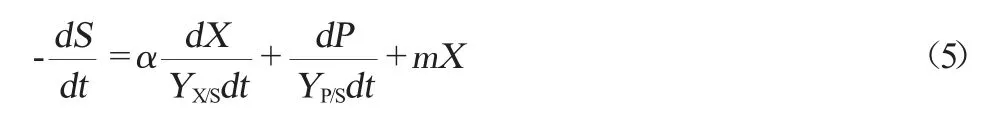
式中:dS/dt為基質(碳源)消耗的速度,g/(L·h);S為發酵培養基中碳源的質量濃度,g/L;YX/S為發酵碳源用于S.cerevisiae工程菌1211菌體生長的得率常數;YP/S為發酵碳源用于目標產物青蒿酸積累得率常數;m為S.cerevisiae工程菌1211菌體維持系數。
將式(1)、式(3)和式(5)進行積分換算得式(6)。
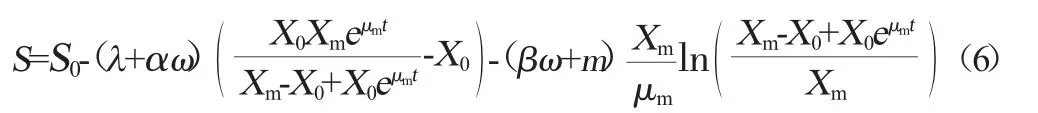
式中:S0為初始碳源質量濃度,g/L;λ=1/YX/S;ω=1/YP/S。
1.3.7 動力學模型的驗證
為了檢驗所獲得的發酵模型是否準確可靠,在發酵培養條件相同的前提下,進行3個批次的平行發酵實驗,將發酵培養獲得的實際實驗值與通過建模得到的模型預測值進行對比。
2 結果與分析
2.1 溶氧對釀酒酵母工程菌1211發酵產青蒿酸的影響
不同溶氧水平對S.cerevisiae工程菌1211的生長和青蒿酸產量的影響見圖1。
由圖1a可知,在發酵前期,不同溶氧水平條件下,S.cerevisiae工程菌1211的OD600nm值差異不大;到發酵中期時,OD600nm值的差異逐漸變大;再到發酵后期,OD600nm值均趨于穩定或略有下降。溶氧越高,OD600nm值越高,S.cerevisiae工程菌1211的初級代謝越旺盛。由此可知,溶氧水平對S.cerevisiae工程菌1211的生長繁殖有著顯著的影響,足夠的溶氧可以明顯提高S.cerevisiae工程菌1211的生物量,大量的氧氣被用于菌株的繁殖生長代謝。
由圖1b可知,當溶氧處于10%~15%時,S.cerevisiae工程菌1211的青蒿酸產量較低,為(3 351.2±60.4)mg/L,分析原因可能是由于S.cerevisiae工程菌1211產青蒿酸需要通過甲羥戊酸途徑(mevalonate pathway,MVA),而該途徑需要消耗大量的能量,此時,發酵體系中沒有足夠的氧氣支持菌株進行呼吸作用,進而導致青蒿酸產量較低。當溶氧升高至25%~30%時,青蒿酸的發酵產量達到最高,為(6 269.6±100.3)mg/L。之后隨著溶氧水平的進一步提高,青蒿酸發酵產量出現下降。分析原因可能是由于高溶氧條件下,菌株的初級代謝非常旺盛,與產青蒿酸途徑在利用碳源等基質的情況下形成了競爭關系。當溶氧為35%~40%時,青蒿酸發酵產量下降至(4 154.4±124.6)mg/L。因此,選擇溶氧水平25%~30%為50 L發酵罐的最適溶氧條件。

圖1 不同溶氧對釀酒酵母工程菌1211生長(a)及青蒿酸產量(b)的影響Fig.1 Effect of dissolved oxygen on growth(a)and arteannuic acid yield(b)of engineered Saccharomyces cerevisiae 1211
2.2 釀酒酵母工程菌1211分批發酵產青蒿酸過程

圖2 50 L發酵罐中釀酒酵母工程菌1211分批發酵過程Fig.2 Batch fermentation process of engineered Saccharomyces cerevisiae 1211 cultivated in a 50 L fermenter
由圖2可知,S.cerevisiae工程菌1211生長的延滯期為0~12 h,菌體生長繁殖處于起始階段,發酵液中碳源消耗較少;對數生長期為12~48 h,菌體生長繁殖速度較快,發酵液中碳源消耗速度大幅上升。為了實現較高的菌體生物量,以提高青蒿酸發酵產量,選擇在對數中后期,即培養34 h時,加入乳糖水解液誘導S.cerevisiae工程菌1211產青蒿酸。平穩期為48~84 h,這一時期菌體的生物量以較緩慢的速率增加,青蒿酸則積累迅速。衰亡期84~96 h,在此階段,菌體大量衰亡,此時菌體的死亡速率超過菌體的生長繁殖速率,導致菌體活細胞數呈相應的下降趨勢,同時青蒿酸合成速率減慢。至發酵結束時,菌體生物量為44.12 g/L,殘糖量接近于0,青蒿酸發酵產量為6.21 g/L。由此可知,在整個發酵過程中,青蒿酸的合成與S.cerevisiae工程菌1211生長變化趨勢一致,說明S.cerevisiae工程菌1211的菌體生長繁殖規律與其目標產物青蒿酸積累之間呈現出生長相關型或生長部分相關型的關系。
2.3 釀酒酵母工程菌1211菌體發酵動力學模型
2.3.1 釀酒酵母工程菌1211菌體生長模型
將圖2中的實驗數據代入方程式(2),采用Origin 9.0進行菌體生長模型的非線性擬合,結果見圖3。

圖3 釀酒酵母工程菌1211干質量實驗值與模型擬合結果的比較Fig.3 Comparison of experimental values and model fitting values of cell dry weight of engineered Saccharomyces cerevisiae 1211
由圖3可知,菌體生長模型的相關系數R2=0.995 85,S.cerevisiae工程菌1211菌體生長動力學參數X0、Xm和μm值分別為0.85、45.81和0.12,獲得菌體生長動力學方程如下:

S.cerevisiae工程菌1211的生長繁殖數據得到的動力學模型與實驗值擬合較好。特別是在菌體的發酵前中期,發酵實驗值與已建立的動力學模型擬合曲線較為一致,但是到了發酵末期,由于發酵罐中的青蒿酸含量逐漸升高,對菌體的生長有一定的抑制,從而使得菌體生物量相對于擬合值有所偏差。
2.3.2 釀酒酵母工程菌1211青蒿酸合成動力學模型
根據圖2得到的實驗數據,將S.cerevisiae工程菌1211菌體相關的生長動力學參數X0、Xm和μm值分別代入方程式(4)中,采用Origin 9.0進行非線性擬合,結果見圖4。

圖4 青蒿酸發酵產量實驗值與模型擬合結果的比較Fig.4 Comparison of experimental values of artemisinic acid yield with calculated values by model
由圖4可知,青蒿酸合成動力學模型的相關系數R2=0.979 04,得到青蒿酸合成動力學參數α=0.074、β=0.001 1,由此可知,S.cerevisiae工程菌1211菌體在50 L發酵罐中培養時,菌體生長過程中青蒿酸的積累與菌體生長繁殖為部分生長偶聯型,從而獲得青蒿酸積累的動力學方程如下:
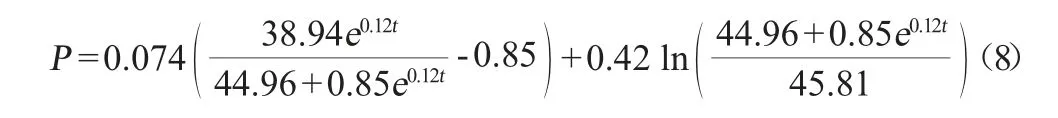
通過數據建模得到的青蒿酸合成動力學模型曲線與經過發酵培養獲得的實驗值之間的擬合情況較好。在發酵合成產物前期,青蒿酸合成擬合曲線與實驗值幾乎保持一致。但當發酵后期,菌體逐漸進入衰亡期,同時,菌體生長一定程度上也受到產物青蒿酸的抑制后,菌體產青蒿酸的能力也開始下降,發酵末期的青蒿酸發酵產量明顯低于模型預測值。
2.3.3 釀酒酵母工程菌1211基質消耗動力學模型
根據圖2的實驗數據,將所得的參數X0、Xm、μm、α、β值分別代入方程式(6)中,采用Origin 9.0進行非線性擬合,結果見圖5。
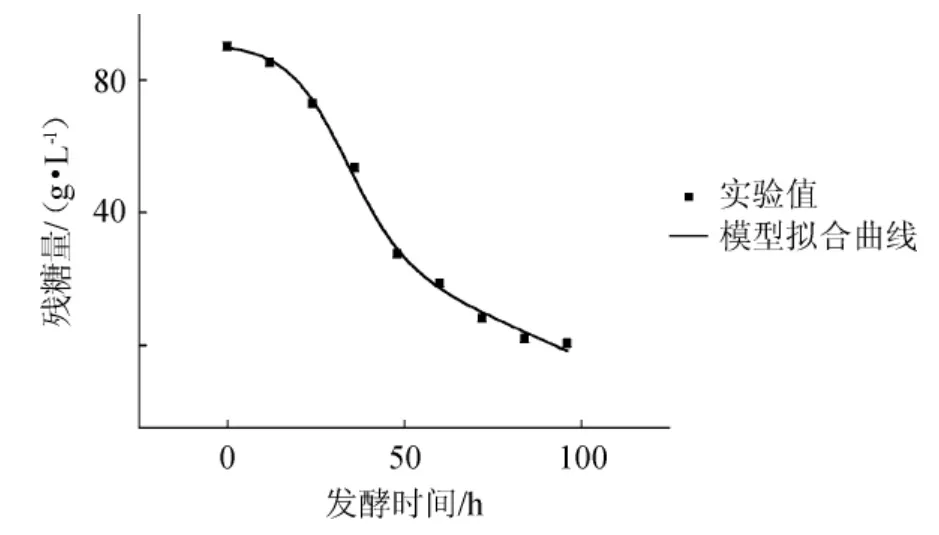
圖5 蔗糖含量實驗值與模型擬合結果的比較Fig.5 Comparison of experimental values and model fitting results of sucrose content
由圖5可知,基質消耗動力學模型的相關系數R2=0.995 48,得到基質消耗動力學模型參數S0=90.85、m=0.007、λ=1.21、ω=2.51,由此可知,S.cerevisiae工程菌1211菌體在50 L發酵罐中培養時,基質消耗動力學方程如下:
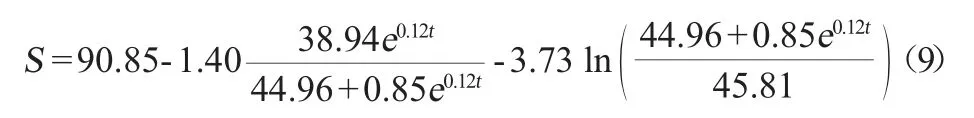
蔗糖在S.cerevisiae工程菌1211發酵過程中被消耗的動態變化可以很好的由基質消耗動力學模型曲線進行描述。基質的實際消耗與模型擬合稍有偏差僅發生在菌體的生長末期,蔗糖消耗速率未達到擬合曲線速率,可能與菌體生長代謝變慢、受到產物抑制以及產青蒿酸能力下降有關。
2.4 動力學模型的驗證
由表1可知,除了發酵末期實驗值與理論值差距較大,其他實驗點的平均值與模型預測值兩者之間的誤差大部分都是在±10%以下。因此,S.cerevisiae工程菌1211發酵產青蒿酸的過程能夠用以上發酵動力學模型來描述。
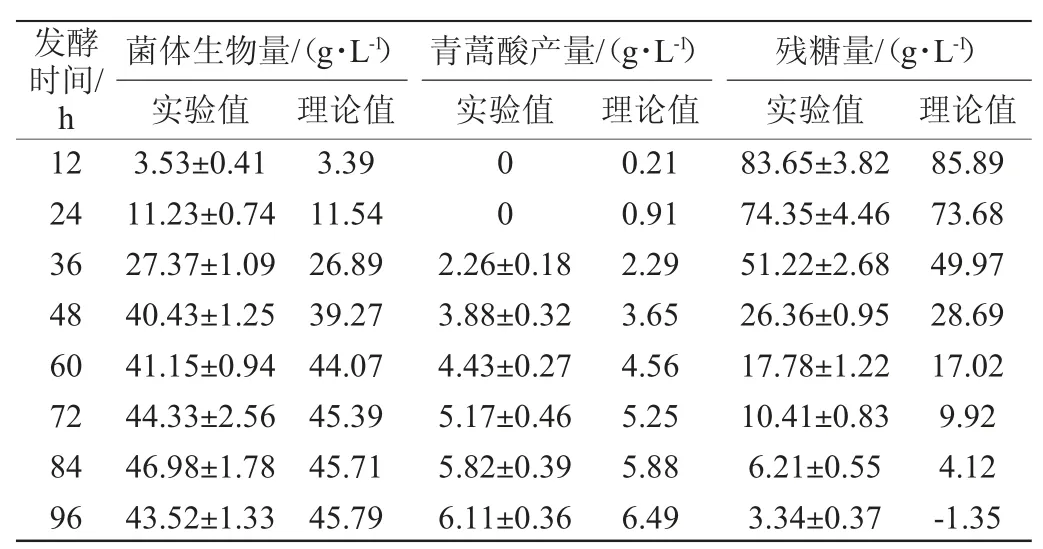
表1 模型理論值與試驗值的比較Table 1 Comparison of theoretical value calculated by modelsand experimentalvalue
3 結論
S.cerevisiae工程菌1211在50 L發酵罐中的最佳發酵溶氧參數為25%~30%,在此條件下青蒿酸發酵產量達到(6 269.6±100.3)mg/L,與搖瓶產量相比提升了309.9%[18]。根據Logistic方程和Luedeking-Piret方程,借助Origin 9.0軟件,發現S.cerevisiae工程菌1211青蒿酸的合成和菌體的生長呈現出部分生長偶聯關系,建立了S.cerevisiae工程菌1211分批發酵高產青蒿酸的動力學模型,S.cerevisiae工程菌1211的菌體繁殖生長、青蒿酸合成以及基質消耗模型擬合度R2分別達到0.995 85、0.979 04和0.995 48,較好的反映了S.cerevisiae工程菌1211發酵過程中菌體生物量、青蒿酸合成和基質消耗隨發酵時間的變化規律,該研究為S.cerevisiae工程菌1211產青蒿酸的發酵工藝后續改進、發酵過程的放大與控制提供了一定的理論基礎。

