鱘魚肝酶解條件優化及酶解液對雙歧桿菌增殖效果的研究
王靖麟,王世博,徐 睿,李平蘭,武瑞赟
(1.中國農業大學 食品科學與營養工程學院 北京食品營養與人類健康高精尖創新中心,北京 100083;2.北京市水產技術推廣站,北京 100176)
隨著生活水平的提高,人們對健康的關注度逐漸提高,益生菌受到了廣泛的關注,其中雙歧桿菌屬(Bifidobacterium)是一種厭氧的革蘭氏陽性桿菌屬[1],菌體不運動、細胞呈桿狀、一端有時呈分叉狀[2],是最早的定植于母乳喂養健康新生兒腸道中的益生菌,廣泛存在于人和動物的消化道、口腔等環境中,具有維護腸道菌群平衡、改善乳糖不耐癥、抑制病原菌、提高免疫、改善人體精神狀態等功效[3-6]。雙歧桿菌特殊的生長條件和高營養要求使得雙歧桿菌的生長較為緩慢,國內外大量的研究主要集中在尋找能夠促進雙歧桿菌生長繁殖的物質,即促生長因子。促生長因子(bifidus factor,BF)是指可以促進微生物生長繁殖的一大類天然及合成物質。常見的促生長因子有寡聚糖類、多糖類(如云芝多糖水提物)、短鏈脂肪酸類物質,天然植物及中草藥的提取物、蛋白及其水解產物(肽類)等[7-14]。其中已經證實的肽類促生長因子包括酪蛋白經胰蛋白酶作用產物;富含核蛋白的動物組織,如一些陸生和水生動物的胰臟、肝臟經植物蛋白酶處理后的產物,且上述肽類雙歧因子具有廣泛的促生長效應,對多種雙歧均有促生長作用[15-19]。目前肽類雙歧因子促生長機理尚不明確。
我國鱘魚養殖業日漸擴大[20],鱘魚加工量也在迅速增長。然而鱘魚體型較大,加工過程中產生大量的內臟、魚皮、魚骨等下腳料,占總質量的50%以上,直接丟棄容易造成資源浪費和環境的污染。其中鱘魚肝臟營養價值較高,富含維生素E、維生素A、維生素D和鐵等礦物質元素以及蛋白質。有學者以鱘魚肝為原料提取出了蛋白磷酸酶2A,這是酶抑制法檢測微囊藻毒素所使用的主要蛋白酶[21]。也有學者測定了鱘魚肝中脂溶性維生素A、D、E、K含量,發現鱘魚肝中維生素E含量較高[22]。以上研究為鱘魚肝的綜合利用提供了參考。研究發現,鱘魚肝中含有金屬硫蛋白(metallothionein,MT),其主要參與微量元素的儲存、運輸和代謝[23-27],由于金屬硫蛋白富含半胱氨酸,可為二硫鍵的合成提供原料,而含硫的肽以及二硫鍵對雙歧桿菌的生長促進活性密切相關[28],這為其開發肽類雙歧因子提供了可能性。因此,利用鱘魚肝制備生物活性肽有利于最大限度地利用水產資源,蛋白酶解后得到的肽類物質也具有作為雙歧桿菌促生長因子的開發潛力。
本研究以鱘魚肝為原料,通過單因素和響應面優化法確定出最佳酶解條件,以6種雙歧桿菌為模式菌株,考察酶解產物對雙歧桿菌的促生長效果,研究結果可為多肽類雙歧桿菌促生長物質的開發以及為水產品加工過程中下腳料的綜合利用提供新思路。
1 材料與方法
1.1 材料與試劑
鱘魚肝:取自西伯利亞鱘-史氏鱘雜交種;青春雙歧桿菌、兩歧雙歧桿菌、動物雙歧桿菌、長雙歧桿菌、短雙歧桿菌和嬰兒雙歧桿菌:本實驗室分離保藏;十二烷基硫酸鈉(sodium dodecyl sulfate,SDS):艾萬拓股份有限公司;二硫蘇糖醇(dithiothreitol,DTT):上海源葉生物科技有限公司;二奎啉甲酸(bicinchoninic acid,BCA)法蛋白定量試劑盒:碧云天生物有限公司;鄰苯二甲醛(o-phthaldialdehyde,OPA)、四硼酸鈉:北京化工廠;L-亮氨酸、堿性蛋白酶(200 000 U/g):北京酷來搏科技有限公司;中性蛋白酶(60 000 U/g)、牛血清白蛋白標準品:北京索萊寶科技有限公司;木瓜蛋白酶(100 000 U/g):南寧龐博生物工程有限公司;胃蛋白酶(400 000 U/g):西格瑪奧德里奇(上海)貿易有限公司;胰蛋白酶(250 000 U/g):寶如億(北京)生物技術有限公司;半胱氨酸鹽酸鹽、MRS肉湯培養基:北京奧博興生物技術有限公司。
1.2 儀器與設備
DNP-9102型恒溫培養箱:上海精宏試驗設備有限公司;TGL-20M型臺式高速離心機、TG16W型微量高速離心機:長沙平凡儀器儀表有限公司;FA1004型電子分析天平:上海天平儀器廠;WH-3型微型漩渦混合儀:上海滬西分析儀器廠;SCL-1300型垂直流潔凈工作臺:北京賽伯樂試驗儀器有限公司;EF28型pH計:梅特勒-托利多儀器(上海)有限公司;SPX-250B-Z型電熱恒溫水浴鍋:上海博訊實業有限公司;722S紫外分光光度計:上海棱光技術有限公司。
1.3 方法
1.3.1 鱘魚肝蛋白酶解液的制備
鱘魚肝→切塊→脫脂→瀝干→攪碎→加水勻漿→調節體系pH值→恒溫酶解→沸水浴滅酶(100 ℃、10 min)→冷卻→離心(8 000 r/min、10 min)→取上清液→酶解液
1.3.2 水解度測定
參照羅艷華等[29-30]對蛋白水解度測定方法中OPA法測定水解度。
1.3.3 蛋白酶種類篩選
使用胃蛋白酶、胰蛋白酶、木瓜蛋白酶、中性蛋白酶、堿性蛋白酶分別對相同量的魚肝進行單酶酶解,并根據各蛋白酶使用說明,分別在其最適pH和溫度條件下添加相同量的酶,并以相同的料液比酶解相同時間,酶解后進行高溫滅酶,測定水解度。考察各蛋白酶對鱘魚肝蛋白水解度的影響,具體酶解條件如表1所示。
1.3.4 鱘魚肝酶解條件優化單因素試驗
選取水解度較高組使用的蛋白酶,設計5因素5水平單因素試驗,分別考察酶解時間(4 h、5 h、6 h、7 h、8 h)、酶解初始pH值(7、8、9、10、11)、酶解溫度(37 ℃、40 ℃、45 ℃、50 ℃、55 ℃)、料液比(1∶10、1∶15、1∶20、1∶25、1∶30(g∶mL))與酶添加量(2 000 U/g、4 000 U/g、6 000 U/g、8 000 U/g、10 000 U/g)對鱘魚肝蛋白水解度的影響。
1.3.5 Plackett-Burman試驗
根據單因素試驗的結果,參考PLACKETT R L等[31]試驗方法,分別在試驗因素的最大響應區間中選擇高低兩水平,使用Design-Expert 8.0.6軟件設計Plackett-Burman試驗,具體方案如表2所示。
1.3.6 最陡爬坡試驗
根據Plackett-Burman試驗結果的貢獻率大小得到的3個顯著因素及效應值來設計最陡爬坡試驗的變化方向和步長[32]。在所選擇的顯著因素中,若效應值為正,則變化方向為增加;若效應值為負,則變化方向為減少;效應值絕對值越大,變化步長應越小,反之應越大。最陡爬坡試驗具體設計方案如表3所示。
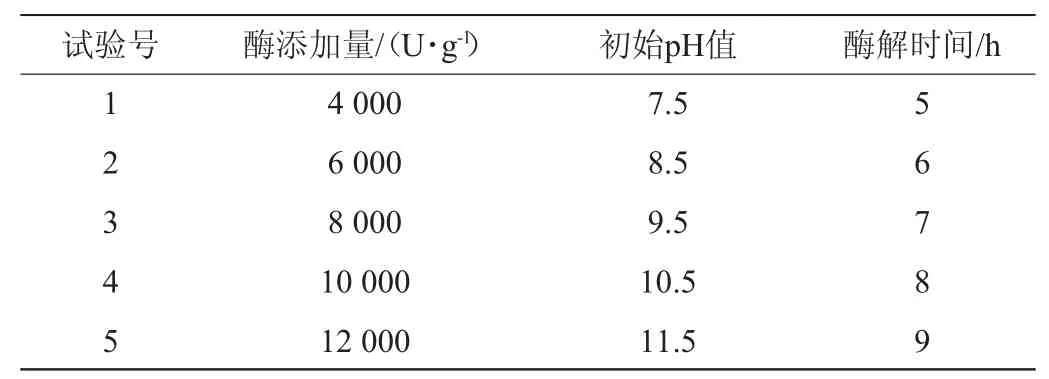
表3 最陡爬坡試驗設計Table 3 Design of the steepest ascent tests
1.3.7 Box-Behnken響應面試驗
以最陡爬坡試驗結果中的拐點作為中心點,由Plackett-Burman試驗中篩選出的顯著影響因素為試驗因素,并以水解度(Y)為響應值,通過Design-Expert 8.0.6軟件設計3因素3水平的Box-Behnken響應面試驗。具體方案如表4所示。對水解度值進行二次多元回歸方程擬合,得到各因素與水解度響應值之間的二次多元回歸方程,根據此方程確定最優解,得到最優酶解條件。

表4 Box-Behnken試驗因素與水平Table 4 Factors and levels of Box-Behnken tests
1.3.8 回歸模型驗證
根據響應面模型優化得到的最佳酶解條件進行驗證試驗,比較模型預測值與實際值,驗證模型的正確、有效性。
1.3.9 鱘魚肝酶解產物對雙歧桿菌體外生長的影響
鱘魚肝酶解液凍干粉的制備:鱘魚肝→切塊→脫脂→瀝干→攪碎→加水調節料液比為1∶10(g∶mL),調節體系pH值為10.04,酶添加量5.27%→恒溫45 ℃酶解8.6h→沸水浴滅酶(100 ℃,10 min)→酶解液→冷卻→離心(8 000 r/min、10 min)→取上清液→微濾→40 ℃旋轉蒸發→冷凍干燥48 h→鱘魚肝酶解液凍干粉。
在無菌無氧操作條件下,取雙歧桿菌凍干粉,用MRS肉湯培養基溶解,于(37±1)℃厭氧培養48 h,然后以3%的接種量連續傳代培養活化。活化后,傳代3代以上進行試驗。
在MRS基礎培養基中添加不同質量的鱘魚肝酶解液凍干粉配制出不同質量濃度的培養基(不添加、0.1 mg/mL、0.2 mg/mL、0.3 mg/mL、0.4 mg/mL、0.5 mg/mL),調節pH值為7.6左右充氮、滅菌;每種菌以3%的接種量分別接種于對應的培養基中,分別于(37±1)℃厭氧靜置培養,24 h后取出發酵液,測定發酵液中活菌數。
1.3.10 數據處理與分析
使用Microsoft Excel2016、SPSS 25.0進行方差分析、繪制統計圖表;Design-Expert 8.0.6進行Plackett-Burman試驗與Box-Behnken試驗設計及結果分析。各處理組間的差異比較選擇TukeyHSD法,P<0.05時有統計學意義。
2 結果與分析
2.1 蛋白酶種類篩選試驗結果
蛋白酶的種類不同,其作用位點、方式及其所結合的底物特性將不同,從而酶解效果不同。由圖1可知,各蛋白酶對鱘魚肝的酶解能力不同,堿性蛋白酶酶解鱘魚肝的水解度最高,為40.44%,酶解效果顯著優于其他酶。因此,選用堿性蛋白酶作為目標酶,進行后續酶解條件參數優化。
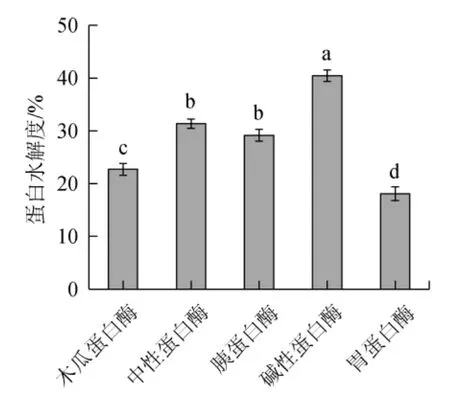
圖1 不同種類蛋白酶對鱘魚肝蛋白水解度的影響Fig.1 Effect of different protease types on the hydrolysis degree of sturgeon liver protein
2.2 鱘魚肝酶解條件優化單因素試驗結果
由圖2(a)可知,蛋白水解度隨著酶解溫度的升高呈先增加后減少的趨勢;酶解溫度在37~50 ℃范圍內,隨著酶解溫度的升高,蛋白水解度增加;酶解溫度為50 ℃時,蛋白水解度最高,為46.62%,繼續升高酶解溫度至55 ℃,蛋白水解度未進一步提升。可能是因為酶解溫度低酶催化效率低;而酶解溫度過高時酶的活性結構破壞,酶活力下降。因此,選擇最適酶解溫度為50 ℃。
由圖2(b)可知,蛋白水解度隨著酶添加量的增加呈現上升趨勢;酶添加量為1%~3%(2 000~6 000 U/g)范圍增加時,水解度升高速度較快;酶添加量為4%時(8 000 U/g),蛋白水解度最高,為53.76%,繼續增加酶添加量對蛋白水解度無進一步提升作用。出現此現象原因可能是相同時間下蛋白酶添加至一定量時,蛋白已基本被酶作用完,所以繼續增加酶的用量酶解效果提升不顯著。因此,選擇最佳酶添加量為4%(8 000 U/g)。
圖2 各因素對鱘魚肝蛋白水解度的影響Fig.2 Effect of various factors on the hydrolysis degree of sturgeon liver protein
由圖2(c)可知,不同料液比各處理組間蛋白水解度無顯著差異(P>0.05),原因可能是因為實際試驗過程為邊振蕩邊酶解,振蕩作用促進了酶在體系中的分散、均勻分布,并及時將蛋白表面已水解的肽分散使得酶時刻與底物充分接觸,同時克服了因料液比提高時體系黏度增大而使蛋白酶分散不均,因此減小了不同處理組間的差異。
由圖2(d)可知,蛋白質水解度隨著酶解時間的增加呈現增加的趨勢;酶解時間為7 h時,蛋白水解度最高,為61.71%,進一步提升時間,水解度未顯著提升(P>0.05),說明7 h左右時酶解反應已基本結束。因此選擇7 h為最佳酶解時間。
由圖2(e)可知,魚肝蛋白質水解度隨初始pH值的提升呈現先增加后降低的趨勢;當體系的初始pH值在7~9范圍內逐漸升高時,鱘魚肝蛋白的水解度呈上升趨勢,體系初始pH為9時,水解度最高,為66.61%,繼續提升pH,酶解效果變差,水解度下降。出現這一變化的原因是酶發揮催化作用存在一最適pH,此pH下酶活性最高,催化蛋白水解效果最優,偏離最優pH值之后,蛋白酶活性下降,催化效果變差。因此,選擇最佳pH值為9。
2.3 Plackett-Burman試驗結果
在單因素基礎上,由Plackett-Burman試驗考察單因素的貢獻率與效應值,確定主要影響因素。試驗考察酶添加量(A)、初始pH值(B)、料液比(C)、酶解時間(D)、酶解溫度(E)5個因素對鱘魚肝蛋白水解度(Y)的貢獻率。根據各單因素試驗結果選擇的高低兩個水平,試驗設計與結果如表5所示。
表5 Plackett-Burman試驗設計與結果Table 5 Design and results of Plackett-Burman tests
使用Design-Expert 8.0.6軟件對Plackett-Burman試驗結果進行效應分析和方差分析,結果如表6所示。

表6 Plackett-Burman試驗效應分析Table 6 Effect analysis of Plackett-Burman tests
由表6可見,酶添加量(A)、初始pH值(B)、酶解時間(D)3因素的效應值為正,應該增加,料液比(C)、酶解溫度(E)2因素的效應值為負,應該減小。其中貢獻率大小表示各因素對該試驗結果影響的大小,由貢獻率的大小可得到這5個因素對模型影響的大小依次為酶解時間>酶添加量>初始pH值>料液比>酶解溫度。因此,最終選擇酶解時間、酶添加量和初始pH值共3個因素進行下一步的最陡爬坡試驗。
2.4 最陡爬坡試驗結果
如圖3所示,最陡爬坡試驗結果呈現先增高后降低的趨勢,在4號試驗點處出現最高點和拐點,該點處酶添加量5%(10 000 U/g)、初始pH值10.5、酶解時間8 h,此時魚肝蛋白水解度達到最大,為80.95%。選擇該點作為下一步Box-Behnken響應面試驗設計的中心點。
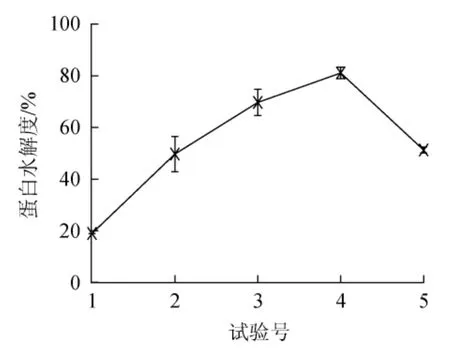
圖3 最陡爬坡試驗結果與分析Fig.3 Results and analysis of the steepest ascent tests
2.5 Box-Behnken響應面試驗結果
利用Design-Expert 8.0.6軟件對酶解時間、酶添加量和初始pH值設計3因素3水平的Box-Behnken試驗,結果見表7,方差分析結果如表8所示。所選擇的回歸模型的P值小于0.01,表明整體模型對試驗結果具有顯著的影響;而失擬項的P值為0.685 6>0.05,失擬項檢驗不顯著,模型選擇適當。蛋白水解度(Y)對酶添加量(X1)、初始pH值(X2)和酶解時間(X3)的多元二次回歸方程為:

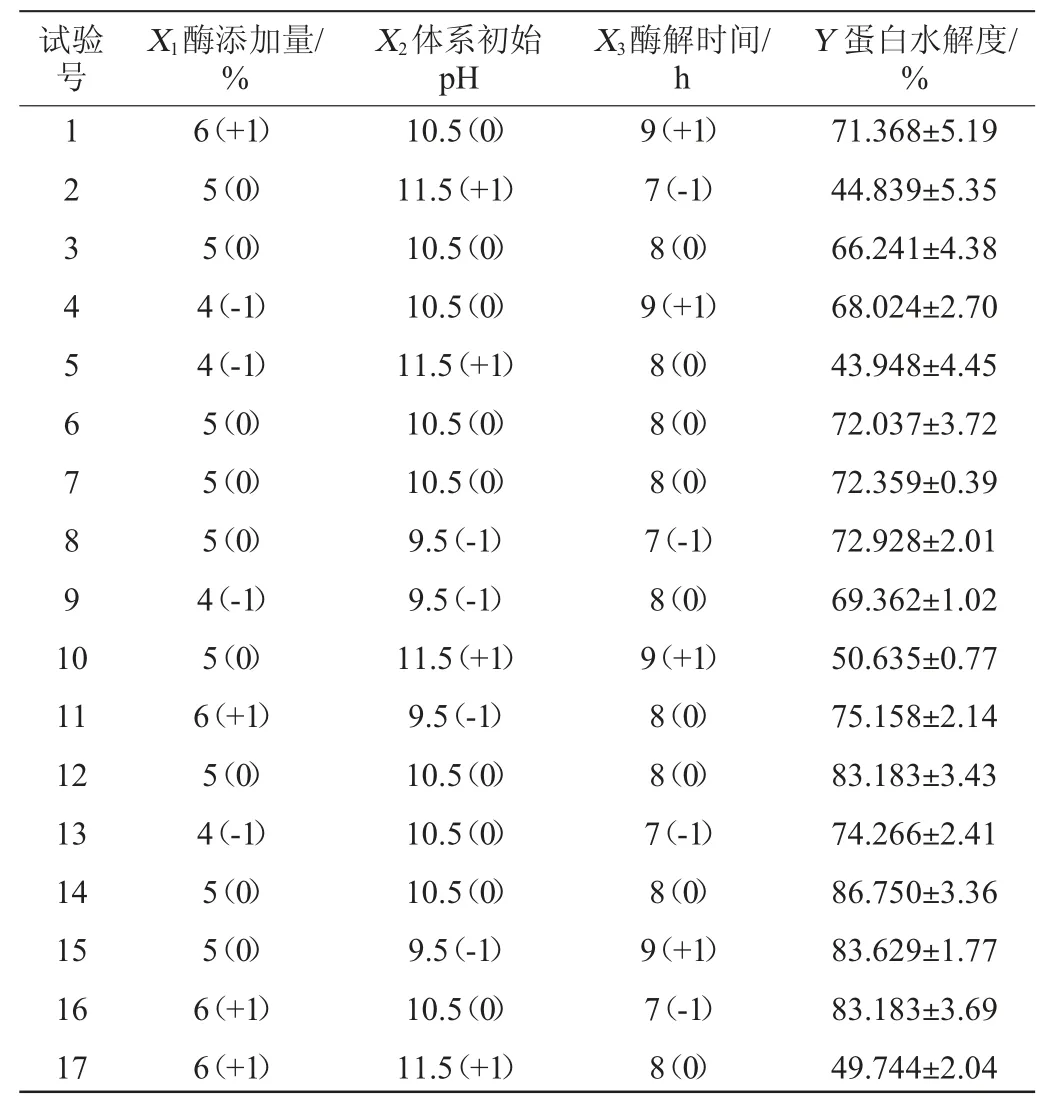
表8 Box-Behnken試驗設計與結果Table 8 Design and results of Box-Behnken tests
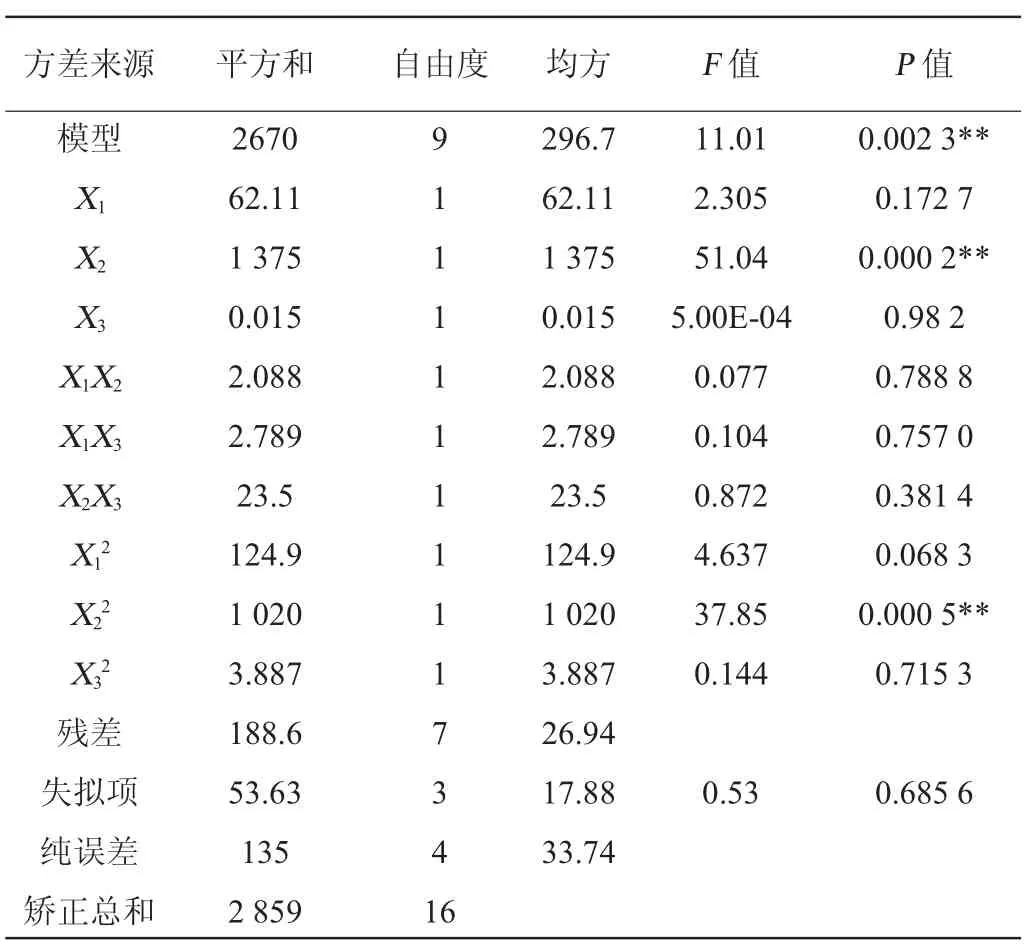
表9 回歸模型方差分析結果Table 9 Variance analysis of regression model
由所得方程可知,二次項系數為負值,其所代表的拋物面開口向下,表明方程具有最大值。由Design-Expert 8.0.6分析計算,得出最優酶解條件為酶添加量10 540 U/g、初始pH值10.04、酶解時間8.60 h,此時水解度可達83.86%。
2.6 回歸模型結果驗證
在優化得到的條件下,根據實際條件,設置酶添加量5.3%(10 540 U/g)、初始pH 10.0、酶解時間8.6h、料液比1∶10(g∶mL)、酶解溫度45 ℃進行3組平行酶解試驗,以對優化結果進行驗證。鱘魚肝蛋白水解度的平均值為81.70%,與預測值擬合度達97.42%,實際值與模型預測值基本一致,模型可信。
2.7 鱘魚肝酶解產物對雙歧桿菌生長的影響
由圖4可知,6種雙歧桿菌在添加有鱘魚肝酶解液凍干粉的培養基中均能夠生長增殖,且在一定質量濃度條件下生長效果較在基礎MRS培養基更優。對不同雙歧桿菌而言,培養基中鱘魚肝酶解液凍干粉質量濃度并不全是越高越好。對于短雙歧桿菌、動物雙歧桿菌和長雙歧桿菌,隨著培養基體系中酶解產物質量濃度的提高,雙歧桿菌活菌數呈現先升高后降低的趨勢;青春雙歧桿菌和嬰兒雙歧桿菌的活菌數隨體系中鱘魚肝蛋白酶解產物質量濃度的升高總體上呈現顯著的上升趨勢;而對于兩歧雙歧桿菌,培養基中酶解產物濃度為0.1 mg/mL的情況下便達到了顯著的促生長效果(P<0.05),且在試驗范圍內,繼續提升添加量,促生長效果不再顯著提升(P>0.05)。不同菌種的結果出現差異的原因可能是菌種之間生長特性的不同以及其各自對酶解產物體系中各類物質利用情況的差異。由于加入的蛋白酶解產物組成比較復雜,成分并不單一;同時菌株對酶解產物的利用也是一個復雜的過程,且菌株間存在差異,促生長機理還需要進一步的研究。
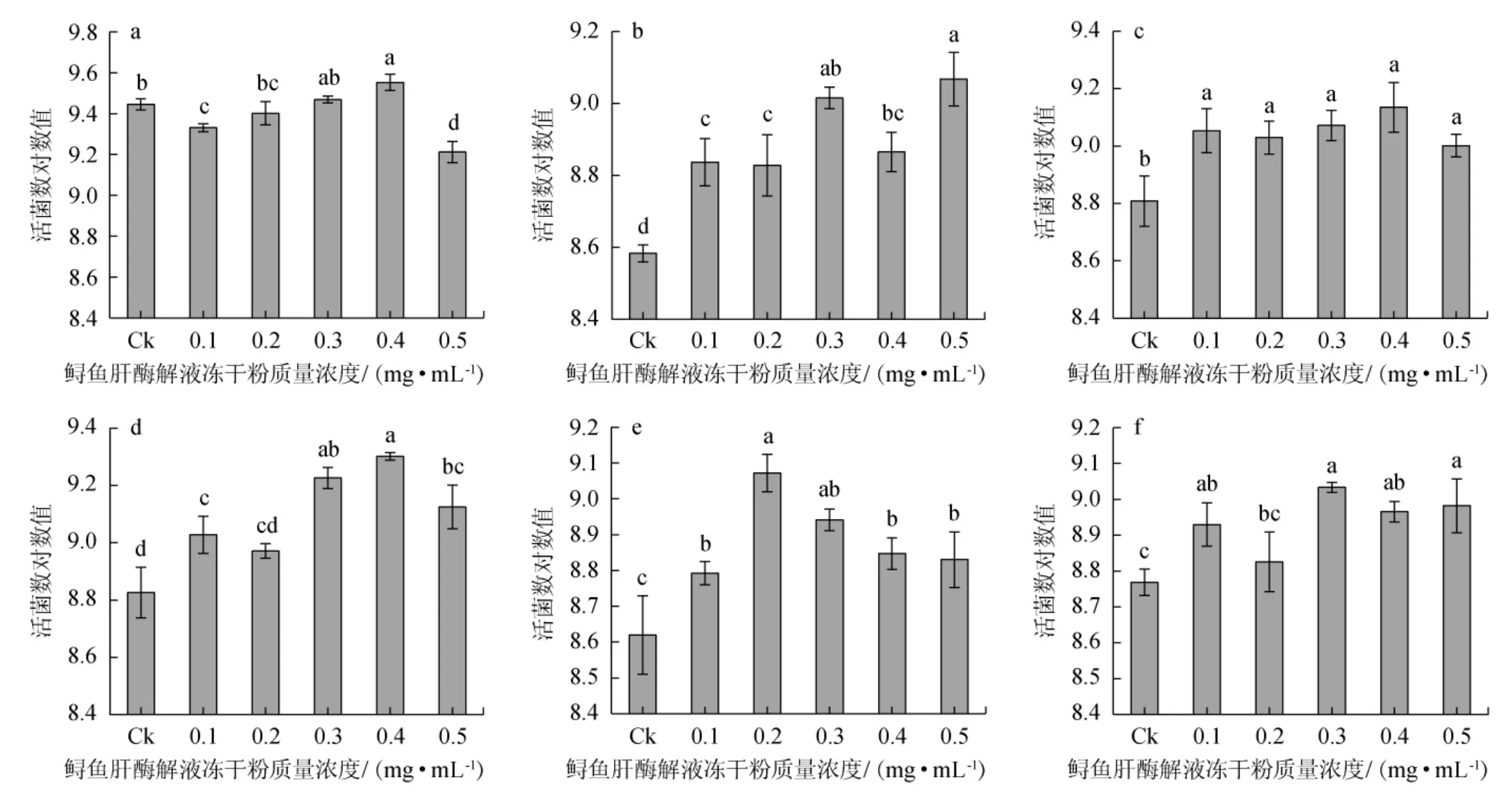
圖4 鱘魚肝蛋白酶解產物對雙歧桿菌體外生長活菌數的影響Fig.4 Effect of sturgeon liver protein enzymatic hydrolysate on the viable Bifidobacterium count in vitro
在試驗水平范圍內,對于短雙歧桿菌、兩歧雙歧桿菌和動物雙歧桿菌,鱘魚肝蛋白酶解液凍干粉質量濃度為0.4 mg/mL時的促增殖效果最好,在這一條件下相對于基礎培養基對照組,活菌數均顯著提高,且差異顯著(P<0.05);對于青春雙歧桿菌、長雙歧桿菌和嬰兒雙歧桿菌而言,魚肝酶解液凍干粉質量濃度分別為0.5 mg/mL、0.2 mg/mL、0.3 mg/mL時促增殖效果最好,在對應條件下相對于基礎培養基對照組,活菌數顯著提高,且差異顯著(P<0.05)。
3 結論
本研究在單因素試驗的基礎上,利用Plackett-Burman試驗確定了酶解主要影響因素酶添加量、初始pH值、酶解時間,最陡爬坡試驗確定了中心點,Box-Behnken響應面試驗確定了二次多項回歸模型,最終確定最優酶解條件:酶添加量5.3%(10 540 U/g),體系pH10.0,酶解時間8.6 h,酶解溫度45 ℃,料液比1∶10(g∶mL)。此條件下最終水解度可達83.86%。
結果表明鱘魚肝蛋白酶解產物具有作為一種雙歧桿菌促生長因子的開發潛力,并為鱘魚副產品綜合利用提供了新思路。

