響應面法優化Chlorella vulgaris 224胞外多糖積累及其抑菌和抗氧化活性
孫建瑞,趙君峰,符丹丹,原江鋒,王大紅
河南科技大學食品與生物工程學院 洛陽市微生物發酵工程技術研究中心,洛陽 471023
微藻因具有光合效率高、生產周期短、油脂含量高、不受季節和氣候限制等優點[1],已成為生產生物柴油最有潛力的原料之一,以微藻制備生物柴油已經成為當前的研究熱點[2]。但是微藻生產油脂存在規模化培養、采收及油脂提取方面成本較高的問題,這限制了微藻生產生物柴油的商業化應用。微藻除了可以用來生產生物柴油,還可以生產許多高附加值代謝產物,如活性多糖[3]、葉黃素[4]、多不飽和脂肪酸[5]、蝦青素[6]、胡蘿卜素[7]、凝集素[8]、藻膽蛋白[9]等各種活性物質,這些活性物質被廣泛應用于食品添加劑、營養保健品及醫藥品等領域,具有很高的經濟價值[10]。因此,從降低微藻生產生物柴油成本方面考慮,可以將這些高附加值代謝產物和油脂一起開發利用。
微藻可以產生多種胞內或胞外多糖物質,這些多糖具有調節機體的免疫力和抗腫瘤、抗炎癥、抗病毒、抗菌活性、抗氧化活性等[11]。Guzman等[12]發現綠藻多糖具有一定的免疫抑制劑活性和抗炎活性。Chen等[13]研究發現從海水小球藻和紫球藻中提取的多糖具有一定的抑制細菌和真菌的活性,尤其對中華根霉與稻瘟病菌的抗菌活性極強。Tannin-Spitz等[14]研究發現提取的紫球藻多糖,及其降解后的不同多糖組分具有清除自由基的能力。Sun等[15]發現球等鞭金藻的胞外多糖具有抑制大腸桿菌和枯草芽孢桿菌的活性。Chen等[16]研究發現薔薇藻的胞外粗多糖具有清除超氧陰離子以及抑制亞油酸自動氧化的能力。同時,國外學者對藻類多糖在醫藥保健和食品領域的應用也有深入研究[17]。
然而,微藻多糖的研究大多集中在胞內多糖,對胞外多糖的研究較少。實驗室前期篩選到淡水微藻(編號為224號),其油脂含量可以達到23.8%,初步鑒定為小球藻(C.vulgaris),有一定的潛在應用前景。本課題組初步實驗發現其能夠積累胞外多糖,且有一定的抑菌和抗氧化活性,因此在培養末期收集藻體提取油脂的同時回收培養液,分離其中的胞外多糖,可以增加C.vulgaris的綜合利用價值。本研究以C.vulgaris作為研究對象,采用響應面法優化其胞外多糖的積累,并對其抑菌活性和抗氧化活性進行研究。
1 材料與方法
1.1 材料與試劑
224號藻株小球藻(C.vulgaris)由實驗室前期篩選得到,受試菌種大腸桿菌(Escherichiacoli)、綠膿桿菌(Pseudomonasaeruginosa)、沙門氏菌(Salmonellatyphimurium)、金黃色葡萄球菌(Staphylococcusaureus)、白色葡萄球菌(Staphylococcusalbus)、枯草芽孢桿菌(Bacillussubtilis)、中華根霉(Rhizopuschinensis)和黑曲霉(Aspergillusniger)來自河南科技大學食品與生物工程學院。
實驗用三氯乙酸、1,1-二苯基-2-三硝基苯肼(DPPH)、二丁基羥基甲苯(BHT)、濃硫酸、碳酸氫鈉、苯酚、乙醇等無機試劑、有機溶劑均為國產分析純;透析袋(截留分子量為7.0 kDa)。
1.2 儀器與設備
萬分之一天平(梅特勒-托利多國際貿易(上海)有限公司);TU-1800型紫外可見分光光度計(尤尼柯上海儀器有限公司);Eppendorf 5417R型臺式高速冷凍離心機(德國艾本德股份公司)。
1.3 方法
1.3.1 微藻的培養
以對數生長期的藻液作為種子液,接種于2 L三角瓶中(內裝1 L SE培養基,初始pH 7.0),接種量為10%(V/V),然后在溫度25 ℃的恒溫光照培養室中培養,光暗比16 h∶8 h,光強度約為100 μmol/m2/s,培養14天。
1.3.2 胞外多糖的制備
微藻培養液6 000 rpm,離心20 min,分別收集藻體和上清液;上清液60 ℃旋轉蒸發濃縮后透析96 h;收集透析液,加入3倍體積的無水乙醇,然后靜置過夜;8 000 rpm離心15 min取沉淀;用5 mL蒸餾水將沉淀溶解,加入適量TCA,攪拌均勻至沉淀不再溶解;8 000 rpm離心10 min,收集上清液;再次添加3倍體積的無水乙醇于上清液中,沉淀3 h;8 000 rpm離心10 min取沉淀,所得沉淀即為胞外多糖;冷凍干燥后放4 ℃備用。
1.3.3 胞外多糖含量和產量的測定
采用苯酚-硫酸法[18]檢測胞外多糖的濃度,胞外多糖濃度的計算采用線性方程:Y= 11.895X-0.044 1,R2= 0.996 8(以葡萄糖作為標準品配制標準溶液,以標準溶液濃度為橫坐標,吸光度為縱坐標作標準曲線,得到糖濃度與吸光值的關系),然后分別根據公式(1)和(2)計算胞外多糖含量和產量。
胞外多糖含量(%)=
(1)
胞外多糖產量(mg/L)=
(2)
1.3.4 單因素試驗
分別考察微藻培養基中NaCl(30、60、90、120、150 mg/L)、NaNO3(100、200、300、400、500 mg/L)、MgSO4(30、60、90、120、150 mg/L)、K2HPO4(50、100、150、200、250 mg/L)和NaHCO3(0、1.0、2.0、3.0、4.0 g)對C.vulgaris224胞外多糖積累量的影響。
1.3.5 響應面試驗設計
單因素試驗之后,進一步進行Plackett-Burman實驗以篩選出多個考察因素中的重要因素,最終選擇NaNO3、NaCl和NaHCO3三個因素進行響應面試驗,各個因素的水平設計如表1所示。
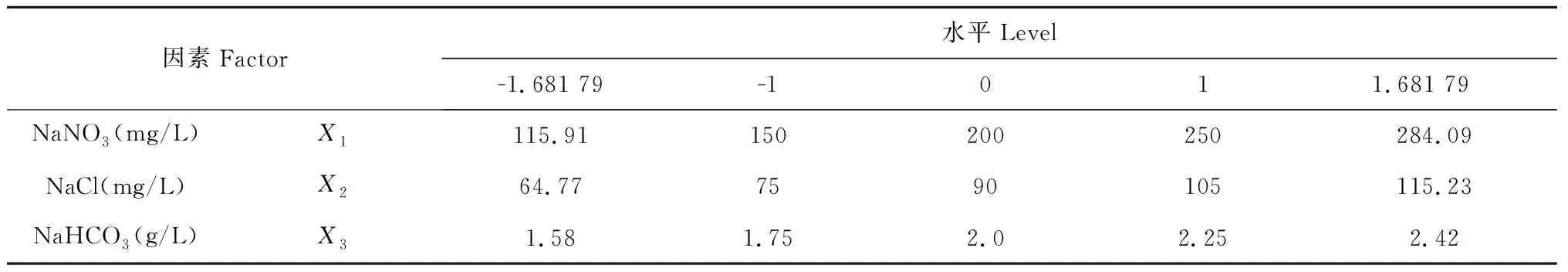
表1 響應面試驗各個因素及水平
1.3.6 抑菌實驗
將受試菌分別接種在對應的細菌和真菌培養基上,置于恒溫培養箱中進行培養(真菌28 ℃ 2天,細菌37 ℃ 1天),然后用接種環挑取活化后的菌種一環于滅菌的蒸餾水中,混合均勻后制成菌懸液。
抑菌試驗采用濾紙片法[19]:將滅菌過的直徑6 mm的圓形濾紙片烘干后,浸泡于制備好的多糖溶液中12 h;然后將制備好的各種菌懸液(200 μL)置于相應的固體培養基表面,涂布均勻;用滅過菌的鑷子將浸泡好的濾紙片貼在培養基表面,之后將培養皿放在恒溫培養箱中進行培養(細菌37 ℃ 18~24 h,真菌28 ℃ 48~72 h),觀察和測量抑菌圈直徑;無菌水作為空白對照。
1.3.7 DPPH自由基清除能力測定
參照Feng等[20]的方法測定,取1.0 mL質量濃度不同的多糖溶液,加入0.004% DPPH溶液4 mL,充分混勻,黑暗下靜置30 min,以無水乙醇作空白對照,相應濃度的BHT作陽性對照,于517 nm處測定其吸光值。每一樣品平行測3 次,取其平均值。清除率公式可表示為:
式中:A1為樣品或者陽性對照的吸光值;A2為空白對照的吸光值。
1.3.8 羥基自由基清除能力測定
參照Feng等[20]的方法測定,在試管中分別加入0.4 mL pH 7.4的PBS、0.25 mL重蒸水、0.15 mL 5 mmol/L的鄰二氮菲溶液和0.5 mL 7.5 mmol/L的FeSO4后混合均勻。然后加入1.0 mL不同質量濃度的多糖樣品溶液,最后加入1%的過氧化氫溶液0.1 mL,37 ℃水浴保溫60 min,536 nm處測定吸光值。陽性對照采用對應濃度的BHT,損傷管中不加樣品,對照管中樣品和過氧化氫都不加,空白管中不加過氧化氫。每一樣品平行測3 次,取其平均值。清除率公式可表示為:
式中A樣品、A損傷、A對照、A空白分別為536 nm處樣品管、損傷管、對照管和空白管的吸光值。
1.3.9 總還原力測定
參照Chen[21]的方法測定,在試管中加入1.0 mL質量濃度不同的多糖溶液,然后加入0.2 mol/L、pH 6.6的PBS 2.5 mL,1%鐵氰化鉀2.5 mL,置于50 ℃水浴中20 min;加入2.5 mL 10%的TCA,混合均勻后3 000 rpm離心10 min;吸取2.5 mL上清液,加2.5 mL重蒸水和 0.5 mL 0.1%的三氯化鐵溶液,以相應濃度的BHT作陽性對照,在700 nm處測定吸光值。每一樣品平行測3 次,取其平均值。
2 結果與討論
2.1 單因素試驗結果
2.1.1 NaCl對胞外多糖積累的影響
如圖1所示,當NaCl濃度為90 mg/L時,C.vulgaris224胞外多糖產量達到最高的21.59 mg/L;之后隨著NaCl濃度的增加,胞外多糖產量呈下降趨勢,而胞外多糖的含量卻繼續升高,各濃度之間的差異達到顯著水平(P<0.05)。這可能是因為C.vulgaris在鹽脅迫下會分泌較多的胞外多糖來抵御外界環境的變化;但是較高的鹽濃度會抑制C.vulgaris的生長,導致其生物量銳減,從而造成胞外多糖產量的下降。因此,NaCl濃度選擇90 mg/L進行后續實驗。
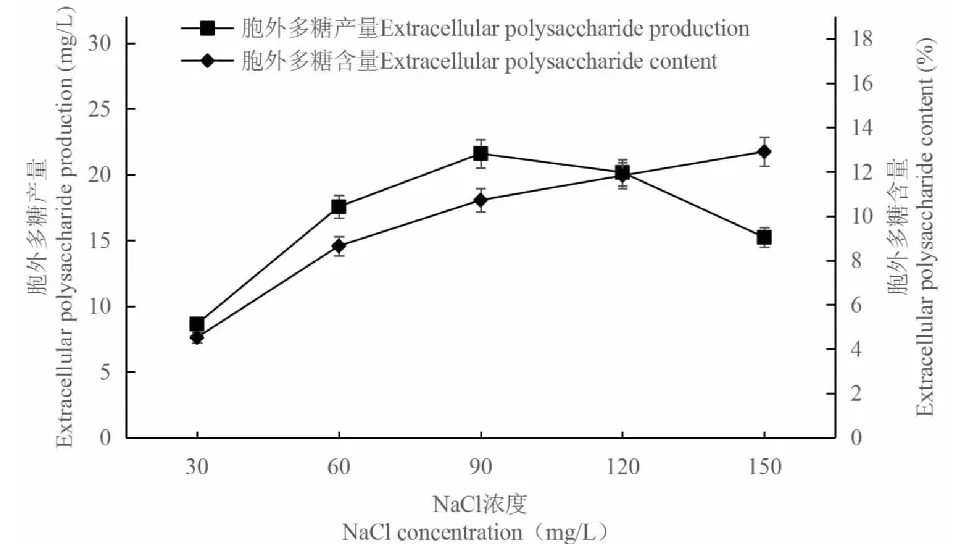
圖1 NaCl對胞外多糖積累的影響Fig.1 Effect of NaCl on extracellular polysaccharide accumulation
2.1.2 NaNO3對胞外多糖積累的影響


圖2 NaNO3對胞外多糖積累的影響Fig.2 Effect of NaNO3 on extracellular polysaccharide accumulation
2.1.3 MgSO4對胞外多糖積累的影響
當MgSO4濃度從30 mg/L升高到90 mg/L時,C.vulgaris胞外多糖的含量和產量呈上升趨勢;在90 mg/L時分別達到最大的11.98%和25.75mg/L;之后隨著MgSO4濃度的增加,胞外多糖的含量和產量則逐漸降低(圖3),各濃度之間的差異達到顯著水平(P<0.05)。研究表明,Mg2+有利于藻類的生長發育,它能夠參與藻細胞內糖、脂肪和蛋白質等物質的代謝;還可以作為酶的活化劑促進藻細胞的新陳代謝。因此,選擇MgSO4濃度為90 mg/L進行后續實驗。
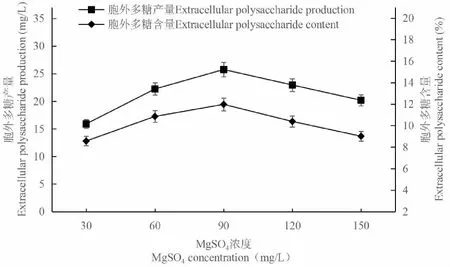
圖3 MgSO4對胞外多糖積累的影響Fig.3 Effect of MgSO4 on extracellular polysaccharide accumulation
2.1.4 K2HPO4對胞外多糖積累的影響
當K2HPO4濃度為100 mg/L時,C.vulgaris胞外多糖的產量和含量都達到最高,分別為12.03%和25.59 mg/L;之后隨著K2HPO4濃度的升高,它們都呈下降趨勢(圖4),各濃度之間的差異達到顯著水平(P<0.05)。因此,K2HPO4濃度選擇100 mg/L進行后續實驗。
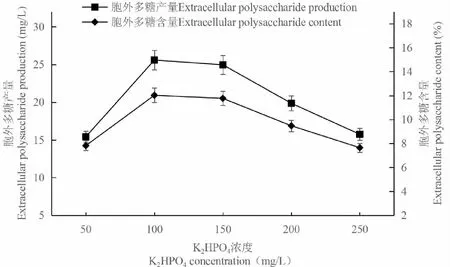
圖4 K2HPO4對胞外多糖積累的影響Fig.4 Effect of K2HPO4 on extracellular polysaccharide accumulation
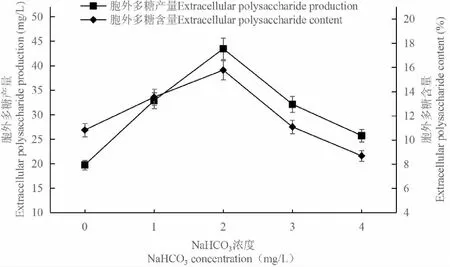
圖5 NaHCO3對胞外多糖積累的影響Fig.5 Effect of NaHCO3 on extracellular polysaccharide accumulation
2.1.5 NaHCO3對胞外多糖積累的影響
添加NaHCO3后,C.vulgaris胞外多糖的含量和產量有明顯的增加,當NaHCO3濃度為2.0 g/L時胞外多糖的含量和產量達到最大,分別為15.77%和43.45 mg/L;之后進一步增加NaHCO3的濃度,胞外多糖的含量和產量則呈大幅下降(圖5),各濃度之間的差異達到顯著水平(P<0.05)。
NaHCO3能夠為微藻的生長發育提供了光合作用所需的碳源,適量添加NaHCO3能夠促進微藻的生長繁殖。NaHCO3的添加雖然可以促進C.vulgaris224的生長發育,但微藻培養基的pH會因NaHCO3的加入而改變,從而使微藻培養基呈堿性,不利于C.vulgaris胞外多糖的積累。
2.2 響應面試驗結果與分析
2.2.1 響應面試驗結果
根據單因素試驗結果,結合PB實驗,最終選擇NaNO3、NaCl和NaHCO3作為自變量,響應值選擇微藻的胞外多糖產量,進行響應面優化試驗,設計方案及結果見表2。
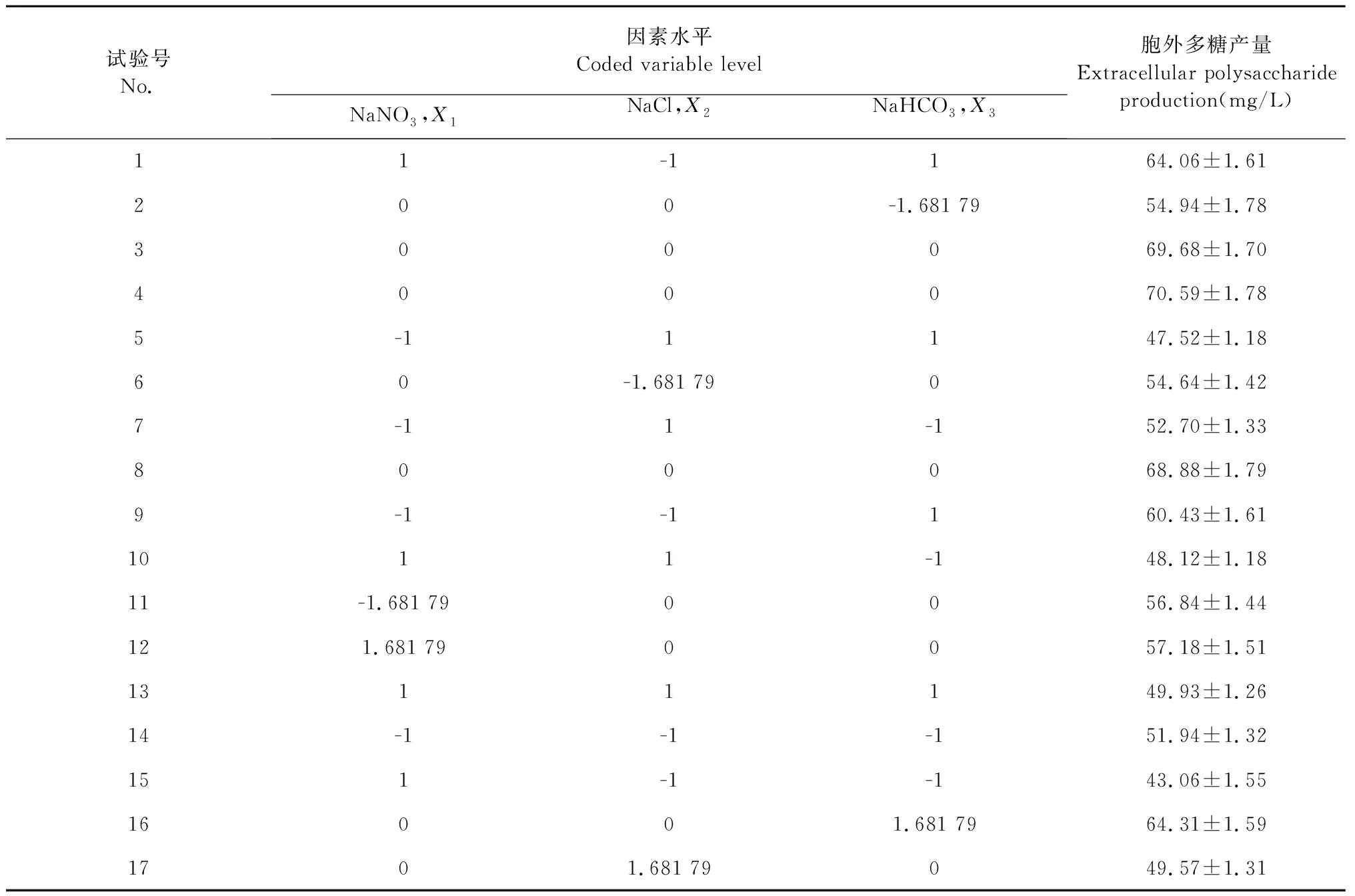
表2 響應面設計方案及結果
2.2.2 模型及顯著性分析
實驗結果采用Design-Expert軟件進行分析,得到的擬合方程如下:
Y=69.92-0.50X1-2.18X2+3.07X3+0.38X1X2+2.44X1X3-4.11X2X3-5.21X12-6.94X22-4.28X32
同時,利用分析軟件對回歸方程的方差分析結果見表3。
由表3可以看出,該模型是高度顯著的(P<0.01)。同時,模型中X2、X3、X1X3、X2X3、X12、X22、X32的P值均小于0.05,說明它們都是顯著的,即它們對微藻胞外多糖的積累均有顯著影響。該模型的失擬項不顯著(P﹥0.05),說明模型選擇合適。
另外,該模型相關系數R2為0.958 4,能夠解釋95.84%的實驗結果,說明該模型相關度很好;模型的變異系數為4.55%,說明實驗操作可靠,該模型能夠很好的反映實驗結果。總之,該模型擬合度好,實驗誤差小,能夠用來分析和預測C.vulgaris胞外多糖的產量。
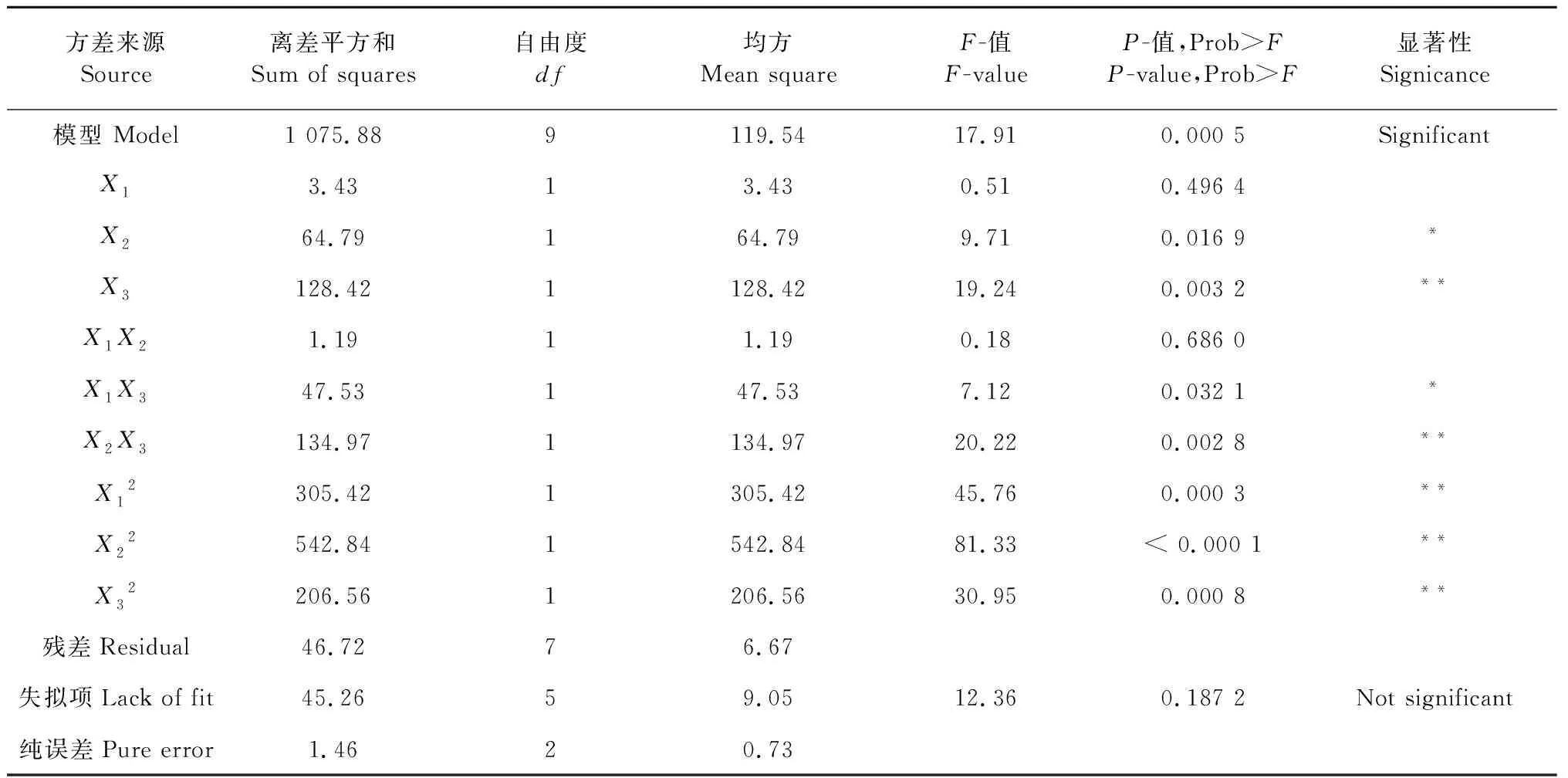
表3 方差分析表
注:*差異顯著,P<0.05;**差異極顯著,P<0.01。
Note:*Significant,P<0.05;**Very significant,P<0.01.
各個因素對C.vulgaris胞外多糖產量影響程度的大小順序依次為:NaHCO3>NaCl>NaNO3,其中NaHCO3對胞外多糖產量的影響極顯著,NaCl對胞外多糖產量的影響顯著。
2.2.3 響應曲面分析
響應曲面圖可以形象地看出各因素之間的相互作用及最佳參數,等高線的形狀可以看出兩個因素之間交互作用的強弱[22]。圖6顯示的是各個因素交互作用的響應曲面圖和等高線形狀圖。
當NaHCO3濃度為2.0 g/L時,微藻胞外多糖產量隨著NaCl和NaNO3濃度的升高先增加后降低;等高線偏圓形,表明NaCl和NaNO3兩個因素之間的交互作用相對較弱(圖6a)。
當NaCl濃度為90 mg/L時,微藻胞外多糖產量隨著NaHCO3和NaNO3濃度的升高先增加后降低;等高線偏橢圓形,說明NaHCO3和NaNO3兩個因素之間的交互作用顯著(圖6b)。
當NaNO3濃度為200 mg/L時,微藻胞外多糖產量隨著NaHCO3和NaCl濃度的升高先增加后降低。等高線呈橢圓形,表明NaHCO3和NaCl兩個因素之間的交互作用顯著(圖6c)。
通過軟件的進一步分析可以得到最大響應值(Y)時各因素(X1、X2、X3)對應的值分別為:X1=203.13 mg/L,X2=85.34 mg/L,X3=2.13 g/L。在此條件下,理論上C.vulgaris224胞外多糖的產量為71.051 3 mg/L。
2.2.4 驗證實驗
根據響應面確定的各因素的最優濃度配制微藻培養基,來驗證所得結果的可靠性。在實驗條件下,C.vulgaris224胞外多糖產量為70.365 7 mg/L,與理論值很接近,相對誤差僅為0.96%,說明該回歸模型準確度高。經優化后,C.vulgaris224胞外多糖比優化前提高了1.62倍。
2.3 胞外多糖的抑菌活性
C.vulgaris224胞外多糖抑菌實驗結果如表4所示,胞外多糖對金黃色葡萄球菌具有較強的抑菌作用,抑菌圈直徑可以達到14.72 mm;同時對白色葡萄球菌、綠膿桿菌和大腸桿菌有較弱的抑菌作用,抑菌圈較小;對枯草芽孢桿菌、沙門氏菌、黑曲霉和中華根霉沒有抑菌作用。
綜上所述,C.vulgaris224的胞外多糖對細菌具有抑菌作用,對真菌沒有抑菌作用;胞外多糖對革蘭氏陽性菌的抑制作用要強于革蘭氏陰性菌。
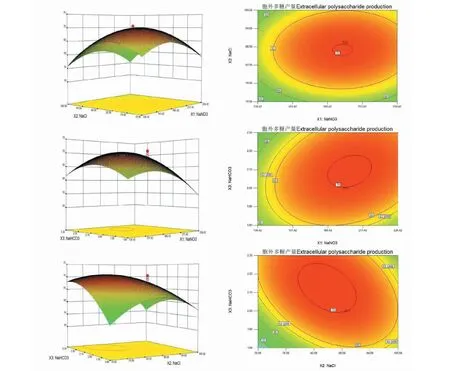
圖6 各因素交互作用對胞外多糖產量影響的響應面圖和等高線圖Fig.6 Response surface and contour plots of effects of interaction between various factors on the production of extracellular polysaccharide
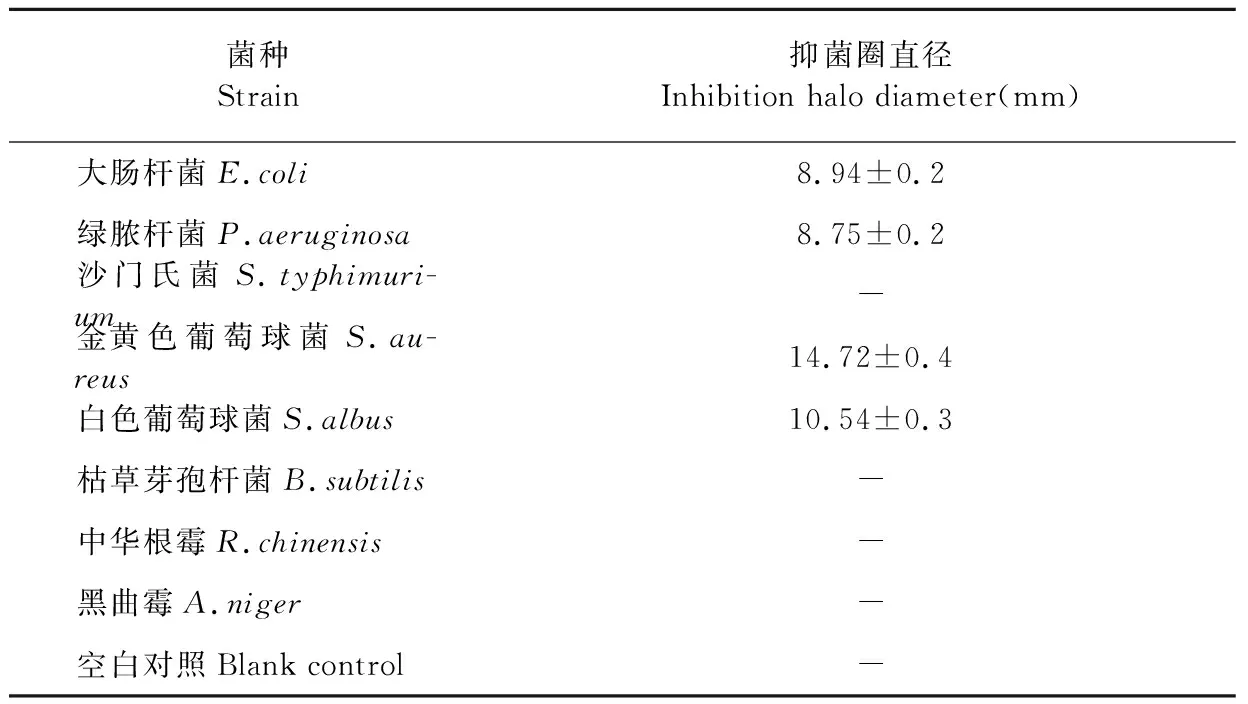
表4 C.vulgaris 224胞外多糖抑菌實驗結果
2.4 胞外多糖的抗氧化活性
2.4.1 DPPH自由基清除能力
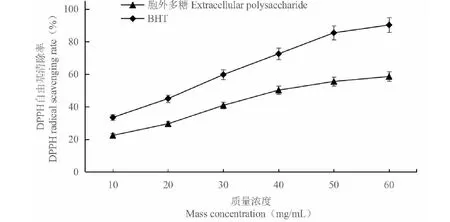
圖7 胞外多糖對DPPH自由基的清除能力Fig.7 DPPH radical scavenging activities of extracellular polysaccharide from C.vulgaris 224
C.vulgaris224的胞外多糖對DPPH自由基的清除能力隨著樣品濃度的升高而增強(圖7)。在檢測的濃度范圍內,胞外多糖的抗氧化活性略低于陽性對照BHT。結果說明,C.vulgaris224的胞外多糖具有較強的清除DPPH自由基的能力。
2.4.2 羥基自由基清除能力
C.vulgaris224的胞外多糖對羥基自由基的清除能力隨著樣品溶液質量濃度的增加而增強;在30 mg/mL時,胞外多糖對羥基自由基的清除率已超過50%(圖8)。在檢測的質量濃度范圍內,胞外多糖的抗氧化活性略低于陽性對照BHT。結果說明,C.vulgaris224的胞外多糖具有較強的清除羥基自由基的能力。
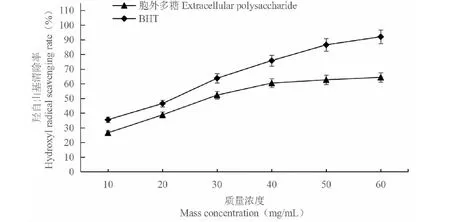
圖8 胞外多糖對羥基自由基的清除能力Fig.8 Hydroxyl radical scavenging activities of extracellular polysaccharide from C.vulgaris 224
2.4.3 總還原能力
C.vulgaris224胞外多糖的總還原能力隨著樣品濃度的升高而逐漸增強(圖9)。在檢測的濃度范圍內,胞外多糖的總還原力始終略低于陽性對照BHT的總還原力。結果說明,胞外多糖的總還原力較強。
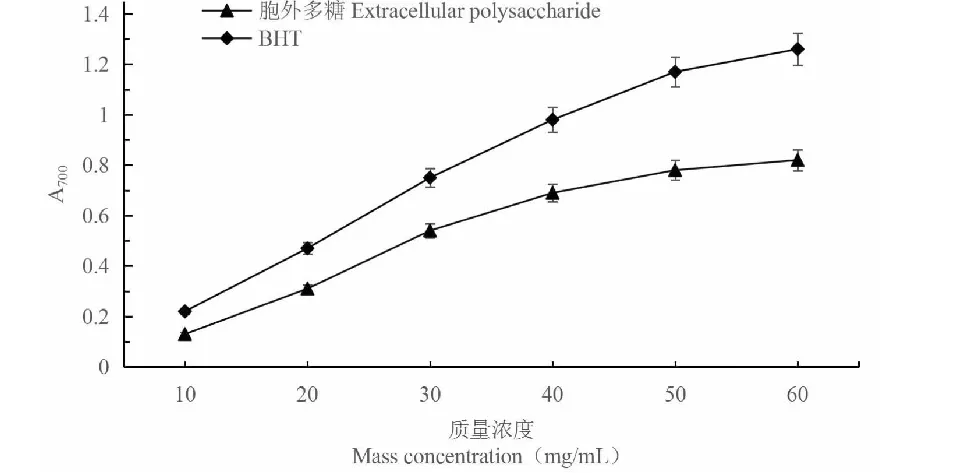
圖9 胞外多糖的總還原能力Fig.9 Reducing power of extracellular polysaccharide from C.vulgaris 224
3 結論
本研究以油脂含量較高的淡水微藻C.vulgaris224作為研究對象,采用響應面法優化其胞外多糖的積累,并對其抑菌活性和抗氧化活性進行研究。通過響應面優化得到的C.vulgaris224積累胞外多糖的最佳參數為NaNO3203.13 mg/L、NaCl 85.34 mg/L、NaHCO32.13 g/L,在此條件下,C.vulgaris224胞外多糖產量為70.365 7 mg/L,比優化前提高了1.62倍。抑菌實驗結果表明C.vulgaris224的胞外多糖對細菌有一定程度的抑菌作用,對金黃色葡萄球菌具有較強的抑菌作用,對白色葡萄球菌、綠膿桿菌和大腸桿菌的抑菌作用較弱;對真菌沒有抑菌作用。同時,抗氧化實驗結果表明C.vulgaris224的胞外多糖具有較強的抗氧化活性。本研究為篩選天然抗菌、抗氧化活性物質提供了一定的參考價值,同時為產油微藻的綜合開發、擴大其應用領域提供了一定的理論依據。

