正畸骨改建中Hedgehog通路下游信號的表達變化
榮崧汐,周夢琪,孫 瑤
骨骼發育和骨改建過程中需要信號通路參與調控,其中Hedgehog(Hh)信號通路在胚胎時期骨發育及出生后骨改建中發揮重要作用[1]。Hh信號通路主要包括3種Hh信號蛋白Shh、Dhh、Ihh,2種蛋白受體Ptch1、Smo,核轉錄因子Gli1、Gli2、Gli3及下游靶基因[2-3]。有報道Hh信號通路參與皮質骨的改建,通過調節血管生成參與成骨機制[4]。Hh信號通路的異常增強或減弱,會引起各種骨骼系統疾病[2]。初級纖毛是突出于細胞表面的細胞器,有感知傳導信號功能,作為細胞的“天線”[5],幾乎所有細胞都有初級纖毛存在[6]。在脊椎動物里,Hh-Gli信號傳導需要初級纖毛的存在和參與[7-8]。而存在于纖毛轉運系統中的纖毛轉運蛋白(IFT)變化影響Hh信號通路的信號傳導。本研究通過建立正畸加力小鼠模型,分別在特定時間點觀察牙槽骨改建情況和破骨細胞在牙槽骨中的分布,以及Hh信號通路和纖毛相關轉運蛋白在正畸過程中的表達變化,探討Hh信號通路和纖毛相關轉運蛋白參與正畸牙槽骨改建的表達變化特征及相關性,為牙槽骨改建中破骨細胞的調節機制提供新的視角。
1 材料和方法
1.1 實驗動物
8周齡野生型小鼠(C57/6J)18只,體質量(28±1.5)g,由同濟大學實驗動物中心提供。動物飼養于SPF級實驗室,喂養固體飼料,飲消毒清水,室溫約20℃,定期消毒。所有動物實驗經同濟大學倫理委員會認可批準(TJLAC-017-027)。
1.2 實驗儀器和試劑
直徑0.2 mm,長度4 mm的螺旋鎳鈦拉伸彈簧(圣馬特,中國);正畸專用直徑0.1 mm結扎絲(晨陽,中國);酸蝕劑(登萊克,中國),樹脂粘結劑(3M,美國);組織處理脫水儀(Microm,德國),石蠟切片機(Thermo Fisher,美國);HE染色試劑盒(威奧,中國);TRAP染色試劑盒(Sigma,美國);山羊血清(邁新,中國);Gli1抗體(Abcam,英國);熒光二抗(Abcam,英國);DAPI(Thermo Fisher,美國);抗淬滅劑(Thermo Fisher,美國);直立熒光顯微鏡和圖像分析系統(Nikon,日本);Trizol(Ambion,美國);Transcriptor First Strand cDNA Synthesis Kit(Roche,瑞士);Light Cycler 96實時熒光定量PCR儀(Roche,美國)。
1.3 小鼠正畸加力模型
1%戊巴比妥鈉麻醉小鼠(80 mg/kg),建立上頜右側第一磨牙正畸加力模型,4 mm拉簧用結扎絲一端固定在第一磨牙處,另一端固定在切牙處,力值為30~35 g,建模步驟參照先前實驗[9]。
1.4 Micro CT測量
取加力0、7、14 d的小鼠,6只/組,4%多聚甲醛(PFA)固定上頜骨24 h,進行上頜骨掃描,選擇中等分辨率8 μm切片增量獲得上頜骨右側近遠中磨牙三維圖像。選取第一磨牙遠中最凸接觸點和第二磨牙近中最凸接觸點作為標記點,使用Micro CT自帶系統軟件SCANCO Medical AG測量牙移動距離。
1.5 石蠟切片及HE、TRAP染色
4%多聚甲醛(PFA)固定小鼠上頜骨24 h,用10%乙二胺四乙酸溶液(EDTA)脫鈣20 d,進行組織脫水石蠟包埋。石蠟組織連續切片,每片厚度4 μm,55 ℃恒溫烤片2 h,60 ℃烘箱30 min,脫蠟入水,HE、TRAP染色。
1.6 免疫熒光染色
切片脫蠟入水,第1天透明質酸37 ℃抗原修復1 h,PBS洗5 min,分3次,山羊血清封閉37 ℃ 1 h,PBS洗5 min,分3次,Gli1抗體(1∶400)4 ℃下孵育過夜,第2天全程避光,復溫至室溫后PBS洗5 min,分3次,Alexa Flour 586IgG(1∶500)室溫孵育45 min,PBS洗5min,分3次,DAPI(1∶1 500)復染5 min,抗淬滅劑封片,熒光顯微鏡拍照。
1.7 實時熒光定量PCR檢測
提取0、7、14 d小鼠右側上頜骨組織,加入1 mL Trizol試劑,機械研磨粉碎,提取組織總RNA。使用Transcriptor First Strand cDNA Synthesis Kit,用Oligo DT引物,終體積為20 μL,從1 μg總RNA合成1個cDNA。實時熒光定量PCR反應體系:以GAPDH為內參基因,上下游引物(10 μmol/L)各0.5 μL, DyeⅡ 0.5 μL,cDNA 2 μL,SYBR Premix ExTaq12.5 μL,雙蒸水定容20 μL,測定Ct值(Roche PCR儀),進行相對定量分析。引物列于表1中。

表1 引物序列
1.8 統計方法
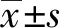
2 結 果
2.1 建立正畸加力模型,加力后顯示第一磨牙向近中移動
如示意圖所示建立正畸加力模型(圖1A)。CT三維成像顯示相對于未正畸小鼠,加力7、14 d小鼠上頜骨右側第一磨牙向近中移動(圖1B、1C、1D)。統計牙移動距離顯示加力7 d移動距離為(0.251±0.0194)mm,14 d牙移動距離為(0.359±0.064)mm,移動距離具有統計學差異(P<0.001)。
A:正畸加力示意圖;B~D:右側上頜第一磨牙加力0、7、14 d牙移動變化;E:右側上頜第一磨牙加力7、14 d移動距離;箭頭示移動方向;*:P<0.05
圖1建立正畸牙移動模型
Fig.1Establishment of orthodontic tooth movement model
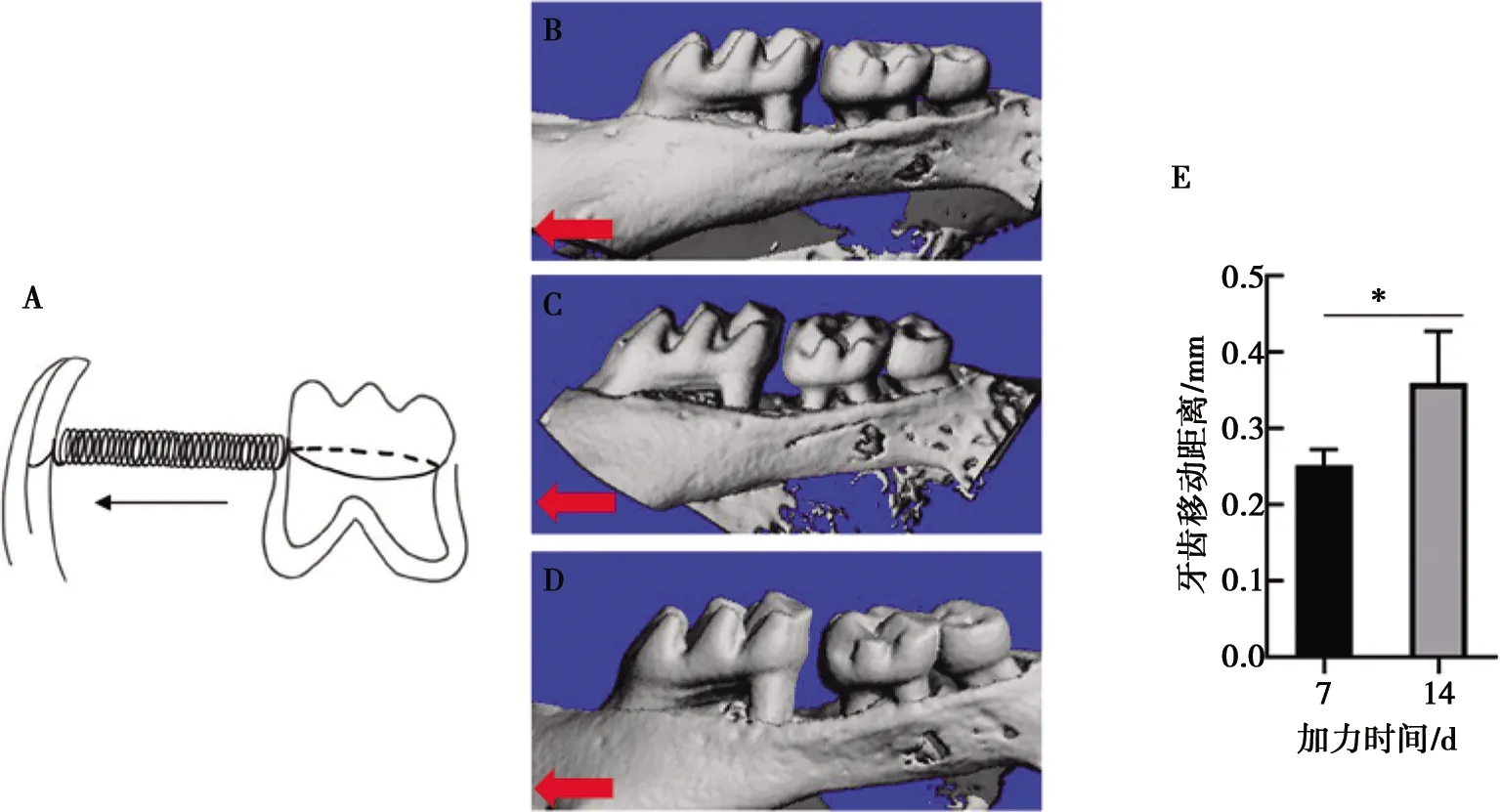
2.2 正畸加力牙槽骨改建情況及破骨細胞數量變化
HE染色顯示未正畸小鼠牙周膜連續致密,牙槽骨結構完整,可見疏松骨髓腔;TRAP染色未見牙槽骨中有破骨細胞生成。正畸7 d小鼠牙槽骨壓力側牙周膜受壓萎縮,牙槽骨受壓后骨質疏松多孔,14 d可見壓力側牙槽骨吸收明顯(圖2A);TRAP染色可見破骨細胞生成,主要集中在壓力側(圖2B),差異具有統計學意義(P<0.05)(圖2C)。破骨細胞特異酶抗酒石酸酸性磷酸酶(TRAP)和組織蛋白酶K(CTSK)加力前表達水平較低,7 d和14 d連續上調,差異具有統計學意義(P<0.05,圖2D)。
A:加力0、7、14 d HE染色示牙槽骨壓力側牙周膜紊亂,牙槽骨改建明顯; B:加力0、7、14 d TRAP染色示破骨細胞生成逐漸增加,壓力側骨吸收明顯; C:牙槽骨壓力側TRAP陽性細胞計數; D:破骨細胞相關基因TRAP 、CTSK mRNA表達水平;R:牙根;PL:牙周膜;MB:近中牙槽骨。紅色箭頭示牙齒移動方向,黑色箭頭示TRAP陽性破骨細胞;*:P<0.05
圖2加力后右側上頜第一磨牙牙槽骨改建情況
Fig.2Alveolar bone remodeling of the right maxillary first molar of mice after force
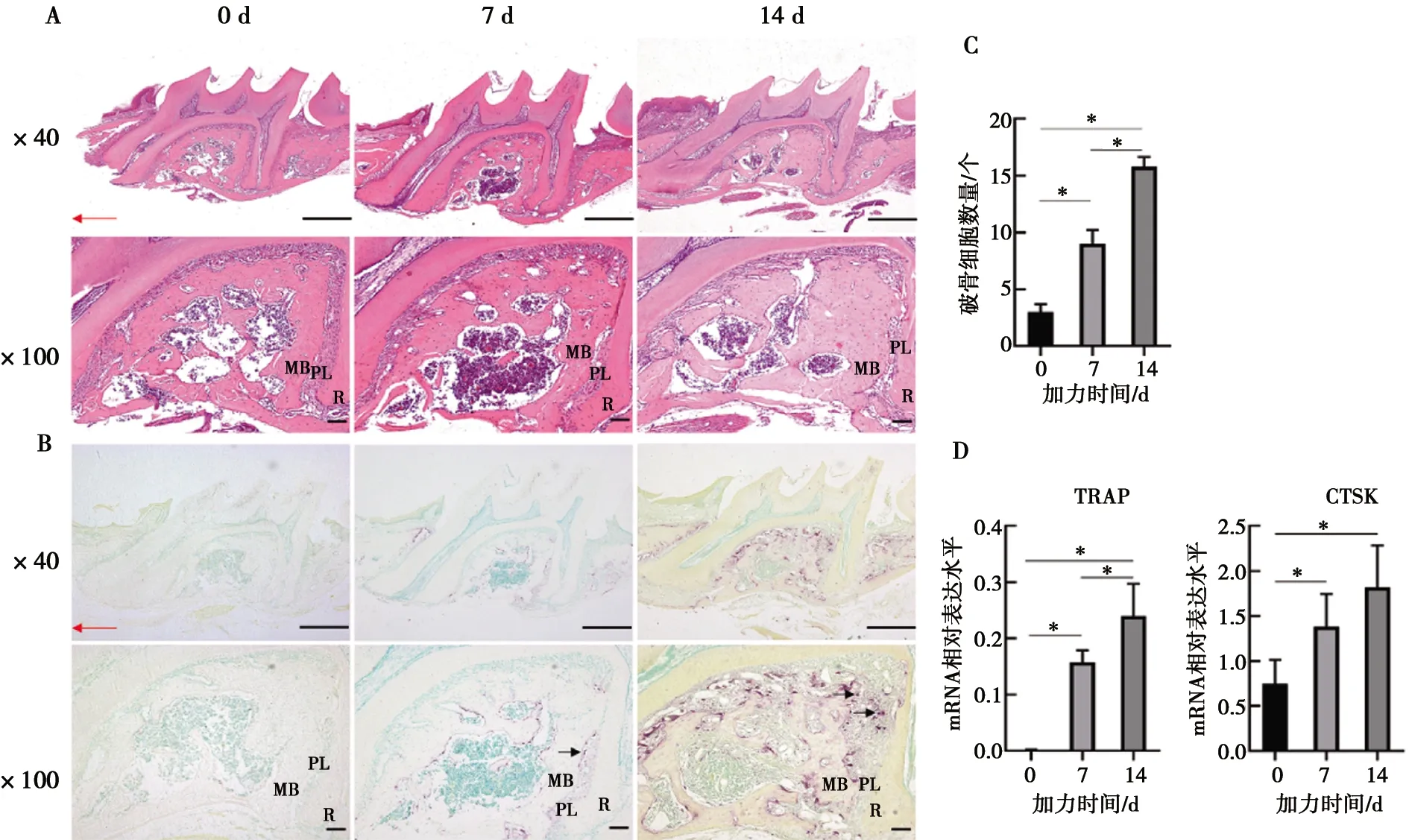
2.3 熒光染色示Gli1陽性細胞在牙槽骨中的表達分布及Hh信號通路分子Shh、Smo、Gli1表達水平變化
免疫熒光染色顯示未加力小鼠牙槽骨中Gli1陽性細胞較少((3.333±0.471)個),加力7 d可見牙槽骨中有大量Gli1陽性細胞出現,并且主要分布在牙槽骨壓力側(圖3A),計數Gli1陽性細胞在7 d時表達最高((28.000±0.816)個),14 d下降((22.667±1.247)個)(P<0.05,圖3B)。Hh信號通路分子Shh、Smo、Gli1在加力7 d時表達水平達到峰值,14 d表達水平下降,但整體表達水平在加力后上升,0、7、14 d表達水平具有統計學差異(P<0.05,圖3C)。
A:加力0 d牙槽骨中無明顯Gli1陽性細胞,7 d Gli1陽性細胞在牙槽骨中表達明顯,14 d在牙槽骨壓力側聚集表達; R:牙根;PL:牙周膜;MB:近中牙槽骨;圖中白色箭頭示Gli1陽性細胞;B:加力0、7、14 d Gli1陽性細胞表達水平定量;C: 加力0、7、14 d Hedgehog信號通路分子Shh、Smo、Gli1 mRNA表達水平,*:P<0.05
圖3免疫熒光染色示Gli1陽性細胞在正畸骨改建中表達分布及Hedgehog通路下游分子表達變化
Fig.3Immunofluorescence showed Gli1positive cell expression in orthodontic bone remodeling and the expressionlevels of Hedgehog pathway downstream signals
2.4 纖毛相關轉運蛋白Ift144、Ift88、Ift74和纖毛動力蛋白Kif3a表達水平
實驗結果顯示轉運復合體A(IFTA)中的Ift88隨加力時間在7 d時輕微下降,在14 d時表達水平上升,差異具有統計學意義(P<0.05)。IFTA中的Ift74在牙槽骨加力后14 d表達水平上調,有統計學差異(P<0.05)。轉運復合體B(IFTB)中的Ift144表達水平在7 d時下降明顯,14 d略微上升(P<0.05)。纖毛動力蛋白Kif3a表達水平在加力7、14 d中明顯上升(P<0.05,圖4)。
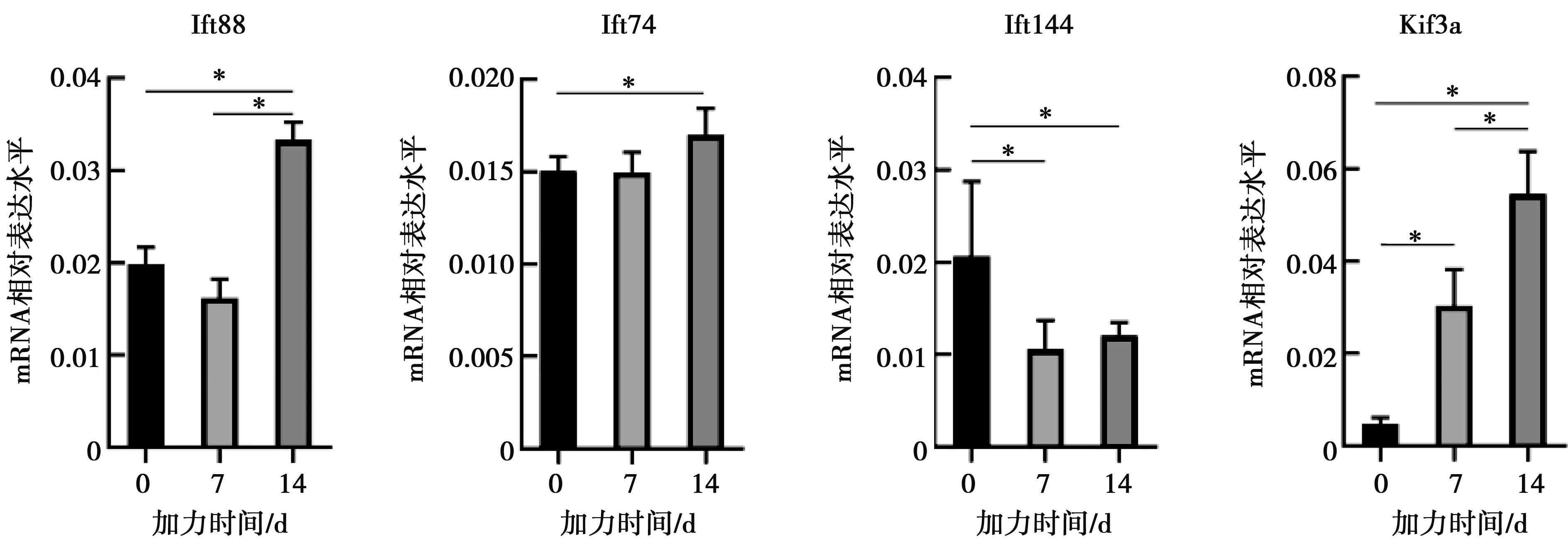
加力0、7、14 d Ift88、Ift74、Ift144、Kif3a mRNA表達水平,*:P<0.05
圖4不同時間點纖毛相關轉運蛋白和纖毛動力蛋白mRNA表達水平
Fig.4Expression level of intraflagellar transport protein and ciliary dynein protein at different time points
3 討 論
正畸下的牙槽骨改建包括壓力側的骨吸收和張力側的新骨形成。發現小鼠正畸早期牙槽骨中生成大量破骨細胞,壓力側骨吸收區域明顯,牙移動距離隨著正畸天數增加而不斷加大(P<0.05),破骨細胞相關特異酶TRAP和CTSK在正畸加力后表達水平上調,14 d時具有明顯差異(P<0.05)。說明正畸早期牙槽骨改建以骨吸收為主。
Hedgehog信號通路在胚胎和成體組織的發育和維持中具有重要作用[10-12],參與骨髓間充質干細胞向軟骨分化[13-14],在Shh誘導的小鼠胚胎成骨細胞前體細胞MC3T3-E1中成骨細胞特異性轉錄因子Osterix表達上調促進間充質干細胞(MSCs)向成骨細胞分化[15]。 Heller等[16]發現在體外抑制Hh效應器Smo表達后減少破骨細胞生成。Shimo等[17]在CD11b陽性細胞破骨向培養中加入Shh發現促進破骨細胞分化的活化T細胞核因子1(Nfatc1)表達上調,證實Hh信號通路影響破骨細胞活性。此研究聚焦于體內,發現Shh在正畸7 d時表達較高(P<0.05),提示正畸骨改建激活Hh信號通路。Shh的升高抑制了膜受體Ptch1的表達,解除了對Smo的結合抑制,Smo表達在7 d時達到高峰而隨后下降(P<0.05)。Hh信號通路中具有激活效應的轉錄因子Gli1在Hh通路激活后表達上調[18],免疫熒光染色示Gli1陽性細胞在牙槽骨壓力側表達集中,其mRNA表達水平在7 d較高(P<0.05)。這些結果提示Hh信號通路參與正畸牙槽骨改建,正向調控破骨細胞的分化[19-20]。未來可進一步研究牙槽骨改建過程中Shh信號和破骨細胞生成的相關性。
初級纖毛是介導Hedgehog信號的重要細胞器。纖毛轉運蛋白復合體系統(IFT)維持纖毛結構和信號傳導,分為逆向纖毛轉運蛋白系統A(IFTA)和正向纖毛轉運蛋白系統B(IFTB)。作為信號傳導器,推測物理刺激導致纖毛相關轉運蛋白表達改變影響Hh信號通路。Ift144是IFTA中的核心蛋白,構建ift144等位基因突變小鼠顯示轉運膜蛋白缺損使得Shh活性喪失[21],實驗結果顯示ift144在加力后下降明顯,第14天表達略有上升,可能源于激活早期以正向運輸纖毛蛋白積聚在纖毛頂部,逆向轉運系統暫時抑制所造成,仍需進一步實驗探究。IFTB的缺失會損害Hh信號通路,其中Ift88影響Hh信號通路激活[22]。選取IFTB上的核心蛋白Ift88和Ift74,發現Ift88呈先下降后上升趨勢,Ift74在早期變化不明顯,14 d時表達升高。推測Hh信號通路與IFTB核心蛋白之間多向性調控。Kif3a是纖毛正向運輸系統中動力蛋白亞基,相關研究顯示Kif3a的缺損會導致Shh敏感性下降[23],減弱細胞內鈣離子對流體剪切力的響應,降低Hh信號通路的活性[24],Kif3a在正畸骨改建中表達激活,判斷Kif3a在正畸牙槽骨改建中參與Hh信號通路正向調控。
有研究證實Hh信號通路在體外促進破骨細胞生成,增強骨吸收能力。但是在體內則缺乏相關研究。上述結果說明在正畸力的作用下,以破骨細胞為主導的正畸骨改建階段,牙槽骨中Hh信號通路的基因表達水平上調,同時纖毛相關轉運蛋白的表達水平有明顯變化,提示我們牙槽骨中破骨細胞的生成可能會受到纖毛轉運系統激活Hh信號通路的影響,本研究為理解正畸牙移動過程中破骨細胞的激活和生成提供新的視角和理論依據。骨改建過程中初級纖毛對Hh信號通路的調控機制,有待于進一步研究。

