植酸酶YiAPPA在糞腸球菌中的高效組成型表達研究
(江西省科學院微生物研究所,江西南昌 330096)
植酸是單胃動物日糧中主要的抗營養因子,對蛋白質、脂類、礦物質離子等營養素均具有極強的吸附和螯合能力[1]。另外,單胃動物由于缺少分解植酸的酶,導致一些營養素的消化和吸收率降低,大量營養素被排泄到體外,造成對環境的污染[1]。植酸酶是能夠將植酸分解為肌醇和無機磷的一類磷酸酯酶,是單胃動物日糧中最常見的飼料添加劑,其在飼用酶制劑生產和銷售市場中占有很大的份額[2-8]。植酸酶作為飼料添加劑能夠減輕植酸磷對環境的污染和解除飼料中植酸的抗營養作用。在實際生產中,通過添加外源性植酸酶可在一定程度上消除抗營養因子植酸的不良影響,但也增加了飼料成本,并且只能取得短期效應,同時在飼料制粒過程中,額外添加的植酸酶易因高溫而失活[9]。因此,如何在實際生產中高效利用植酸酶具有重要意義。其中利用基因工程技術將植酸酶在乳酸菌宿主中進行表達將是一種可行的和廉價的策略。
來源于Yersiniaintermedia的植酸酶YiAPPA是目前已知的植酸酶活性最高的植酸酶,其于37 ℃、pH4.5條件下的酶活高達3960 U/mg[10],是目前應用最廣泛的植酸酶AspergillusnigerPhyA酶活的40倍[11]。YiAPPA的最適反應pH為4.5,于pH2.0~5.5條件下具有50%以上的相對酶活,于pH1.0~8.0條件下具有80%以上的穩定性,并且對于胃蛋白酶和胰蛋白酶均具有較強的抗性[10]。YiAPPA的酶學性質使其在飼料工業中具有巨大的應用潛力,但是其酶學性質(特別是熱穩定性)難以完全滿足飼料工業的要求。以YiAPPA的熱穩定性為例,飼用酶制劑在飼料制粒過程中需要經過一個75~93 ℃的短暫高溫,而YiAPPA于80 ℃的半衰期僅為15 min[10],難以滿足飼料工業的要求。
乳酸菌是以乳酸為主要代謝產物的各類細菌統稱,是人與大多數動物腸道內常見優勢菌群,被公認為安全級微生物[12]。乳酸菌進入動物體內不但可以保持腸道菌群微生態平衡,還可以提供很多益生作用。乳酸菌表達系統越來越受到重視,其優點在于乳酸菌安全,無內毒素,可以在腸道中存活定殖,其表達的外源蛋白質可以源源不斷在腸道中生產并起到相應的作用[13-16]。但是乳酸菌表達系統存在表達量低的缺點[17],通過改造控制基因表達的順式作用元件是提高蛋白質表達量的常用手段,而其中最常用的就是找到一種高效的啟動子。乳酸菌屬的啟動子對宿主有著高度的選擇性和特異性[18]。因此在乳酸菌表達系統中很少使用外源啟動子甚至是不同種屬的啟動子。這就需要對乳酸菌內源性的啟動子進行克隆和篩選,從而找到所需的啟動子。目前用于構建乳酸菌表達載體的啟動子包括誘導型啟動子和組成型啟動子,對應的表達載體分為誘導型表達載體和組成型表達載體[19-20]。誘導型表達載體的優點在于在添加誘導物的條件下可以相對提高外源蛋白質的表達量;其缺點在于在大規模發酵生產中,誘導物的添加使得工藝變得繁瑣,生產成本變高,并且誘導物的添加是否會對人和動物機體產生非安全方面的影響還有待研究。組成型乳酸菌表達載體則可以在不添加誘導物的情況下不斷地表達目的蛋白,在飼料生產、食品發酵等工業生產中簡化操作步驟,同時降低成本,便于大規模生產[21]。乳酸菌組成型啟動子在功能上的優勢使其在科研和工業生產中顯得越發重要,因此克隆和篩選高效的乳酸菌組成型啟動子具有重要意義。
本研究以本實驗室前期從健康仔豬腸道黏膜上分離純化得到的具有優良益生特性的糞腸球菌EXW27為宿主菌,結合人工啟動子文庫技術和高通量篩選技術,獲得控制YiAPPA高效組成型表達的強組成型啟動子,從而構建既具有益生特性又具有植酸酶活性的轉基因糞腸球菌。本研究一方面可為植酸酶YiAPPA的應用提供新策略,另一方面也為研制新型轉基因微生態制劑奠定基礎。
1 材料與方法
1.1 材料與儀器
大腸桿菌EscherichiacoliJM109、糞腸球菌EntercoccusfaecalisEXW27、大腸桿菌-乳酸菌穿梭質粒pSIP409、重組質粒pSTOP1622-yiappah 均由本實驗室保存;KOD-Plus-neo DNA聚合酶 日本Toyobo公司;DNA限制性內切酶、T4 DNA連接酶、DNA Marker、蛋白質Marker 美國Fermentase公司;DNA膠回收試劑盒、質粒抽提試劑盒E.Z.N.A. 美國Omega Bio-tek公司;B-PERTMBacterial Protein Extraction Reagent 美國Thermo Fisher Scientific 公司;Chelating SepharoseTMFast Flow 美國GE Healthcare公司;Bradford法蛋白濃度測定試劑盒、PCR引物 上海生工生物工程股份有限公司;乳酸桿菌素sakacin P 百靈威科技有限公司;實驗所用試劑 均為國產分析純。
Mastercycler gradient型PCR儀 美國Eppendorf公司;TY04S-3C型凝膠成像系統 北京君意東方電泳設備有限公司;SCIENTZ-ⅡD型超聲波細胞破碎儀 寧波新芝生物科技股份有限公司;SP-752PC型紫外可見分光光度計 上海光譜儀器有限公司;iMark 酶標儀 美國Bio-Rad公司。
1.2 實驗方法
1.2.1 重組質粒pSIP409-yiappads的構建與鑒定 基于yiappa的堿基序列,設計引物P1和P2(表1),以重組質粒pSTOP1622-yiappah為模板,擴增基因yiappa中不含信號肽的結構基因yiappads。PCR擴增體系為:10×buffer I 5 μL;dNTP 5 μL;MgSO45 μL;引物各2 μL;模板1 μL;KOD-Plus-neo DNA聚合酶2 μL;ddH2O 28 μL。PCR擴增條件為:98 ℃ 5 min;98 ℃ 20 s,60 ℃ 20 s,74 ℃ 2 min,30個循環;74 ℃ 10 min。擴增產物經Nco I和Xho I雙酶切,連接至經同樣雙酶切處理的載體pSIP409,構建重組質粒pSIP409-yiappads。將連接產物轉化大腸桿菌EscherichiacoliJM109感受態細胞,將轉化產物全部涂布于含200 μg/mL紅霉素的LB固體平板上,于37 ℃過夜培養。挑取LB固體平板上轉化子,提取其中所含重組質粒。采用Nco I和Xho I雙酶切重組質粒鑒定是否有外源基因的插入。

表1 構建重組質粒所用引物序列Table 1 Primer sequences for the construction of recombinant plasmids
引物P3中N為25%的A、G、C或T;S為50%的G或C;W為50%的A或T;R為50%的A或G。1.2.2 YiAPPA在糞腸球菌中組成型表達的人工啟動子文庫的構建 在NCBI中找出糞腸球菌中16S rRNA的啟動子序列,采用DNAMAN軟件對啟動子序列進行比對,確定啟動子序列中核心序列和非核心序列。將啟動子序列中核心序列保持不變,將非核心序列設計為隨機化序列或半保守序列,并結合穿梭質粒pSIP409的結構特點,設計構建人工啟動子文庫所需的上游PCR引物P3(如表1和圖2所示)。再基于yiappa的堿基序列,設計構建人工啟動子文庫所需的下游PCR引物P4(如表1和圖2所示)。以重組質粒pSIP409-yiappads為模板,以P3和P4為引物,進行PCR擴增。PCR擴增條件為:98 ℃ 5 min;98 ℃ 20 s,60 ℃ 20 s,74 ℃ 20 s,30個循環;74 ℃ 10 min。擴增產物經Bgl II和Nco I雙酶切,連接至經同樣雙酶切處理的載體pSIP409-yiappads。將連接產物轉化大腸桿菌EscherichiacoliJM109感受態細胞,將轉化產物全部涂布于含200 μg/mL紅霉素的LB固體平板上,于37 ℃過夜培養。挑取LB固體平板上所有轉化子,提取其中所含重組質粒并電擊轉化糞腸球菌EntercoccusfaecalisEXW27,將轉化產物全部涂布于含10 μg/mL紅霉素的MRS固體平板上,37 ℃培養24 h,獲得人工啟動子文庫。糞腸球菌EntercoccusfaecalisEXW27的電擊轉化方法參照參考文獻[22]進行。
1.2.3 YiAPPA在糞腸球菌中組成型表達的人工啟動子文庫的高通量培養和篩選
1.2.3.1 人工啟動子文庫的高通量培養 取滅菌、烘干的96孔深孔板,每孔加入含10 μg/mL紅霉素的MRS液體培養基500 μL。用10 μL移液槍扎取槍頭后挑取單菌落,轉移到培養孔中,依次反復直至挑選結束。蓋上蓋子,于搖床中37 ℃靜置培養24 h進行活化。用8通道移液器按照順序將活化后的種子液轉接至48孔深孔板中,接種量為3%。蓋上蓋子,于37 ℃靜置培養至OD600 nm為1.8(培養時間約為36 h)。其中,陰性對照為未經誘導處理的轉化了重組質粒pSIP409-yiappads的重組糞腸球菌;陽性對照為經乳酸桿菌素sakacin P誘導處理的轉化了重組質粒pSIP409-yiappads的重組糞腸球菌(誘導條件為:當重組糞腸球菌生長至OD600 nm為0.3時,加入50 ng/mL sakacin P進行誘導,待重組糞腸桿菌生長至OD600 nm為1.8,培養結束)[22]。
1.2.3.2 人工啟動子文庫的初步篩選 將發酵后的48 孔深孔板于4 ℃下4000 r/min離心10 min,收集細胞沉淀,加入25 μL 0.25 mol/L醋酸鈉緩沖液(pH4.5),重懸菌體。按照順序將菌懸液轉移至96孔深孔板,加入等體積的細菌蛋白抽提試劑(B-PER Bacterial Protein Extraction Reagent),室溫放置30 min后,再加入150 μL 0.25 mol/L醋酸鈉緩沖液(pH4.5),混勻,用于植酸酶活性的高通量檢測。向實驗組中加入400 μL 1.5 mmol/L植酸鈉溶液(0.25 mol/L醋酸鈉緩沖液,pH4.5),對照組中加入400 μL顏色/終點混合液(鉬酸銨/釩酸銨/硝酸),混勻。于37 ℃反應30 min后,立即向實驗組中加入400 μL顏色/終點混合液,對照組中加入400 μL 1.5 mmol/L植酸鈉溶液,并混勻。取潔凈的酶標板加入100 μL無菌水和100 μL反應液并混勻,用酶標儀測定415 nm下的吸光值。實驗組與對照組的吸光值的差值大小反應重組糞腸桿菌中植酸酶表達量的多少。
1.2.3.3 人工啟動子文庫的復篩 從人工啟動子文庫中選取酶活較高的10個克隆子,對其進行復篩,并以未經誘導處理的轉化了重組質粒pSIP409-yiappads的重組糞腸球菌為陰性對照,以經乳酸桿菌素sakacin P誘導處理的轉化了重組質粒pSIP409-yiappads的重組糞腸球菌為陽性對照。這12個克隆子的培養和篩選分別參照“1.2.3.1”和“1.2.3.2”。
1.2.4 YiAPPA在糞腸球菌中組成型表達的組成型啟動子的鑒定 選取人工啟動子文庫中植酸酶活性較高的克隆子,設計引物P4和P5(表1)進行菌落PCR,其中PCR擴增體系和擴增條件參照“1.2.2”。并將獲得的DNA片段送至上海生工生物工程股份有限公司進行測序,確定每個克隆子所對應的啟動子序列。
1.2.5 YiAPPA在糞腸球菌中的組成型表達和純化 接種重組糞腸桿菌單克隆到含10 μg/mL紅霉素的MRS液體培養基中,用250 mL三角瓶進行培養,其中培養基的裝液量為100 mL,于37 ℃靜置培養,培養時間為24 h。然后轉接該培養物于新鮮含10 μg/mL紅霉素的MRS液體培養基中,用250 mL三角瓶進行培養,其中培養基的裝液量為100 mL,接種量為3%,于37 ℃靜置培養,培養時間為36 h。
待培養結束后,于4 ℃下8000 r/min離心5 min收集菌體沉淀,采用0.25 mol/L醋酸鈉緩沖液(pH4.5)重懸并洗滌菌體沉淀,再加入適量0.25 mol/L醋酸鈉緩沖液(pH4.5)重懸菌體沉淀,置于冰上用超聲波破碎細胞。超聲波細胞破碎儀的參數設置如下:超聲波功率為250 W,超聲波破碎時間為3 s,間歇6 s。超聲波處理菌體細胞至菌體懸液變為均一的溶液,采用SDS-PAGE檢測重組蛋白質的表達情況。掃描已脫色的凝膠,采用軟件Image J 1.38×對凝膠上目標蛋白條帶進行灰度積分,以此估算目標蛋白質占細胞總蛋白中的比例。
采用Ni2+親和層析柱對細胞可溶成分中目的蛋白質進行純化,用250 mmol/L咪唑洗脫緩沖液洗脫,即得到純化后的重組酶。利用SDS-PAGE檢測重組酶的純度,并采用Bradford法[23]測定重組酶的濃度。

圖1 糞腸球菌16S rRNA啟動子序列比對Fig.1 Alignment of 16S rRNA promoters from Entercoccus faecalis圖2 人工啟動子文庫構建示意圖Fig.2 Construction of the synthetic promoter library
1.2.6 分子克隆技術和表達產物的聚丙烯酰胺凝膠電泳(Sodium dodecyl sulphate-polyacrylamide gel electrophoresis,SDS-PAGE)分析 分子克隆技術和表達產物的SDS-PAGE分析參照文獻[24]進行。
1.2.7 YiAPPA的酶學性質分析 YiAPPA的酶學性質分析參考文獻[25]。
1.2.7.1 植酸酶的最適反應pH測定 將酶液于不同pH(1.0~8.0)條件下測定植酸酶活性,將所測得的最高酶活力定義為100%,然后以相對酶活對pH作圖。所使用的緩沖液如下:0.25 mol/L甘氨酸-鹽酸緩沖液,pH1.0~3.5;0.25 mol/L醋酸鈉-醋酸緩沖液,pH3.5~6.0;0.25 mol/L Tris-鹽酸緩沖液,pH6.0~8.5。
1.2.7.2 植酸酶的pH穩定性測定 將酶液用不同pH(1.0~12.0)緩沖液稀釋,使其在不同pH條件下于37 ℃處理2 h,然后用最適pH緩沖液稀釋,并根據如上反應體系測定樣品的酶活力,將所測得的最高酶活力定義為100%,然后以相對酶活對pH作圖。所使用的緩沖液如下:0.25 mol/L甘氨酸-鹽酸緩沖液,pH1.0~3.5;0.25 mol/L醋酸鈉-醋酸緩沖液,pH3.5~6.0;0.25 mol/L Tris-鹽酸緩沖液,pH6.0~8.5;0.25 mol/L甘氨酸-氫氧化鈉緩沖液,pH8.5~12.0。
1.2.7.3 植酸酶的最適反應溫度測定 按照如上反應體系,分別于30~90 ℃反應30 min,測定不同溫度條件下樣品的酶活力,并以酶活力對溫度作圖,確定其最適反應溫度。
1.2.7.4 植酸酶的熱穩定性測定 取250 μL酶液于離心管中,加入750 μL 0.25 mol/L醋酸鈉緩沖液(pH4.5),混勻。酶液于80 ℃保溫0~40 min后,根據如上反應體系測定樣品的酶比活力,將所測得的最高酶比活力定義為100%,并以相對酶活對時間作圖。
1.2.7.5 植酸酶的酶活力測定 取250 μL酶液于離心管中,加入750 μL 0.25 mol/L醋酸鈉緩沖液(pH4.5),混勻。向實驗組管中加入2 mL 1.5 mmol/L 植酸鈉溶液(0.25 mol/L醋酸鈉緩沖液,pH4.5),對照組中加入2 mL顏色/終點混合液(鉬酸銨/釩酸銨/硝酸),搖勻。于37 ℃反應30 min后,立即向實驗組中加入2 mL顏色/終點混合液,對照組中加入2 mL 1.5 mmol/L植酸鈉溶液,并混勻,于415 nm處測定光吸收值。植酸酶活力單位(U)定義為:在37 ℃、pH4.5的條件下,每分鐘從1.5 mmol/L植酸鈉溶液中釋放出1 μmol/L無機磷所需要的植酸酶量為一個酶活力單位(U)。
1.3 數據處理

2 結果與分析
2.1 人工啟動子文庫的構建
本研究首先從NCBI查詢得到糞腸球菌中16S rRNA的啟動子序列,包括Ef16SA-1、Ef16SA-2、Ef16SB-1、Ef16SB-2、Ef16SC-1、Ef16SC-2、Ef16SD-1和Ef16SD-2。并采用DNAMAN軟件對這些序列進行比對分析,找出其中保守序列和非保守序列,結果如圖1所示。將啟動子序列中保守序列保持不變,將非保守序列設計為隨機化序列,設計人工啟動子文庫構建引物P3。以誘導型大腸桿菌-乳酸菌穿梭表達載體pSIP409為基礎框架,利用pSIP409中酶切位點構建植酸酶YiAPPA在糞腸球菌EXW27中組成型表達的人工啟動子文庫。
2.2 人工啟動子文庫的篩選與鑒定
本研究構建植酸酶YiAPPA在糞腸球菌EXW27中組成型表達的人工啟動子文庫,共獲得318個克隆子,對這318個克隆子進行胞內植酸酶活性檢測,實現人工啟動子文庫的初步篩選。從以上318個克隆子選取其中酶活較高的10個克隆子,對其進行復篩,并以未經誘導處理的轉化了重組質粒pSIP409-yiappads的重組糞腸球菌為陰性對照,以經乳酸桿菌素sakacin P誘導處理的轉化了重組質粒pSIP409-yiappads的重組糞腸球菌為陽性對照。這12個克隆子的胞內植酸酶活性檢測結果如圖3所示,此外以上克隆子的胞內可溶性成分的SDS-PAGE檢測結果如圖4所示。由圖3和圖4可知,本研究所獲得的組成型人工啟動子均能有效控制植酸酶YiAPPA在糞腸球菌EXW27中表達。其中,10號克隆子具有最高的植酸酶活性,其胞內可溶性成分以植酸鈉為底物時所測得的415 nm下的吸光值最高。并且10號克隆子的胞內植酸酶表達量最高,10號克隆子中重組YiAPPA的表達量約占細胞內蛋白總量的15%,約為經乳酸桿菌素sakacin P誘導的重組YiAPPA表達量的94%。
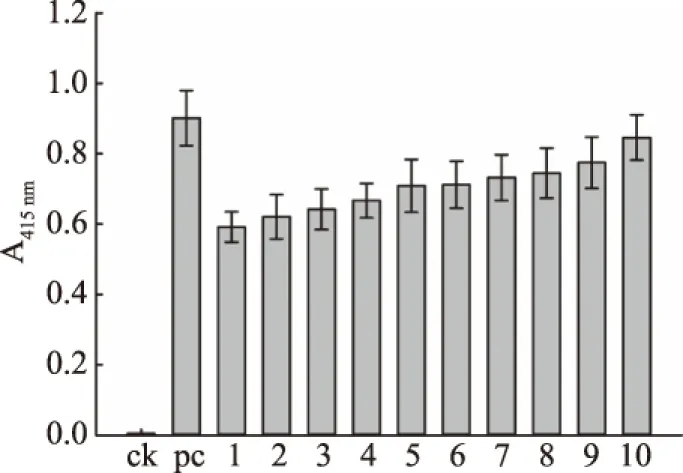
圖3 人工啟動子文庫的植酸酶活性分析Fig.3 Phytase activity analysis of synthetic promoter library注:ck:未經誘導處理的轉化了重組質粒pSIP409-yiappads的重組糞腸球菌;pc:經乳酸桿菌素sakacin P誘導處理的轉化了重組質粒pSIP409-yiappads的重組糞腸球菌;1~10分別表示1~10號克隆子。

圖4 重組植酸酶YiAPPA在糞腸球菌EXW27中表達的SDS-PAGE分析Fig.4 SDS-PAGE analysis of expression ofrecombinant phytase YiAPPA in Entercoccus faecalis EXW27注:M:蛋白質Marker;ck:未經誘導處理的轉化了重組質粒pSIP409-yiappads的重組糞腸球菌的胞內可溶成分;pc:經乳酸桿菌素sakacin P誘導處理的轉化了重組質粒pSIP409-yiappads的重組糞腸球菌的胞內可溶成分;1~10分別表示1~10號克隆子的胞內可溶成分;圖中箭頭標示為目的蛋白。
采用引物P4和P5對以上10個克隆子進行菌落PCR,并將獲得的DNA片段送至上海生工生物工程股份有限公司進行測序,確定每個克隆子所對應的啟動子序列,結果如圖5所示。在篩選得到的10個啟動子中,除了啟動子p2對應為Ef16SA-1,啟動子p5對應為Ef16SD-2,啟動子p9對應為Ef16SC-1外,其他7個啟動子均為人工啟動子。根據以上結果,啟動子p10控制YiAPPA在糞腸球菌EXW27中組成型表達的效率最高,選定啟動子p10為控制YiAPPA在糞腸球菌EXW27中組成型表達的啟動子。
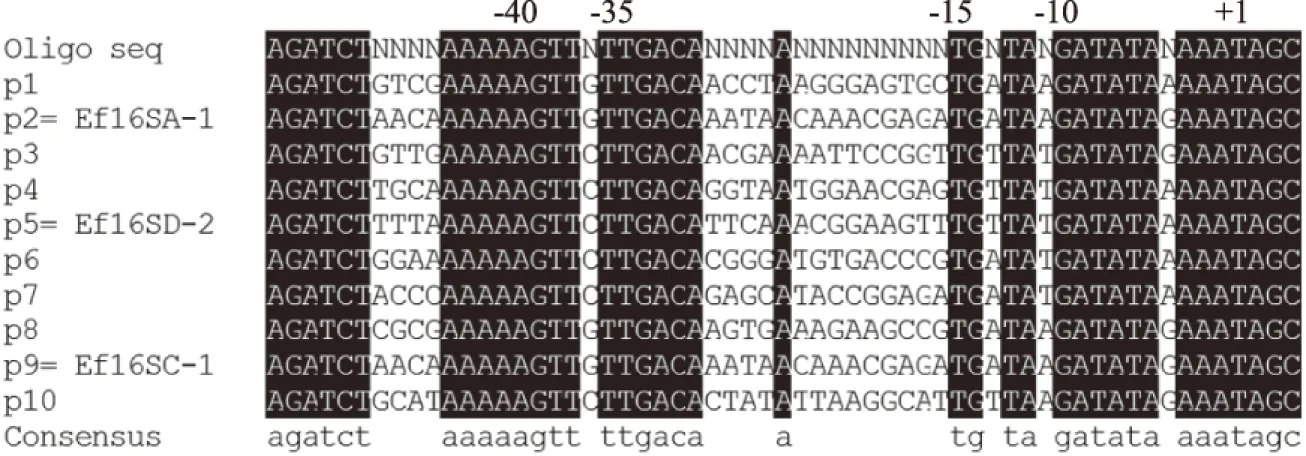
圖5 人工啟動子的序列比對Fig.5 Alignment of synthetic promoters
2.3 重組YiAPPA在糞腸球菌中的表達與純化
待發酵結束后,采用超聲波處理菌體細胞,并采用Ni2+親和層析柱對細胞可溶成分中目的蛋白質進行純化,用200 mmol/L咪唑洗脫緩沖液洗脫,即得到純化后的重組植酸酶YiAPPA。
重組植酸酶YiAPPA在糞腸球菌EXW27中的組成型表達及純化的SDS-PAGE檢測分析結果如圖6所示。重組YiAPPA的分子量約為45 kDa,與理論值基本一致。

圖6 重組YiAPPA在糞腸球菌EXW27中表達及純化的SDS-PAGE分析Fig.6 SDS-PAGE analysis of expression and purification ofrecombinant YiAPPA in Entercoccus faecalis EXW27注;M:蛋白質Marker;ck:未經誘導處理的轉化了重組質粒pSIP409-yiappads的重組糞腸球菌的胞內可溶成分;pc:經乳酸桿菌素sakacin P誘導處理的轉化了重組質粒pSIP409-yiappads的重組糞腸球菌的胞內可溶成分;10:10號克隆子的胞內可溶成分;YiAPPA:經Ni2+親和層析柱純化后的重組YiAPPA。圖中箭頭標示為目的蛋白。
2.4 重組YiAPPA的酶學性質研究
2.4.1 pH對重組YiAPPA相對酶活的影響 將酶液于不同pH(1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0)條件下,測定pH對重組YiAPPA相對酶活的影響,結果如圖7所示。重組植酸酶YiAPPA的最適反應pH為4.5,并且重組植酸酶YiAPPA在pH2.0~6.0范圍內具有50%以上相對酶活。野生型YiAPPA的最適反應pH為4.5,并于pH2.0~5.5條件下具有50%以上的相對酶活[10,26]。本研究中重組糞腸球菌表達的重組YiAPPA和野生型YiAPPA的最適反應pH以及在不同pH條件下的相對酶活基本一致。

圖7 pH對酶活的影響Fig.7 pH dependence of phytase activity
2.4.2 pH對重組YiAPPA穩定性的影響 重組植酸酶YiAPPA的pH穩定性如圖8所示,其在pH1.0~3.0范圍內具有80%以上的相對酶活;在pH4.0~10.0范圍內具有90%以上的相對酶活。野生型YiAPPA于pH1.0~8.0條件下具有80%以上的穩定性[10,26]。重組YiAPPA與野生型YiAPPA的pH穩定性基本一致。
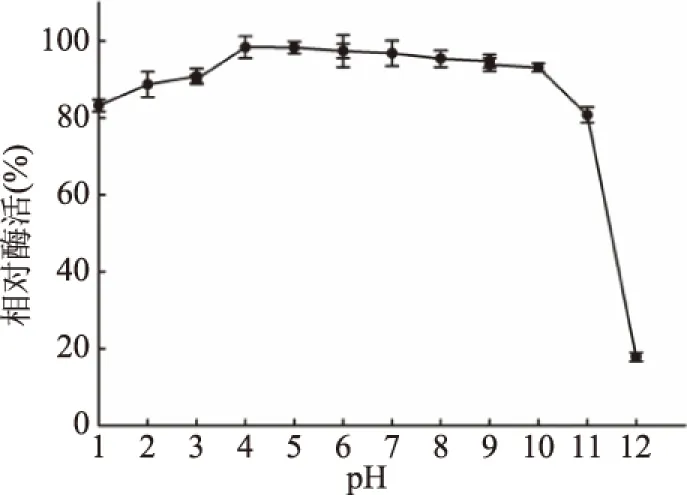
圖8 pH對酶穩定性的影響Fig.8 pH stability of phytase activity
2.4.3 溫度對重組YiAPPA酶比活力和穩定性的影響 按照植酸酶的酶比活力測定方法,于30~90 ℃下測定重組YiAPPA的酶比活力,以樣品的絕對酶活對溫度作圖,結果如圖9所示。重組植酸酶YiAPPA的最適反應溫度為55 ℃,并且重組植酸酶YiAPPA于55 ℃的絕對酶活高達3900 U/mg。將重組植酸酶YiAPPA于80 ℃分別保溫不同時間,測定其相對酶活,分析其熱穩定性,結果如圖10所示。在80 ℃下,重組植酸酶YiAPPA于80 ℃的半衰期約為15 min。重組YiAPPA于不同溫度下的酶比活力以及于80 ℃的半衰期與野生型YiAPPA[10,26]基本一致。
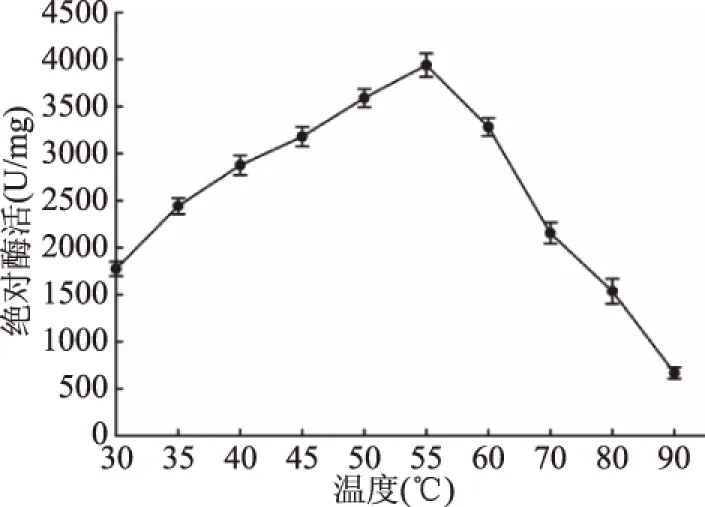
圖9 溫度對酶活的影響Fig.9 Temperature dependence of phytase activity

圖10 80 ℃重組YiAPPA的熱穩定性Fig.10 Thermal stability of recombinant YiAPPA at 80 ℃
3 結論
本研究首先對比分析了糞腸球菌16S rRNA的啟動子序列,然后以誘導型大腸桿菌-乳酸菌穿梭載體pSIP409為基礎框架,并結合糞腸球菌16S rRNA的啟動子序列特征和pSIP409中酶切位點設計構建人工啟動子文庫的相關引物,最后基于PCR引物和啟動子序列中非保守序列的隨機化設計構建人工啟動子文庫。通過對人工啟動子文庫的高通量篩選,獲得了控制植酸酶YiAPPA在糞腸球菌EXW27中高效組成型表達的組成型啟動子p10。重組植酸酶YiAPPA在糞腸球菌EXW27中成功表達,其最適反應pH為4.5,在pH2.0~6.0范圍內具有50%以上相對酶活,最適反應溫度為55 ℃,絕對酶活高達3900 U/mg,于80 ℃的半衰期約為15 min。

