妊娠期糖尿病患者孕晚期腸道菌群的變化
許雅娟,張 淼,張婧喆,孫宗宗,班彥杰,王 彪,侯曉峰,蔡琰鈞,李晶晶
鄭州大學第三附屬醫院產科 鄭州 450052
妊娠期糖尿病(gestational diabetes mellitus,GDM)指妊娠期發生的糖代謝異常,可導致妊娠期羊水過多、巨大兒、胎兒生長受限、流產、早產、胎兒窘迫、胎兒畸形等,對母嬰結局影響深遠[1]。腸道菌群是腸道中存在的數量龐大的菌類,參與內分泌系統、免疫系統等的發育和成熟[2-4]。近年來,研究腸道菌群的相關技術日益成熟,其中最常用的是16S rRNA測序技術,qRT-PCR也因其快速、簡便的優點備受青睞。研究[5]表明2型糖尿病患者均有中等程度的腸道菌群紊亂,且表現出產丁酸細菌種類的缺乏。 也有研究[6]指出腸道菌群一旦失衡,可引起肥胖和糖尿病等代謝性疾病。近年來,越來越多的報道[7]指出,GDM與腸道菌群關系密切。我們采用16S rRNA測序技術探求GDM患者孕晚期腸道菌群特征,并使用qRT-PCR技術進一步驗證。
1 對象與方法
1.1研究對象選擇2018年1月至2019年3月于鄭州大學第三附屬醫院圍保的GDM孕婦(n=33)和健康對照孕婦(n=30)。GDM診斷標準[8]:服糖前及服糖后1、2 h血糖值應分別低于5.1、10.0、8.5 mmol/L,任何一項血糖值達到或超過上述標準。對照組口服葡萄糖耐量試驗值均正常且無產科疾病。兩組的所有孕婦均處于孕晚期并在鄭州大學第三附屬醫院經剖宮產分娩。排除標準:①年齡<18歲。②多胎妊娠及胎兒死亡。③人工受孕。④妊娠前糖尿病和多囊卵巢綜合征。⑤發生嚴重的壓力、焦慮和抑郁事件。⑥接受過腸道手術。⑦過去兩周使用了抗腹瀉藥物、益生菌和抗生素。⑧既往長期或近期具有腹脹、腹瀉、便秘等胃腸道不適。⑨大便常規異常。研究對象均自愿簽署知情同意書。
1.2標本收集用無菌勺收集新鮮糞便樣本,置于2.0 mL無菌管中,2 h內-80 ℃液氮冷凍。
1.3DNA提取及16S rRNA基因測序由武漢華大基因測序中心進行DNA提取和16S rRNA基因測序。采用打珠法從標本中提取總DNA,設計16S rRNA基因PCR引物,以總DNA為模板,擴增16S rRNA v3~v4高變區。隨后,使用Illumina Hiseq 2500 PE250協議進行靶向擴增子測序。使用軟件Flash[9]合并原始對端序列,并用標簽分割,最小重疊15 bp,允許不匹配率<0.1。在默認設置下,usearch(v7.0.1090)[10]用于將每個讀取值聚集到OTU(操作分類單元)中,并通過與參考數據庫比對,進行分類注釋。
1.4菌群群落多樣性及分類特征分析通過與數據庫比對,對OTU進行物種分類并針對每個樣品菌群門分類水平作物種概述柱狀圖。測量α多樣性(每個樣本的物種多樣性),通過chao指數、ace指數、shannon指數以及simpson指數[11]對比兩組α多樣性的差異。β多樣性(樣本之間的總體差異)使用Weighted UniFrac的單分式距離矩陣[3]測量,并通過非度量多維標度(NMDS)方法進行可視化。利用Lefse選擇與GDM相關的菌群特征,并用于在高維數據中發現生物標志物和揭示基因組特征。
1.5腸道γ-變形桿菌DNA的qRT-PCR檢測γ-變形桿菌的引物來源于Yang等[12]。PCR反應體系50 μL:H2O 22 μL,2×buffer 25 μL, 上、下游引物各1 μL,模板DNA 1 μL。產物經瓊脂糖凝膠電泳后切膠回收,與T載體連接,轉化到大腸桿菌感受態細胞,構成重組菌,PCR法鑒定重組菌,使用Qiagen質粒提取試劑盒提取質粒,使用NanoDrop測定質粒濃度。以所提取的質粒10倍系列稀釋制作標準曲線(橫坐標代表拷貝數,縱坐標代表CT值)。用稀釋后的重組質粒作為模板,進行qRT-PCR擴增。引物序列:γ877-F:5’-GCTAACGCATTAAGTRYCCCG-3’;γ1066-R:5’-GCCATGCRGCACCTGTCT-3’,產物大小189 bp。反應體系16 μL:H2O 6.6 μL,2×PCR Mix(Qiagen) 8 μL, 上、下游引物各0.2 μL,模板DNA 1 μL。反應條件: 95 ℃預變性2 min;94 ℃變性10 s, 60 ℃變性10 s, 72 ℃退火40 s,40個循環。反應在ABI ViiA 7 PCR儀進行,每個標本做3次平行實驗。
1.6統計學處理采用SPSS 24.0分析。兩組孕婦一般臨床資料的比較采用兩獨立樣本的t檢驗、χ2檢驗或精確概率法。檢驗水準α=0.05。
2 結果
2.1兩組孕婦一般臨床資料的比較見表1。兩組孕婦年齡、孕前BMI、孕期增重、孕次、產次、孕周等差異均無統計學意義。
2.216S rRNA測序結果選擇50 000個高質量16S rRNA擴增子序列進行分析,2個GDM患者因糞便DNA含量低被排除。由物種注釋分析圖(圖1)可見,GDM組優勢門包括變形菌門、厚壁菌門、擬桿菌門和放線菌門。由圖2可見兩組α多樣性(左)和β多樣性(右)差異均無統計學意義。Lefse分析(圖3)顯示,GDM組中γ-變形桿菌明顯增多。
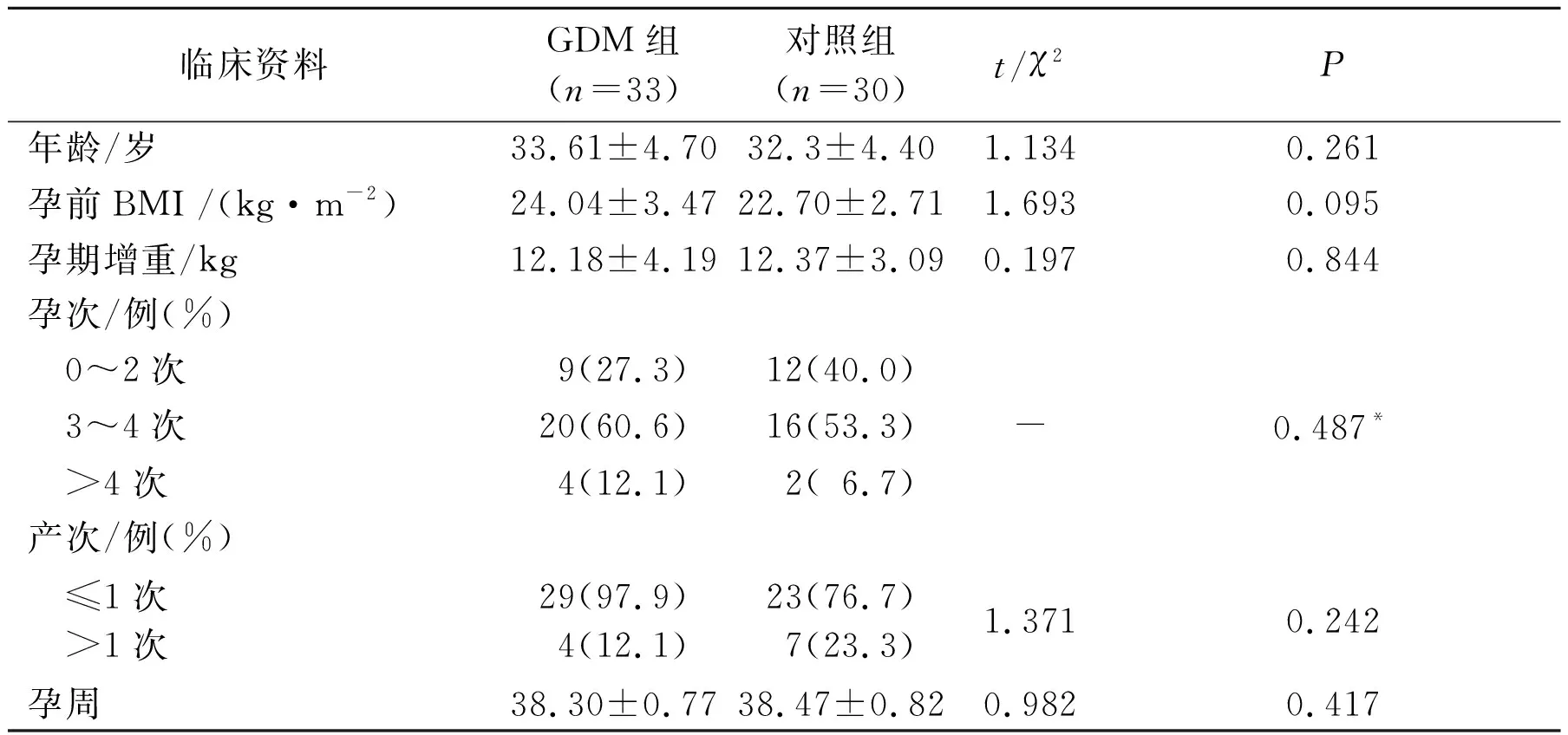
表1 兩組孕婦一般臨床資料的比較
*:精確概率法
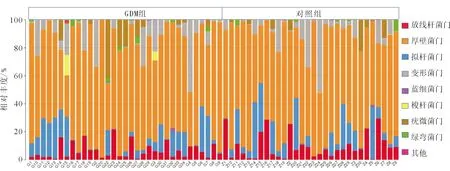
圖1 門分類水平中物種概述柱狀圖
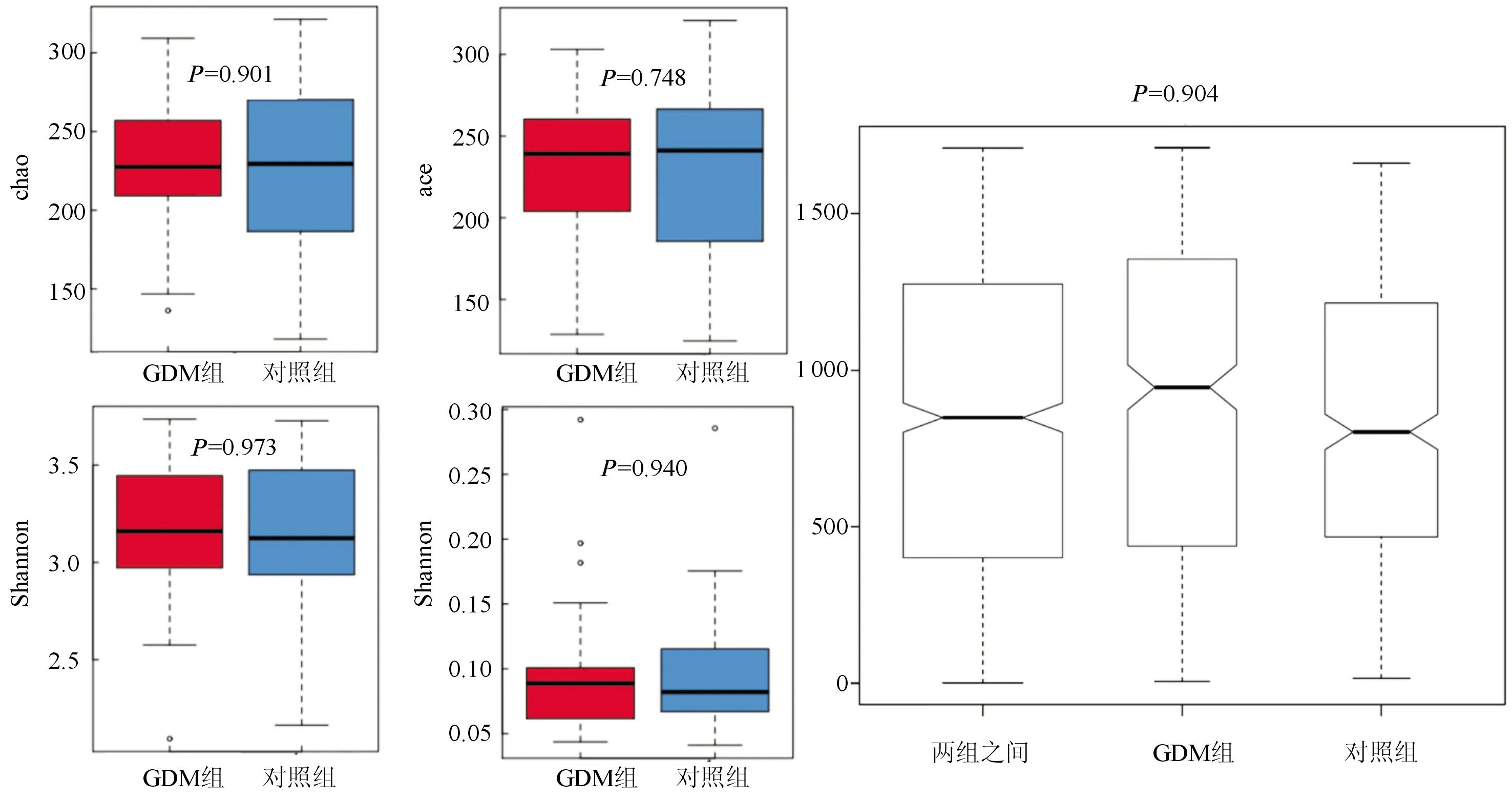
圖2 α多樣性(左)及β多樣性(右)分析
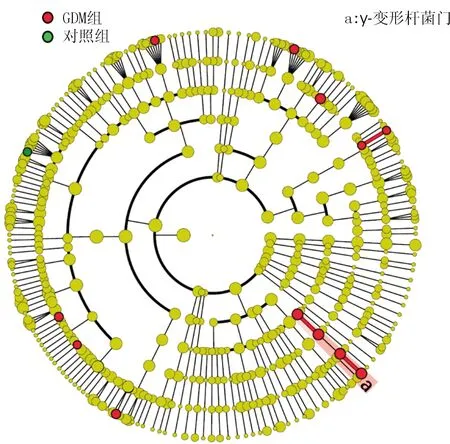
圖3 Lefse分析
2.3兩組腸道γ-變形桿菌DNA的qRT-PCR檢測結果GDM組腸道γ-變性桿菌DNA的CT值為31.790±2.340,高于對照組的9.890±2.290(t=16.367,P<0.001)。
3 討論
近年來,腸道菌群的研究成為各個領域的熱點。有研究[7,13-14]表明腸道菌群可能通過影響炎癥反應、促進脂肪儲存等引起胰島素抵抗,因此,調節腸道免疫系統可能是一種治療全身炎癥的新方法。
Mie等[7]的研究結果表明GDM組腸道菌群中門水平的放線菌和屬水平的柯林斯氏菌、羅氏菌和脫硫弧菌的豐度較高。Hasan等[15]研究卻發現GDM組和對照組的腸道菌群組成差異無統計學意義。我們的研究結果表明,GDM患者的腸道菌群中變形菌門、厚壁菌門、擬桿菌門和放線菌門比例明顯升高,其中γ-變形桿菌升高最為顯著。GDM組與對照組的α多樣性及β多樣性差異無統計學意義。GDM是一種多因素疾病,懷孕期間菌群的動態變化、研究人群之間的遺傳和表型差異以及實驗性誤差、樣本量不足等都可導致結果的差異。
有研究[16]發現γ-變形桿菌與炎癥反應及胰島素抵抗密切相關。我們也通過16S rRNA測序,利用Lefse分析方法發現了GDM與γ-變形桿菌的關聯,為GDM的診療打開了新的思路。
綜上所述,GDM患者孕晚期腸道γ-變形桿菌的增加可能成為監測GDM狀態的非侵入性生物標志物。然而目前對于腸道菌群與GDM之間的機制研究較少,可進一步從脂代謝等方面進行深入研究。此外,通過調節腸道菌群可能對GDM的防治產生深遠影響。

