原發性盆腔孤立性纖維性腫瘤1 例報告并文獻復習*
歐龍華 魏正茂 李維清 王 燕 周穎琛 梅紅兵 史本濤**
1.深圳市第二人民醫院(深圳大學第一附屬醫院)泌尿外科(深圳518035)2.北京大學深圳醫院泌尿外科; 3.新疆克拉瑪依市中心醫院4.中國醫學科學院阜外醫院深圳醫院泌尿外科
孤立性纖維性腫瘤 (SFT) 是一種罕見的起源于CD34 陽性的樹突狀間葉細胞腫瘤, 具有分化潛能,多數為良性,少數為惡性[1],原發于盆腔的SFT 較為罕見,術前診斷困難,2018 年12 月深圳市第二人民醫院泌尿外科收治1 例原發性盆腔SFT 患者,現報道如下。
一、病例資料
患者,男,35歲,因“發現PSA 升高11 天”于2018年12 月25 日就診于深圳市第二人民醫院, 患者無發熱,無尿頻、尿急、尿痛及肉眼血尿,無腰部脹痛。 既往無特殊病史。 體格檢查:直腸指檢:直腸右側壁可及一腫物頂起,未能觸及上界,表面光滑,質地韌,無觸痛。輔 助 檢 查:TPSA 6.61ng/ml↑,CPSA5.93ng/ml,FPSA/TPSA 0.1↓,入院影像學檢查:盆腔MR 增強提示前列腺右側外周帶旁見一大小約48×50mm 類圓形腫塊,邊界清楚,有包膜,與前列腺分界清楚,信號欠均勻,增強掃描漸進性強化,考慮腫瘤性病變,良性- 中間型可能。 盆腔CT 平掃+增強:前列腺右側旁見軟組織密度影,密度欠均勻,病灶內未見明顯血管走行,增強掃描病灶明顯持續強化; 膀胱及前列腺未見異常強化灶及占位性病變(圖1)。術前穿刺病理:(右側葉結節第11、13、14 針穿刺活檢組織) 結合組織形態學及免疫組化結果提示孤立性纖維性腫瘤。 患者于2019 年1 月25日在全身麻醉下行陰腹聯合腹腔鏡下盆腔腫物切除術, 術中見腫物位于前列腺右側葉旁, 大小約5X5X5cm,腫瘤表面血管豐富,腫瘤緊貼前列腺,與前列腺、 盆底肌及直腸壁周圍粘連, 完整切除腫瘤后送檢,標本肉眼觀:腫物有包膜,切面灰黃灰白、質中。 組織形態學:形細胞增生,細胞呈波浪狀、席紋狀或束狀排列, 核呈梭形或卵圓形 (圖2A)。 免疫組化病理:STAT6(+),CD34(+),Ki67(+,<2%),CD99(+),bcl-2(+),CK(-),SMA(-),S-100(-),AR(散在+),CD117(-),DOG1(-)(圖2B,圖2C,圖2D),(盆腔腫物)確診孤立性纖維性腫瘤。患者術后恢復良好,術后第11 天出院。隨訪至今,未見復發及轉移。
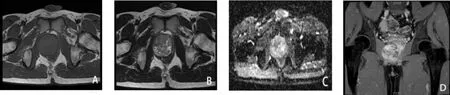
圖1 盆腔增強MRI 影像
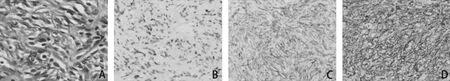
圖2 盆腔孤立性纖維性腫瘤病理學表現
二、討論
SFT 是一種罕見的間葉源性腫瘤, 最初由Klemperer[2]等于1931 年報道,雖然SFT 常發生于胸膜,但根據文獻報道, 大約50%~70%的SFT 起源于胸膜外,如頭部、頸部、腹部和骨盆[3],大多數SFTs 的生物學行為呈良性或交界性,惡性孤立性纖維性腫瘤罕見。 SFT 可發生于任何年齡,多發生于20~70歲的成年人,差異無統計學意義。
(一)發病機制
SFT 的發病機制還不清楚。 目前研究發現,SFT 中多有染色體異常,包括數量和結構異常[4],在SFT 中經常觀察到著絲粒倒位引起染色體12q13 上的染色體內重排[5-6]。 這種重排影響相鄰的和部分重疊的NAB2 基因和STAT6 基因在框架內相互并列, 產生NAB2-STAT6 融合基因[6]。 NAB2 是轉化生長因子β(TGFβ)的重要調節劑,而STAT6(信號轉導和轉錄激活劑)則是通過白介素4 和白介素13 調節信號傳導的轉錄因子。 遺傳融合可以發生在不同的斷點,并且不同的融合類型可能與SFT 的不同臨床病理亞群有關[7]。 另外,有研究表明, 小部分患者會出現副腫瘤性低血糖綜合征(Doegge-Potter 綜合征), 這可能與前激素形式的IGF2(胰島素樣生長因子II)的過度釋放有關[8]。Hajdu 等人發現IGF2 和IR-A 在SFT 的解剖部位有過表達現象[9],IGF2 是一種蛋白質激素,與胰島素有相似之處,通過與IR-A 結合發揮其生物學功能, 這種基因異常表達并不是由于基因擴增, 而似乎與基因標記丟失等表觀遺傳機制有關[10]。
(二)臨床表現
胸膜外SFT 的臨床癥狀由于發生部位不同而各異,多數胸膜外SFT 表現為生長緩慢的無痛性腫塊,早期無明顯臨床癥狀,男女發病機率相似,但是發生在肝臟或者腹壁上的SFT 多見于女性,常見癥狀包括疼痛、可觸及的腫塊、神經或血管癥狀。 發生在腹部和盆腔的SFT 隨著腫瘤的增大,可出現相應部位的壓迫癥狀,如尿路梗阻或尿潴留、腸梗阻、便秘或腹脹[11]。還有少部分患者(5%)表現為低血糖[12]。 與SFT 相關的其他全身癥狀還有杵狀指、肥大性骨關節病和關節痛[13,14]。
(三)診斷方法
影像學檢查對SFT 的診斷和鑒別診斷具有重要價值。 超聲檢查常作為首診篩查手段,一般表現為低回聲或中低回聲, 與鄰近組織界限分明, 同時還可以動態觀察腫瘤的位置變化[15],CT 和MRI 檢查,互為補充,更準確提示腫瘤的部位、大小、形態、與周圍組織關系等情況。 CT 表現為邊界清楚、圓形或者橢圓形、血管豐富的腫塊,可對鄰近的器官如腸管、血管、膀胱和輸尿管造成壓迫或移位。 腫瘤可見中央低強化區或非強化區,表現為壞死或囊性改變。 鈣化是罕見的,但是可以在大的良性或惡性腫瘤中看到[16,17]。MRI 檢查,SFT 在T1WI 中表現為等信號強度,在T2WI 加權像上表現為非均勻的低信號強度。 T1WI 和T2WI 上的低信號強度病灶的存在主要是由于密集的膠原和纖維化成分、 低細胞性以及相關的質子遷移率降低。 此外,高纖維含量的病變可能在動脈期和門脈期表現為漸進性增強, 并在延遲圖像上顯示[18]。這些影像學特征的鑒別診斷包括其他高血管性腫瘤或以纖維成分為主的腫瘤,如平滑肌肉瘤、神經源性腫瘤、嗜鉻細胞瘤、淋巴瘤、硬纖維瘤、惡性纖維組織細胞瘤、間皮瘤和纖維瘤。 僅使用影像學檢查,不能準確區分這些腫瘤。 最終確診需要結合病理組織學特點和免疫組化結果。
典型的SFT 在大體上為邊界清楚的分葉狀質韌腫塊,切面淡褐色至灰白色,均質狀, 可見出血和壞死區域, 腫瘤大小千差萬別,從1 厘米到20 厘米不等[19],惡性SFT 與良性SFT 難以區分,惡性SFT 常顯示更不規則的切面,有壞死區或鄰近組織浸潤的跡象。 光鏡下特點:SFT 細胞多為無異型性的卵圓形或短梭形,細胞界限不清,間質可能呈現不同程度的粘液樣改變,核空泡狀,染色質散在分布,能看見大的分支或“鹿角形”的薄壁血管, 中等大小的血管伴有不同的血管周圍玻璃化也是常見的特征,惡性SFT 通常以浸潤邊緣、多形性、細胞增生、壞死、核分裂大于4/10 高倍視野為特征[20]。免疫組織化學上,SFT 通常表現為STAT6、CD34、bcl2和CD99 的彌漫性強表達,其中,STAT6 診斷SFT 的敏感度和特異度分別為91%和75%[21], 而bcl2 是SFT 最敏感的標記物之一, 在SFT 中bcl2 的強表達有助于鑒別診斷[22-23]。
(四)治療方案
治療首選手術完整切除[24],視周圍是否有臟器和血管侵犯可一并行聯合臟器切除, 這是防止術后復發的關鍵,手術完整切除的5 年生存率接近100%[25]。
通過查閱文獻發現,報道的病例中,治療盆腔SFT均采取腹部開放性手術,Yokoyama[26]等診治一例盆腔SFT 時,術前行2 次血管栓塞,再行開腹手術,術中總出血量440ml;Sueblinvong[27]等報道了5 例盆腔SFT 分析,5 例患者均行開腹探查;2013 年高杰[28]等報道了9例盆腔SFT 診斷與治療,9 例患者均行開腹探查,手術平均用時6 h 29 min,平均出血量2 033 mL。 2017 年張彤[29]等報道了5 例盆腔SFT 分析,5 例患者均行開放盆腔腫瘤切除術,手術時問120~480 min,平均280 min。術中出血量400~2000 mL,平均1200 mL。
本病例中, 患者接受陰腹聯合腹腔鏡下盆腔腫物切除術, 取臍下腹正中切口長約5cm 建立氣腹并放置腹腔鏡,臍下兩橫指,腹直肌左側和右側做穿刺孔放置操作器械, 術中見腫瘤表面血管豐富, 腫瘤緊貼前列腺,與前列腺,盆底肌,直腸周圍粘連,腫瘤后方粘連嚴重。 取會陰部奔馳切口,依次切開皮膚,肉膜,打開球海綿體肌,游離尿道,將腫塊朝盆腔內頂入以協助腹腔鏡手術,另以手指伸入直腸引導腹腔鏡下手術。 以雙極電凝將腫瘤表面血管充分凝固, 緊貼腫瘤包面表面完整切除腫瘤,手術用時90min,術中出血300mL。我們使用腹腔鏡技術完整切除腫瘤,在國內外報道中尚屬首例,與傳統腹部開放手術相比,手術時間大大縮短,術中出血少,術后患者恢復快,未見手術并發癥。
SFT 術后不需要常規的放射治療或輔助化療[30]。但是近年來有學者提出在外科手術后增加放射治療,可以增強對腫瘤生長的局部控制,降低復發率[31]。 分子靶向治療是治療不能切除或轉移的SFT 的一種很有前途的方法,目前正在研究針對IGF 信號通路和Akt/mTOR通路的靶向藥物[32]。
四、結論
盆腔SFT 是一類臨床上較為少見的腫瘤, 其臨床特征和影像學表現無特異性, 主要通過組織病理和免疫組化病理明確診斷。 治療首選手術完整切除腫物,根據不同患者腫瘤形態、大小、位置、血運及周圍臟器情況,可選擇腹腔鏡手術或開放手術,對于不能完整切除的惡性傾向腫瘤,可輔以術后放療或靶向治療。 只要完整切除腫瘤,大多數患者的預后良好。 由于這種腫瘤有一定的復發傾向,術后仍需密切隨訪。

