單細(xì)胞測序研究進(jìn)展及其在口腔醫(yī)學(xué)中的應(yīng)用
鄭明霞,譚俊龍,劉湘寧,2,張永彪,王曉剛
細(xì)胞作為絕大多數(shù)生物體的基本單位,擁有一套復(fù)雜而精細(xì)的生命操作系統(tǒng),既具有普遍的統(tǒng)一性,也具有獨(dú)特的異質(zhì)性。對(duì)于多細(xì)胞生物體如人體而言,從單個(gè)受精卵到構(gòu)成機(jī)體各個(gè)組織器官和系統(tǒng)的數(shù)億個(gè)細(xì)胞的胚胎發(fā)育機(jī)制以及機(jī)體從正常生理情況發(fā)展到疾病狀態(tài)經(jīng)歷了什么樣的細(xì)胞變化歷程等問題,受到了研究人員的普遍關(guān)注。但由于技術(shù)障礙,先前的研究僅基于常規(guī)大體測序(bulk sequencing),使得對(duì)細(xì)胞的研究處于群體細(xì)胞測序水平。自2009年湯富酬團(tuán)隊(duì)首次報(bào)道單細(xì)胞mRNA測序(single cell mRNA sequencing,sc-mRNA-Seq)以來[1],對(duì)單細(xì)胞的研究迅速進(jìn)入火熱階段。近年來,各種單細(xì)胞測序技術(shù)不斷涌現(xiàn),分析工具日益完善,單細(xì)胞的神秘面紗逐漸被揭開,生命科學(xué)研究得到了迅猛發(fā)展。
1 單細(xì)胞測序
1.1 單細(xì)胞測序的技術(shù)流程
單細(xì)胞測序(single-cell sequencing,SCS)的流程包括:(1)單細(xì)胞分離:用于分離多個(gè)細(xì)胞以進(jìn)行后續(xù)分析。目前單細(xì)胞分離技術(shù)主要包括熒光激活細(xì)胞分選(fluorescence-activated cell sorting,F(xiàn)ACS)[2]、顯微操作(micromanipulation)以及微流體技術(shù)(microfluidics)[3-4]。微流體技術(shù)根據(jù)基本原理又可細(xì)分為閥門(valves)、液滴(droplets)、納米孔(nanowells)三種技術(shù)。其中,閥門技術(shù)易于操控;液滴技術(shù)以高吞吐量著稱;納米孔技術(shù)勝在操作上的簡便[5]。(2)測序:包括先擴(kuò)增序列再測序的第二代測序(second generation sequencing,SGS)即下一代測序(next generation sequencing,NGS)和直接測序的第三代測序(third generation sequencing,TGS)即單分子測序(single-molecule sequencing)[6-7]。第二代測序擴(kuò)增序列的目的是增加用于檢測的序列樣本總量。全基因組擴(kuò)增(whole-genome amplification,WGA)的方法包括多重退火和基于環(huán)路的擴(kuò)增循環(huán)(multiple annealing and looping-based amplification cycles,MALBAC)[8]、基于等溫反應(yīng)的多重置換擴(kuò)增(multiple displacement amplification,MDA)和基于熱循環(huán)的簡并寡核苷酸引物聚合酶鏈?zhǔn)椒磻?yīng)(degenerate oligonucleotide primed-polymerase chain reaction,DOP-PCR)[9-14]。其中,MDA的單核苷酸變異體檢出率更高而MALBAC和DOP-PCR在測量拷貝數(shù)變異方面較佳[15-16]。全轉(zhuǎn)錄組擴(kuò)增(whole-transcriptome amplification,WTA)的方法主要有基于PCR的方法(PCR-based amplification methods)如多重(multiplexing)擴(kuò)增方法和基于體外轉(zhuǎn)錄的全轉(zhuǎn)錄組方法(invitrotranscription based WTA-methods)如使用條形碼的多重線性擴(kuò)增(multiplexed linear amplification)[17-19]。單分子測序可以消除擴(kuò)增偏差,但單分子測序存在錯(cuò)誤率高、吞吐量低及測序效率低等不足[20]。(3)數(shù)據(jù)分析:用于移除干擾信息如接頭序列(adapter)、連接序列(linker)和標(biāo)簽序列(barcodes)等,對(duì)剩余的序列信息進(jìn)行分析。常見的分析流程是通過基礎(chǔ)流程Cell Ranger將原始數(shù)據(jù)(raw base call,BCL)拆分為FASTQ文件[21-22],并生成基因表達(dá)矩陣。在下游分析中,細(xì)胞聚類常利用Seurat軟件[23];偽時(shí)間(pseudotime)分析則多采用monocle軟件[24]。在細(xì)胞聚類中,可以通過主成分分析(principal component analysis,PCA)進(jìn)行線性降維[25],再使用tSNE執(zhí)行非線性降維[26],將結(jié)果可視化。隨后尋找每個(gè)聚類中顯著表達(dá)的基因以鑒定高度變化基因。
1.2 單細(xì)胞測序的內(nèi)容
如圖1所示,單細(xì)胞測序涉及基因組、表觀組(包括DNA甲基化、染色體可及性和染色質(zhì)拓?fù)鋵W(xué)等)、轉(zhuǎn)錄組以及空間組等內(nèi)容。
1.2.1 單細(xì)胞基因組測序 人類生物學(xué)和醫(yī)學(xué)的中心問題是關(guān)于人類細(xì)胞譜系樹(human cell lineage tree)的問題,即其在發(fā)育、生長、更新、衰老以及疾病過程中的結(jié)構(gòu)、 動(dòng)力學(xué)和變異性如何的問
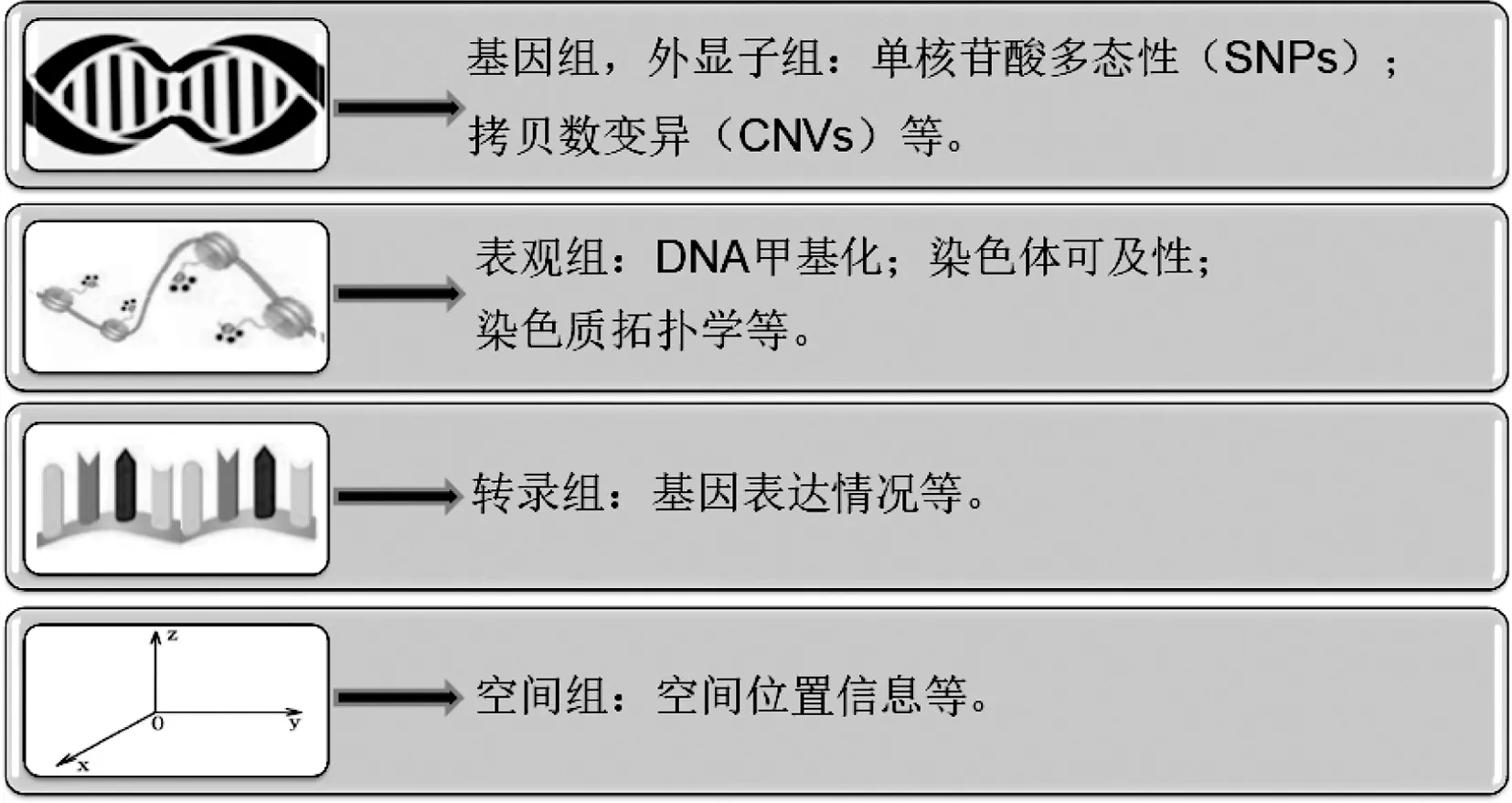
圖1 單細(xì)胞測序
題。由于細(xì)胞分裂期間DNA的非絕對(duì)精確復(fù)制,細(xì)胞便被賦予了獨(dú)特的基因組特征[27]。單細(xì)胞基因組測序既可檢測單核苷酸多態(tài)性(single nucleotide polymorphisms,SNPs)或單核苷酸變異(single nucleotide variations,SNVs),也可檢測拷貝數(shù)變異(copy number variations,CNVs)或拷貝數(shù)畸變(copy number aberrations,CNAs)以及堿基的插入和缺失(insertions and deletions,Indels)等[28],成為剖析腫瘤、神經(jīng)生物學(xué)以及發(fā)育過程中基因組異質(zhì)性的有力工具[29]。如Wang等[30]將單細(xì)胞全基因組測序(single-cell whole genome sequencing,scWGS)用于描繪精子減數(shù)分裂重組活動(dòng)的綜合景觀,揭示了精子的基因組多樣性對(duì)個(gè)體基因組編輯的影響;Navin等[31]利用單核測序(single-nucleus sequencing,SNS)對(duì)乳腺癌進(jìn)行腫瘤群體結(jié)構(gòu)和進(jìn)化研究,發(fā)現(xiàn)單克隆擴(kuò)增是原發(fā)性腫瘤的形成模式,推翻了腫瘤進(jìn)展的漸進(jìn)模型。
1.2.2 單細(xì)胞外顯子組測序 外顯子組雖然只構(gòu)成基因組的一小部分,卻有絕大多數(shù)的致病性變異發(fā)生在該區(qū)域[32],加上單細(xì)胞全外顯子組測序(single-cell whole-exome sequencing,scWES)可以降低全基因組擴(kuò)增(whole genome amplification,WGA)引起的基因座間偏差和提高堿基覆蓋率[33],因此常用于編碼序列的SNVs分析。如Hou等利用scWES進(jìn)行SNVs分析,揭示了原發(fā)性血小板增多癥和腎透明細(xì)胞癌的腫瘤內(nèi)部遺傳結(jié)構(gòu),為進(jìn)一步探索腫瘤的克隆進(jìn)化奠定了基礎(chǔ)[34-35]。
1.2.3 單細(xì)胞表觀組測序 性狀的改變除了受DNA序列改變的控制外,還受遺傳物質(zhì)修飾如DNA甲基化、組蛋白修飾和非編碼RNA調(diào)節(jié)等過程的影響。即遺傳物質(zhì)修飾也可以記載遺傳信息,用于解釋基因型與表型兩者的關(guān)系[36]。單細(xì)胞表觀組研究涉及的內(nèi)容見圖1。
一般來講,基因組DNA甲基化抑制基因的表達(dá);而非甲基化促進(jìn)基因的表達(dá)。單細(xì)胞DNA甲基化測序主要用于檢測基因組DNA中的胞嘧啶特別是CpG二聯(lián)核苷酸位點(diǎn)是否被甲基化修飾[37],可用于胚胎發(fā)育學(xué)研究,如通過對(duì)生殖細(xì)胞系進(jìn)行分析可以了解印記基因在胚胎和胎盤組織轉(zhuǎn)錄調(diào)控中的關(guān)鍵作用[38],有助于理解無性生殖失敗的原因。新近的單細(xì)胞DNA甲基化測序方法有單細(xì)胞亞硫酸氫鹽測序(single-cell bisulfite sequencing,scBS-seq)[39-40]、單核甲基胞嘧啶測序(single-nucleus methylcytosine sequencing,snmC-seq)以及單細(xì)胞組合索引甲基化分析(single-cell combinatorial indexing for methylation analysis,sci-MET)等[41-42]。
不同狀態(tài)下的細(xì)胞擁有不同的順式作用元件活性位點(diǎn)如啟動(dòng)子、絕緣子和基因座控制區(qū)等,這些位點(diǎn)具有轉(zhuǎn)錄因子可及性,是染色體調(diào)控的基礎(chǔ)。染色質(zhì)對(duì)DNase I高度敏感的活性區(qū)域稱為DNase I高敏位點(diǎn)(DNase I Hypersensitive Sites,DHS),DNase I 高敏性常用作染色體可及性的測量指標(biāo)。哺乳動(dòng)物細(xì)胞的DHS定位,能夠提供轉(zhuǎn)錄調(diào)控元件和染色質(zhì)狀態(tài)的重要信息,有助于研究順式作用元件可及性差異的轉(zhuǎn)錄因子驅(qū)動(dòng)機(jī)制。如Denny等[43]通過比較原發(fā)腫瘤和轉(zhuǎn)移灶腫瘤細(xì)胞的全基因組染色質(zhì)可及性特征,發(fā)現(xiàn)轉(zhuǎn)錄因子Nfib可通過廣泛提高染色質(zhì)可及性來促進(jìn)小細(xì)胞肺癌的轉(zhuǎn)移。單細(xì)胞DHS分析的主要研究方法包括單細(xì)胞轉(zhuǎn)座酶可及染色質(zhì)測序(single-cell assay for transposase accessible chromatin using sequencing,scATAC-seq)[44]、單細(xì)胞DNA酶測序(single-cell DNase sequencing,scDNase-seq)和低輸入 DNA酶I測序(low-input DNase I sequencing,liDNase-seq)等[45-46]。
染色質(zhì)的幾何結(jié)構(gòu)與基因表達(dá)的調(diào)控、細(xì)胞核的組織(nuclear organization)、腫瘤的拷貝數(shù)變異以及腫瘤轉(zhuǎn)移有關(guān)[47-48]。拓?fù)潢P(guān)聯(lián)域(topologically associating domains,TAD)被認(rèn)為是基因組的基本調(diào)控單位。TAD及其邊界區(qū)域?qū)τ诰S持基因的正常功能至關(guān)重要,其破壞可引起功能異常。故對(duì)TAD的研究有利于更深入地理解異常發(fā)生的機(jī)制[49]。如Lupiáez等[50]發(fā)現(xiàn)罕見的手指合并ACRPV綜合征(acropectorovertebral syndrome)是WNT6前方因倒位增加了鄰近TAD中的一組肢體增強(qiáng)子所致的疾病。目前單細(xì)胞染色質(zhì)拓?fù)鋵W(xué)的研究技術(shù)有單細(xì)胞Hi-C(single-cell Hi-C,scHi-C)[51]、單細(xì)胞組合索引Hi-C(single-cell combinatorial indexed Hi-C,sciHi-C)以及單核Hi-C(single-nucleus Hi-C,snHi-C)等[52-53]。
1.2.4 單細(xì)胞轉(zhuǎn)錄組測序 單細(xì)胞RNA測序(single cell RNA sequencing,scRNA-seq)可以用于生物學(xué)和醫(yī)學(xué)研究的多個(gè)方面,包括揭示胚胎的遺傳程序、組織的細(xì)胞組成、基因表達(dá)的動(dòng)力學(xué)和轉(zhuǎn)錄水平的差異性以及腫瘤的發(fā)展機(jī)制等[54]。如Xue等[55]通過scRNA-seq鑒定了人和小鼠早期胚胎中多態(tài)基因的階段特異性單等位基因表達(dá)模式,擴(kuò)展了對(duì)早期胚胎發(fā)育的基因激活順序、轉(zhuǎn)錄特征以及遺傳編程認(rèn)識(shí);Mahata等[56]利用Th2細(xì)胞的單細(xì)胞轉(zhuǎn)錄組學(xué)數(shù)據(jù),鑒定了可作為生成類固醇的細(xì)胞亞群的生物標(biāo)記Ly6c1/2;Shalek等[57]通過scRNA-seq分析經(jīng)LPS處理的骨髓樹突細(xì)胞,發(fā)現(xiàn)了某些基因表達(dá)和剪接的雙峰模式(bimodal pattern);Tirosh等[58]通過scRNA-seq分析早期少突膠質(zhì)細(xì)胞瘤細(xì)胞的拷貝數(shù)變異,重建了未分化癌細(xì)胞的發(fā)育程序,首次在人類腦瘤樣本中鑒定了腫瘤干細(xì)胞(cancer stem cells,CSC),證實(shí)了腫瘤干細(xì)胞模型。新近的單細(xì)胞RNA測序技術(shù)有索引液滴RNA測序(indexing droplets RNA sequencing,inDrop-seq)[59]、單細(xì)胞組合索引RNA測序(single-cell combinatorial indexing RNA sequencing,sci-RNA-seq)和基于分裂池連接的轉(zhuǎn)錄組測序(split-pool ligation-based transcriptome sequencing,SPLiT-seq)等[60-61]。
1.2.5 單細(xì)胞空間組測序 細(xì)胞的空間位置信息在譜系發(fā)育和一些腫瘤的相關(guān)研究中至關(guān)重要。如利用組織中的細(xì)胞位置信息可以跟蹤胚胎發(fā)育過程中譜系分配和分化的空間模式;對(duì)于一些腫瘤如導(dǎo)管原位癌(ductal carcinoma in situ,DCIS)和浸潤性導(dǎo)管癌(invasive ductal carcinoma,IDC),其組織病理的空間位置信息則是其分類的依據(jù)。雖然在某些情況下可以從scRNA-seq數(shù)據(jù)推斷出空間參數(shù),但這種計(jì)算推理有許多局限性,如Seurat方法依賴于原位雜交(insituhybridization,ISH)所確定的空間界標(biāo)[23],因而受ISH圖譜低分辨特性的限制。因此,諸如Tomo-seq、Geo-seq、TSCS、FISSEQ等的直接空間轉(zhuǎn)錄組研究方法被相繼研發(fā)[62-65]。如Casasent等[66]通過拓?fù)鋯渭?xì)胞測序(topographic single cell sequencing,TSCS),結(jié)合激光捕獲顯微切割(LCM)、激光彈射(laser catapulting)、全基因組擴(kuò)增(WGA)和scDNA-seq,保留單個(gè)腫瘤細(xì)胞的空間信息的同時(shí)分析拷貝數(shù)畸變(copy number aberrations,CNAs),推出了繼獨(dú)立譜系模型(independent lineage model)和進(jìn)化瓶頸模型(evolutionary bottleneck model)之后的多克隆侵襲模型(multiclonal invasion model)。
2 多組學(xué)單細(xì)胞測序
2.1 多組學(xué)單細(xì)胞測序的定義
如圖2所示,多組學(xué)單細(xì)胞測序是指將不同的組學(xué)測序聯(lián)合起來或?qū)⑼唤M學(xué)的不同層次測序聯(lián)合起來進(jìn)行分析。一方面,由于技術(shù)噪音(technical noise)和固有噪音(intrinsic noise)的存在,單一組學(xué)測序方法具有效用限制性,因此一次性測量多種細(xì)胞特性的多組學(xué)單細(xì)胞測序可以更全面地表征細(xì)胞類型及其驅(qū)動(dòng)因子[5]。另一方面,基因表達(dá)受到多個(gè)方面的調(diào)控,各個(gè)層次之間的相關(guān)性如何,是否存在起中樞作用的關(guān)鍵環(huán)節(jié),疾病相關(guān)的變化發(fā)生在哪個(gè)時(shí)期等都是亟待解決的科研瓶頸。只有找到原因,才可為臨床提供切實(shí)可靠的治療指導(dǎo)。因此,對(duì)細(xì)胞的研究就需要從單組學(xué)拓展到多個(gè)組學(xué)的聯(lián)合。
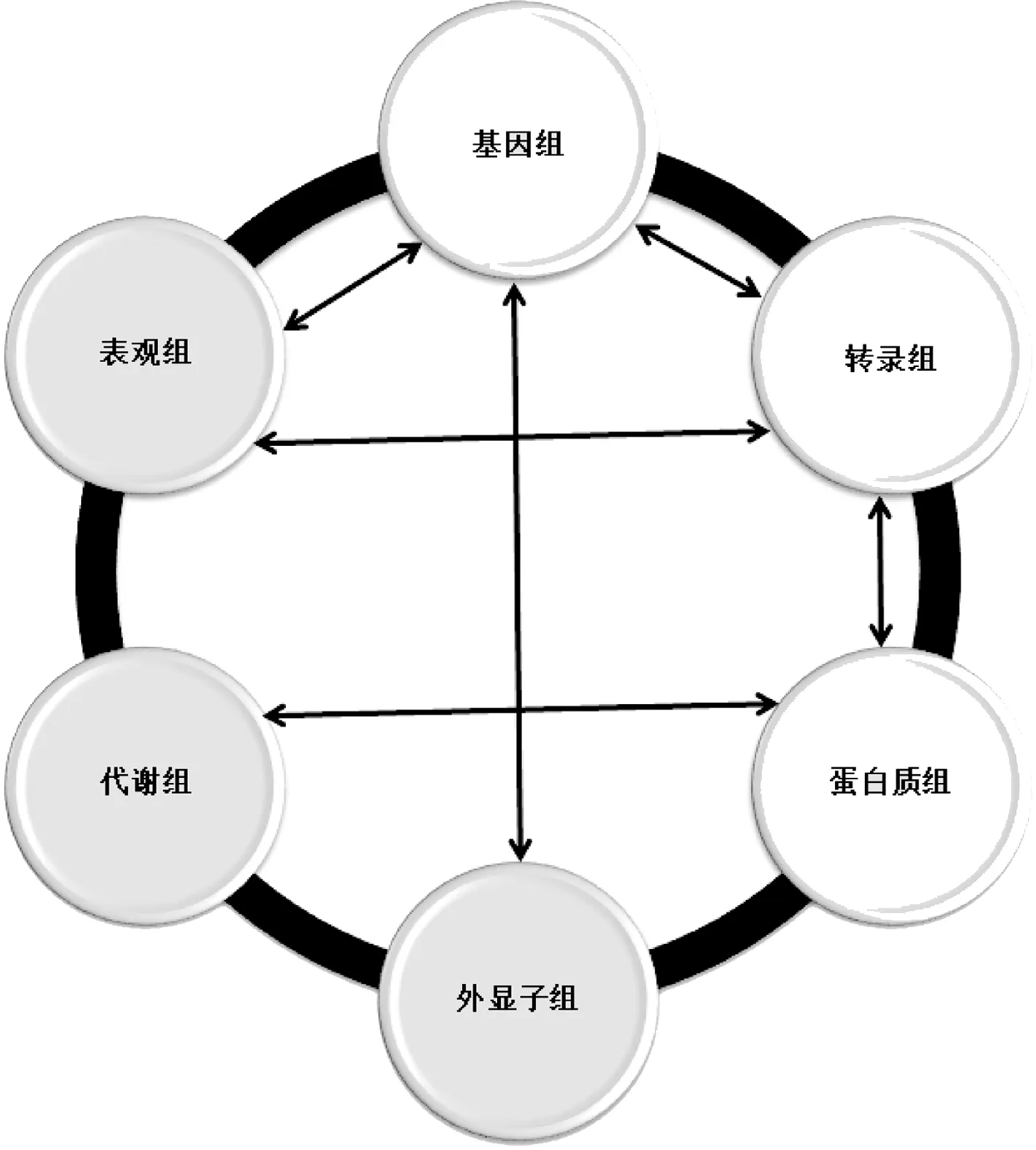
圖2 多組學(xué)單細(xì)胞測序
2.2 多組學(xué)單細(xì)胞測序在生命科學(xué)研究領(lǐng)域的應(yīng)用
目前多組學(xué)單細(xì)胞測序已經(jīng)被用于神經(jīng)科學(xué)、腫瘤研究以及免疫學(xué)等生命科學(xué)研究的多個(gè)領(lǐng)域。
DNA甲基化和核小體占據(jù)(nucleosome occupancy)屬于表觀修飾范疇,研究其深入機(jī)制至關(guān)重要。單細(xì)胞核小體占據(jù)和甲基化組測序(single cell nucleosome occupancy and methylome sequencing,scNOMe-Seq)可用于評(píng)估多能基因如OCT4和NANOG的核小體占據(jù)和DNA甲基化狀態(tài),You等[67]由此揭示了核小體缺失區(qū)域(NDR)在DNA從頭甲基化和轉(zhuǎn)錄調(diào)控中的關(guān)鍵作用。
通過聯(lián)合全基因組亞硫酸鹽測序(whole genome bisulfite sequencing,WGBS)和scRNA-seq對(duì)人類單個(gè)原始生殖細(xì)胞(primordial germ cells,PGCs)和誘導(dǎo)多能干細(xì)胞進(jìn)行分析[68-69],可研究細(xì)胞全能性和表觀遺傳重編程對(duì)可變剪接異質(zhì)性調(diào)節(jié)的影響。整合scCOOL-seq和scRNA-seq對(duì)小鼠單個(gè)卵母細(xì)胞進(jìn)行轉(zhuǎn)錄組[70],DNA甲基化和染色質(zhì)可及性分析可鑒定參與卵母細(xì)胞成熟的表觀修飾和轉(zhuǎn)錄因子,剖析卵母細(xì)胞在發(fā)育和全能性建立中的表觀遺傳改變。將單細(xì)胞的基因組拷貝數(shù)變異、染色體狀態(tài)/核小體定位、DNA甲基化、染色體倍性分析聯(lián)合起來,通過染色質(zhì)全組學(xué)景觀測序(chromatin overall omic-scale landscape sequencing,COOL-seq)可鑒定小鼠受精卵著床前表觀基因組重編程的關(guān)鍵特征和探索染色體狀態(tài)與DNA甲基化兩者的互動(dòng)關(guān)系[71],深入理解細(xì)胞多能性的表觀遺傳調(diào)控機(jī)制和異常胚胎的發(fā)育機(jī)制,為體細(xì)胞克隆效率的提高以及早期胚胎發(fā)育異常的診斷與治療提供新思路。
大腦作為人體最復(fù)雜的器官,可通過聯(lián)合snDrop-seq(single-nucleus droplet-based sequencing)和scTHS-seq(single-cell transposome hypersensitive site sequencing)獲取其單個(gè)細(xì)胞核的轉(zhuǎn)錄組和DNA可及性圖譜,用于研究如髓鞘再生等復(fù)雜的大腦生理遺傳程序[72]。
惡性腫瘤作為常見的死因之一,對(duì)人類健康構(gòu)成了嚴(yán)重威脅。腫瘤是體內(nèi)外多種因素引起的細(xì)胞失控性增殖疾病。對(duì)腫瘤的單細(xì)胞測序探索現(xiàn)已涉及外顯子組與基因組、轉(zhuǎn)錄組與基因組、表觀組與轉(zhuǎn)錄組、轉(zhuǎn)錄組與蛋白組、蛋白組與代謝組、基因組與轉(zhuǎn)錄組及表觀組等多種交叉組學(xué)。
通過全基因組和外顯子組單細(xì)胞測序方法(whole-genome and exome single cell sequencing)對(duì)單個(gè)正常細(xì)胞、雌激素受體(ER)陽性細(xì)胞和三陰性細(xì)胞進(jìn)行單核拷貝數(shù)分析[73],可發(fā)現(xiàn)ER+腫瘤細(xì)胞在生長過程中高度保守,而三陰性腫瘤細(xì)胞的點(diǎn)突變率逐漸增加,從而演變形成腫瘤的克隆多樣性,這對(duì)乳腺腫瘤的演變、化學(xué)耐藥性的診療具有重大意義。
Reuter等[74]利用Simul-seq(simultaneous DNA and RNA sequencing)同時(shí)獲取食道腺癌組織的全基因組和轉(zhuǎn)錄組測序數(shù)據(jù),發(fā)現(xiàn)腫瘤細(xì)胞中的基因組呈現(xiàn)出高度的非整倍性和局部的等位基因純合性,且特異等位基因的表達(dá)增加,由此鑒定了與治療反應(yīng)相關(guān)的基因多態(tài)性。
通過基于索引的單細(xì)胞染色質(zhì)可及性與mRNA共測序(single-cell indexing-based coassay of chromatin accessibility and mRNA,sci-CAR)重建RNA譜定義的單個(gè)肺癌細(xì)胞的染色質(zhì)可及性譜[75],深入揭示順式作用元件與染色體可及性之間的聯(lián)系,對(duì)細(xì)胞之間調(diào)節(jié)異質(zhì)性的探索提出了一個(gè)新的特征維度。
Darmanis等[76]和Genshaft等[77]聯(lián)合mRNA的逆轉(zhuǎn)錄測序和PEA技術(shù),分別對(duì)單個(gè)早期膠質(zhì)母細(xì)胞瘤細(xì)胞和人類單個(gè)乳腺癌細(xì)胞進(jìn)行干擾狀態(tài)下的mRNA和蛋白質(zhì)定量分析,逐步證實(shí)了異質(zhì)mRNA和蛋白質(zhì)表達(dá)的協(xié)同性。Younglee等[78]利用微孔技術(shù)量化原癌基因cMET在轉(zhuǎn)錄和翻譯抑制劑調(diào)節(jié)作用下的mRNA和蛋白質(zhì)表達(dá)情況,發(fā)現(xiàn)了非小細(xì)胞肺癌(NSCLC)的不同轉(zhuǎn)錄物-蛋白質(zhì)相關(guān)模式,促進(jìn)了與動(dòng)態(tài)基因表達(dá)和蛋白質(zhì)表達(dá)相關(guān)的研究從生命科學(xué)向更微觀的細(xì)胞調(diào)節(jié)機(jī)制深入發(fā)展。
代謝物是特定細(xì)胞過程遺留下的特殊化學(xué)指紋。當(dāng)其他組學(xué)數(shù)據(jù)分析無法解釋細(xì)胞體內(nèi)的生理活動(dòng)時(shí),對(duì)代謝物組的表征是個(gè)非常重要的補(bǔ)充。Xue等[79]利用代謝物的表面競爭性結(jié)合熒光讀數(shù)原理將代謝物的檢測整合到蛋白質(zhì)測定的單細(xì)胞條形碼芯片(single-cell barcode chip,SCBC)中,通過分析人單個(gè)膠母細(xì)胞瘤細(xì)胞對(duì)表皮生長因子受體拮抗劑的反應(yīng),首次揭示了細(xì)胞間代謝物的異質(zhì)性和藥物誘導(dǎo)的代謝物——磷蛋白相關(guān)網(wǎng)絡(luò)的變化情況。
在表觀組和基因組的基礎(chǔ)上綜合轉(zhuǎn)錄組,通過scTrio-seq(single-cell triple omics sequencing)可發(fā)現(xiàn)大規(guī)模拷貝數(shù)變異對(duì)基因組某些區(qū)域的DNA甲基化和RNA表達(dá)比例的影響[80],用于鑒定人肝癌組織中的癌細(xì)胞新亞群,深入研究基因組和表觀基因組異質(zhì)性對(duì)細(xì)胞群內(nèi)轉(zhuǎn)錄組異質(zhì)性的影響。
人體依賴免疫系統(tǒng)識(shí)別“異己”,清除入侵的各種抗原或自身的異常細(xì)胞。George等[81]聯(lián)合微流體和RNA測序?qū)蝹€(gè)免疫細(xì)胞進(jìn)行全轉(zhuǎn)錄組和分泌的蛋白并行檢測,在小鼠的巨噬細(xì)胞中發(fā)現(xiàn)了與TNF-α分泌高度相關(guān)的基因亞組,促進(jìn)了免疫系統(tǒng)調(diào)節(jié)機(jī)制的深入研究,以發(fā)掘藥靶用于疾病的治療。利用DNA條形碼技術(shù),轉(zhuǎn)錄組與表位細(xì)胞索引測序(cellular indexing of transcriptomes and epitopes by sequencing,CITE-seq)以及RNA表達(dá)與蛋白質(zhì)測序(RNA expression and protein sequencing,REAP-seq)對(duì)外周血單核細(xì)胞和CD8+T細(xì)胞進(jìn)行研究[82-83],鑒定了僅轉(zhuǎn)錄組學(xué)無法區(qū)分的亞群以及異常細(xì)胞群與正常細(xì)胞差異表達(dá)的蛋白質(zhì),提示CITE-seq和REAP-seq未來可用于檢測多種不同的免疫細(xì)胞,推動(dòng)新型腫瘤免疫療法的開發(fā)。Geiger等[84]通過高分辨率質(zhì)譜技術(shù)(high-resolution mass spectrometry)獲取人幼稚T細(xì)胞的動(dòng)態(tài)代謝組和蛋白組圖譜,發(fā)現(xiàn)了3種感受L-精氨酸水平的轉(zhuǎn)錄因子(BAZ1B、 PSIP1和TSN)及L-精氨酸水平對(duì)T細(xì)胞存活和抗腫瘤活性的影響,為研究細(xì)胞的代謝與功能之間復(fù)雜的相互作用開辟了新道路。
3 單細(xì)胞測序在口腔醫(yī)學(xué)中的應(yīng)用
環(huán)境中的生物膜被認(rèn)為是致病生物的儲(chǔ)存庫。單細(xì)胞基因組學(xué)是捕獲新基因組的方法之一,使用單細(xì)胞方法從環(huán)境中捕獲基因組可用于病原體基因型和流行的相關(guān)研究。如Mclean等[85]利用單細(xì)胞基因組測序,首先通過FACS將從醫(yī)院水槽的生物膜中獲取的單個(gè)細(xì)菌細(xì)胞遞送到微量滴定孔中,接著使用自動(dòng)化平臺(tái)裂解細(xì)胞并進(jìn)行DNA擴(kuò)增以創(chuàng)建單細(xì)胞基因組DNA文庫,隨后對(duì)16S rRNA基因進(jìn)行循環(huán)測序以分析文庫的多樣性,然后挑選出目標(biāo)基因組進(jìn)行全基因組測序;最后使用專門的組裝工具對(duì)所選基因組進(jìn)行組裝,獲得了牙周病原體新的牙齦卟啉單胞菌株的完整基因組,為最終揭示它們?cè)谒拗骱铜h(huán)境之間的傳播模式提供了可借鑒的研究方向。
牙周炎是導(dǎo)致牙齒脫落的主要原因,且與許多系統(tǒng)性疾病包括糖尿病、心血管疾病以及骨質(zhì)疏松癥等有關(guān)[86-88], 但與其相關(guān)的微生物在疾病中的作用機(jī)制還未十分清楚。口腔中富含微生物,但許多菌群至今還未被培養(yǎng)出來,其相關(guān)研究也因此受限。如硫酸鹽還原菌(sulfate-reducing bacteria,SRB)就是一類未培養(yǎng)的口腔微生物,許多研究發(fā)現(xiàn)其與牙周炎尤其是重癥牙周炎相關(guān)[89-91]。利用單細(xì)胞基因組測序,可以研究未培養(yǎng)菌群的功能,探索其與牙周組織疾病及全身疾病的關(guān)系。如Campbell等[92]采用熒光原位雜交(FISH)和流式細(xì)胞分選相結(jié)合的方法,首先從樣品中分離出δ變形菌屬(Deltaproteobacteria);然后利用MDA擴(kuò)增單細(xì)胞基因組DNA;接著通過16S rRNA或SSU rRNA基因測序?qū)渭?xì)胞擴(kuò)增基因組(single cell amplified genomes,SAGs)進(jìn)行分類以獲得目標(biāo)SRB菌屬中脫硫葉菌(Desulfobulbus)和脫硫弧菌(Desulfovibrio)的基因組;最后將獲得的基因組數(shù)據(jù)與其他δ變形菌的基因組進(jìn)行比較,發(fā)現(xiàn)前兩者存在與粘附、抗應(yīng)激以及防御相關(guān)的特異基因,揭示了它們?cè)谘乐懿〔∫驅(qū)W中的可能作用。
此外,利用單細(xì)胞基因組測序還可以揭示不同口腔微生物中疾病相關(guān)基因的進(jìn)化過程,進(jìn)而研究細(xì)菌與宿主間相互作用的深層機(jī)制。如坦納菌福賽斯(Tannerellaforsythia)被認(rèn)為與牙周炎、牙齦卟啉單胞菌及樹突狀螺旋體有關(guān)[93-94],而與其親緣關(guān)系最近的坦納菌BU063(Tannerella BU063)本身卻并不致病,被發(fā)現(xiàn)在健康的牙周環(huán)境中比在患病的牙周袋中更普遍。Beall等[95]對(duì)健康相關(guān)的坦納菌BU063進(jìn)行單細(xì)胞基因組測序:首先利用流式細(xì)胞術(shù)從健康受試者的齦下菌斑中分離出單個(gè)細(xì)胞;隨后對(duì)其基因組進(jìn)行擴(kuò)增;接著對(duì)16S rRNA基因測序,然后在核心口腔16S基因數(shù)據(jù)庫(CORE oral 16S gene database)中進(jìn)行BLAST搜索以鑒定出所需的BU063,最后利用試劑盒制備其基因組文庫,分析發(fā)現(xiàn)其與牙周病致病坦納菌福賽斯之間存在基因組成上的差異,即在BU063中未發(fā)現(xiàn)福賽斯中已知的包括karilysin、prtH和bspA在內(nèi)的毒力基因,故提出病原體的毒性可能源自致病性基因簇的存在的觀點(diǎn),為解釋高度相似的口腔微生物間具有不同致病潛能的現(xiàn)象提供了新的研究思路。
腫瘤內(nèi)的細(xì)胞異質(zhì)性對(duì)腫瘤的生長、轉(zhuǎn)移以及腫瘤對(duì)治療的反應(yīng)等腫瘤生物學(xué)的多個(gè)方面具有重要影響[96]。單細(xì)胞轉(zhuǎn)錄組測序(scRNA-seq)可以用于鑒定腫瘤的組成和癌癥干細(xì)胞以及為腫瘤的耐藥性提供新的見解。因此,口腔頜面部的腫瘤亦可利用scRNA-seq進(jìn)行相關(guān)研究。如Puram等[97]對(duì)不同口腔鱗狀細(xì)胞癌患者的腫瘤細(xì)胞、基質(zhì)細(xì)胞和免疫細(xì)胞進(jìn)行scRNA-seq分析,發(fā)現(xiàn)后兩者在不同患者中的表達(dá)程序具有一致性,而腫瘤細(xì)胞在腫瘤之間及腫瘤內(nèi)部則存在多方面的差異表達(dá)。在差異表達(dá)的程序中,研究人員結(jié)合上皮-間質(zhì)轉(zhuǎn)化(epithelial-to-mesenchymal transition ,EMT)的特點(diǎn),提出了腫瘤細(xì)胞的部分上皮-間質(zhì)轉(zhuǎn)化(partial EMT,p-EMT)概念,通過將scRNA-seq數(shù)據(jù)與頭頸部鱗癌(head and neck squamous cell carcinoma,HNSCC)的常規(guī)大體測序數(shù)據(jù)進(jìn)行整合比較,根據(jù)p-EMT細(xì)胞的特點(diǎn)重新把HNSCC亞型分為三類,并通過實(shí)驗(yàn)證明p-EMT可以作為淋巴結(jié)轉(zhuǎn)移、淋巴結(jié)分期的獨(dú)立預(yù)測因子,即p-EMT評(píng)分可以幫助預(yù)測淋巴結(jié)轉(zhuǎn)移,從而避免不必要的頸部淋巴結(jié)清掃術(shù),為更好地了解上皮性腫瘤的內(nèi)部異質(zhì)性與其侵襲性和轉(zhuǎn)移的關(guān)系提供了實(shí)驗(yàn)支持以用于指導(dǎo)臨床實(shí)踐。
4 展 望
近十年來,單細(xì)胞測序技術(shù)方興未艾,從細(xì)胞鑒定、譜系分析到偽時(shí)分析,隨著單細(xì)胞技術(shù)的不斷發(fā)展和成熟,單細(xì)胞測序在生理病理研究方面扮演越來越重要的角色。如口腔醫(yī)學(xué)領(lǐng)域利用單細(xì)胞測序技術(shù),打開了口腔微生物暗物質(zhì)(microbial dark matter,MDM)研究的大門[98],使口腔疾病的病因?qū)W研究向前邁出了重要的一步;將單細(xì)胞測序與腫瘤研究相關(guān)的方法引進(jìn)口腔頜面部腫瘤的機(jī)制探索實(shí)驗(yàn)中,推動(dòng)其迅猛發(fā)展。未來單細(xì)胞測序?qū)⒊掷m(xù)由單組學(xué)向多組學(xué)延伸,通過整合數(shù)據(jù),建立一個(gè)全面的人類細(xì)胞圖譜[99],揭示細(xì)胞功能的潛在機(jī)制并推斷細(xì)胞之間的因果關(guān)系,最終解答諸如“什么是細(xì)胞類型”等重要的生物學(xué)問題。

