縱向分層應變評價早期系統性紅斑狼瘡左心室收縮功能及同步性改變
王方方,張瑞芳,武麗娜,張秀婷
(鄭州大學第一附屬醫院超聲科,河南 鄭州 450052)
系統性紅斑狼瘡(systemic lupus erythematosus, SLE)為常見全身性結締組織疾病,可累及多個臟器,心血管(cardiovascular, CV)為最常及累部位之一。心血管疾病(cardiovascular disease, CVD)是SLE患者致殘和死亡的重要原因之一[1]。超過50%的SLE患者心臟受累時并無明顯臨床癥狀[2],但常規檢查對此類亞臨床心臟損傷并不敏感。本研究應用縱向分層應變技術分析SLE患者左心室心肌收縮功能及同步性,評價早期SLE左心室心肌改變。
1 資料與方法
1.1 一般資料 收集2019年4月—6月鄭州大學第一附屬醫院診治的42例SLE患者,男4例,女38例,年齡19~59歲,平均(36.9±11.3)歲,病程1個月~11年。納入標準:①符合1997年美國風濕病學會SLE診斷標準;②左心室射血分數(left ventricular ejection fraction, LVEF)>55%;③不伴先天性心臟病、心肌病、冠心病、嚴重瓣膜病、中-大量心包積液、原發性高血壓、糖尿病及嚴重肝腎功能不全等;④患者知情同意。排除標準:①年齡<18歲或>65歲;②超聲圖像質量欠佳或斑點追蹤不成功;③合并其他結締組織病;④妊娠期或哺乳期患者。采用SLEDAI-2000評分系統評估SLE疾病活動性指數(systemic lupus erythematosus disease activity index, SLEDAI),并據此將患者分為非活動期SLE(SLEDAI積分0~4分,SLE-)及活動期SLE(SLEDAI積分≥5分,SLE+)2個亞組。收集同期30名健康體檢者作為對照組,男3名,女27名,年齡21~58歲,平均(37.1±9.7)歲,均排除高血壓、糖尿病及心肺疾病等。
1.2 儀器與方法 采用GE Vivid E9彩色多普勒超聲診斷儀,M5s二維探頭,配有具備2D-strain功能的Echo PAC工作站。囑受檢者左側臥,連心電圖,待圖像顯示清晰且穩定后,采集包含3個心動周期的3個心尖切面(兩腔心、三腔心、四腔心)的動態圖像(40~80幀/秒)并儲存于硬盤。采用盲法行脫機分析,打開Q-Analysis/2D strain模式,于收縮期圖像手動描記心內膜邊界,軟件自動將左心室壁分成內、中、外3層,調整描記點以確保追蹤滿意。完成3個切面分析后,系統自動顯示左心室17節段3層心肌縱向應變(longitudinal strain, LS)及相應的應變曲線、牛眼圖及LS達峰時間的標準差(peak strain dispersion, PSD)。對以上指標均測量3次,取平均值。
1.3 統計學分析 采用SPSS 22.0統計分析軟件。以±s表示符合正態分布的連續變量,采用獨立樣本t檢驗比較2組間均數,以單因素方差分析進行多組(包括亞組)均數比較,兩兩比較用LSD法。分類變量用百分數表示,2組間比較采用χ2檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 基本資料及常規超聲心動圖參數比較 SLE組靜息心率(resting heart rate, RHR)、收縮壓、血脂代謝異常比例均高于對照組(P均<0.05); LVEF低于對照組減(P<0.01),但在正常范圍內。組間其余資料及常規超聲參數差異均無統計學意義(P均>0.05)。見表1。SLE組中,SLE+亞組補體C3低于SLE-亞組(P<0.05),2亞組間其余常規資料差異均無統計學意義(P均>0.05)。見表2。
2.2 分層應變參數比較 SLE組左心室各層及各節段心肌間LS仍保存梯度特征,即心內膜下整體心肌LS(global LS of endo-myocardium, GLSendo)>中層心肌整體LS(global LS of mid-myocardium, GLSmid)>心外膜下心肌整體LS(global LS of epi-myocardium, GLSepi)(P均<0.05);心尖段>中間段>基底段(P均<0.05)。見圖1。與對照組比較,SLE組左心室整體、基底段及中間段心內膜下心肌LS(LS of endo-myocardium, LSendo)、中層心肌LS(LS of mid-myocardium, LSmid)、心外膜下心肌LS(LS of epi-myocardium, LSepi)均低于對照組(P均<0.05),心尖段3層心肌LS差異均無統計學意義(P均>0.05)。SLE組內,SLE+亞組左心室整體、基底段及中間段心內膜下心肌LS(LS of endo-myocardium, LSendo)、中層心肌LS(LS of mid-myocardium, LSmid)、心外膜下心肌LS(LS of epi-myocardium, LSepi)均低于對照組(P均<0.05),心尖段3層心肌LS差異均無統計學意義(P均>0.05);SLE-組左心室整體、基底段心內膜下心肌LS均低于對照組(P均<0.05)。2個SLE亞組之間整體及節段性3層心肌LS差異均無統計學意義(P均>0.05)。見表3、4及圖2、3。
2.3 同步化參數比較 與對照組PSD[(30.27±9.86)ms]比較,SLE組PSD[(51.85±12.16)ms]升高(t=5.286,P<0.01),見圖4;其中SLE-亞組[(49.00±12.82)ms]與SLE+亞組 [(52.83±11.82)ms]均升高(F=5.866,P<0.01),亞組間差異無統計學意義(P=0.369)。
表1 2組基本資料及常規超聲指標比較(±s)
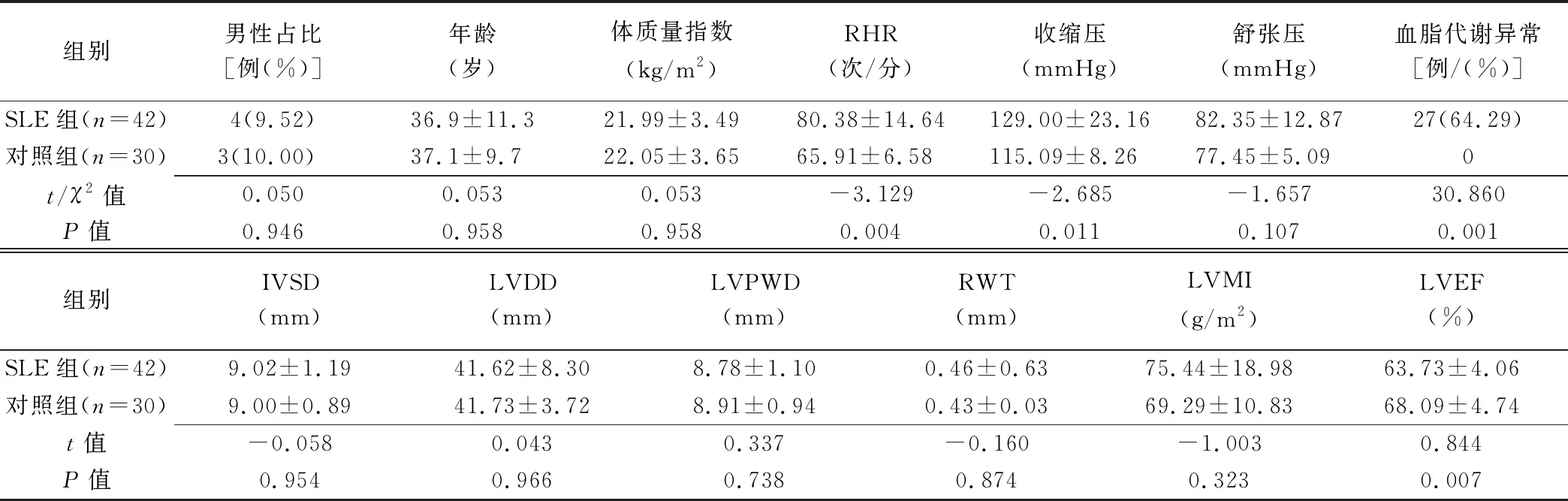
表1 2組基本資料及常規超聲指標比較(±s)
組別男性占比[例(%)]年齡(歲)體質量指數(kg/m2)RHR(次/分)收縮壓(mmHg)舒張壓(mmHg)血脂代謝異常[例/(%)]SLE組(n=42)4(9.52)36.9±11.321.99±3.4980.38±14.64129.00±23.1682.35±12.8727(64.29)對照組(n=30)3(10.00)37.1±9.722.05±3.6565.91±6.58115.09±8.2677.45±5.090t/χ2值0.0500.0530.053-3.129-2.685-1.65730.860P值0.9460.958 0.958 0.004 0.011 0.107 0.001 組別IVSD(mm)LVDD(mm)LVPWD(mm)RWT(mm)LVMI(g/m2)LVEF(%)SLE組(n=42)9.02±1.1941.62±8.308.78±1.100.46±0.6375.44±18.9863.73±4.06對照組(n=30)9.00±0.8941.73±3.728.91±0.940.43±0.0369.29±10.8368.09±4.74t值-0.058 0.043 0.337 -0.160 -1.003 0.844 P值0.954 0.966 0.738 0.874 0.323 0.007
注:IVSd:室間隔舒張末期厚度(interventricular septum thickness at end-diastole);LVEDD:左心室舒張末期內徑(left ventricle end-diastolic dimension);LVPWD:左心室后壁舒張末期內徑(left ventricular posterior wall depth);RWT:相對室壁厚度(relative wall thickness);LVMI:左心室質量指數(left ventricular weight index)
表2 SLE組內2亞組間基本資料比較(±s)

表2 SLE組內2亞組間基本資料比較(±s)
組別發作次數補體C3(g/L)補體C4(g/L)紅細胞沉降率(mm/h)C反應蛋白(mg/L)SLE-亞組(n=22)2.79±1.480.89±0.270.20±0.0724.50±18.073.36±4.48SLE+亞組(n=20)2.17±1.270.65±0.370.15±0.1237.17±29.797.20±12.66t值1.136 2.057 1.235 -1.333 -1.063 P值0.267 0.029 0.229 0.195 0.298

圖1 心尖三腔心切面左心室內、中、外3層心肌的整體LS值及應變曲線 A.對照組; B.SLE組
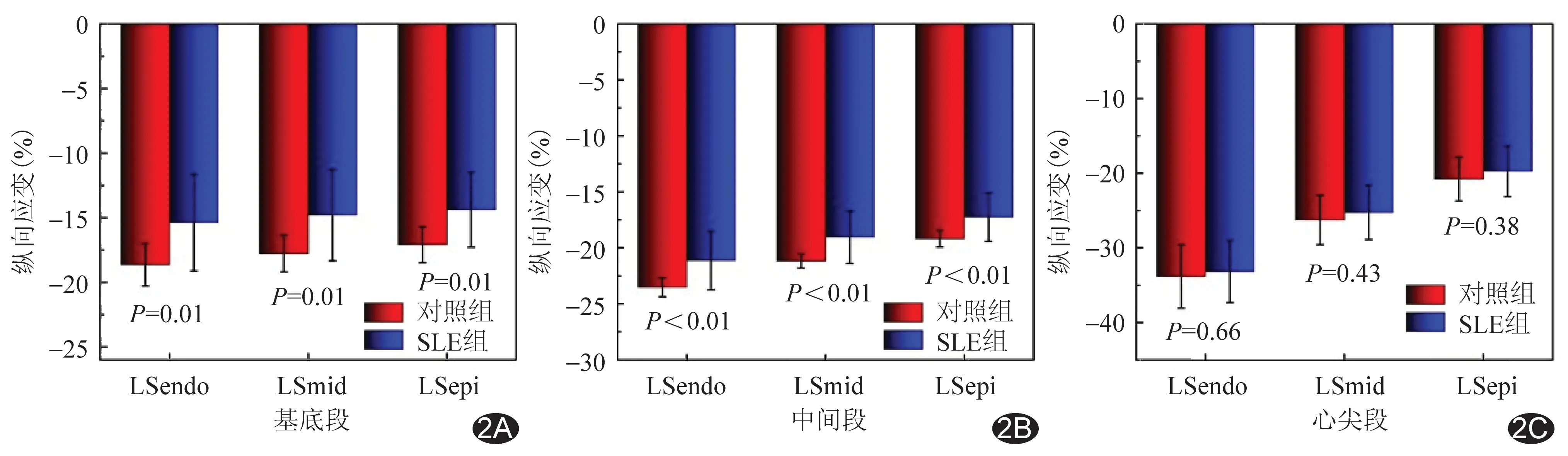
圖2 SLE組與對照組左心室節段性3層心肌LS A.基底段; B.中間段; C.心尖段
表3 SLE組與對照組整體分層LS參數比較(%,±s)

表3 SLE組與對照組整體分層LS參數比較(%,±s)
組別GLSendo GLSmidGLSepiSLE組(n=42)-22.58±2.49-19.58±2.16-17.40±2.46對照組(n=30)-24.55±1.14-21.48±0.95-18.89±0.95t值-3.306 -3.717 -2.657 P值0.002 0.001 0.012
表4 各SLE亞組與對照組整體分層LS參數比較(%,±s)

表4 各SLE亞組與對照組整體分層LS參數比較(%,±s)
組別GLSendo GLSmidGLSepi對照組(n=30)-24.55±1.14-21.48±0.95-18.89±0.95SLE-組(n=22)-22.42±1.83*-20.02±1.52-17.86±1.33SLE+組(n=20)-22.18±3.14*-19.08±2.70*-16.52±3.41*F值3.488 4.786 2.908 P值0.042 0.015 0.046
注:*:與對照組比較P<0.05
3 討論
相比普通人群,SLE患者出現不良心血管事件風險增加50倍[3]。SLE累及心肌引起心律失常、擴張型心肌病或心力衰竭等是患者死亡的獨立預測因素[4],考慮以下因素參與其機制[5]:①心肌炎,免疫復合物沉積使補體激活,在心肌血管壁及肌束間出現補體及免疫球蛋白顆粒沉積,尤其疾病處于活動期時;②冠狀動脈病變,主要累及微小血管,病理改變為免疫介導的血管損害及免疫復合物沉積,產生冠狀動脈炎癥,導致冠狀動脈管腔狹窄甚至阻塞及遠端小范圍心肌灶性纖維化;③長期用藥引起高血壓、脂質代謝紊亂、糖尿病等,加速和導致動脈硬化。
SLE患者存在心臟自主神經功能障礙。RHR是評估自主神經功能障礙的無創指標。本研究中SLE組RHR明顯高于對照組。既往研究[6]表明,RHR越高,SLE患者動脈僵硬度和全身低度炎癥水平越高,提示維持RHR在正常范圍較低水平可能對心血管有益。本研究中SLE組收縮壓及血脂代謝異常比例均增高,可能與SLE患者常伴狼瘡性腎炎及長期使用激素等藥物治療有關;SLE組與對照組IVSd、LVDED、LVPWD、RWT、LVMI差異均無統計學意義,LVEF雖減低但仍在正常范圍內,提示常規超聲心動圖并不能敏感檢出SLE患者左心室心肌早期改變。
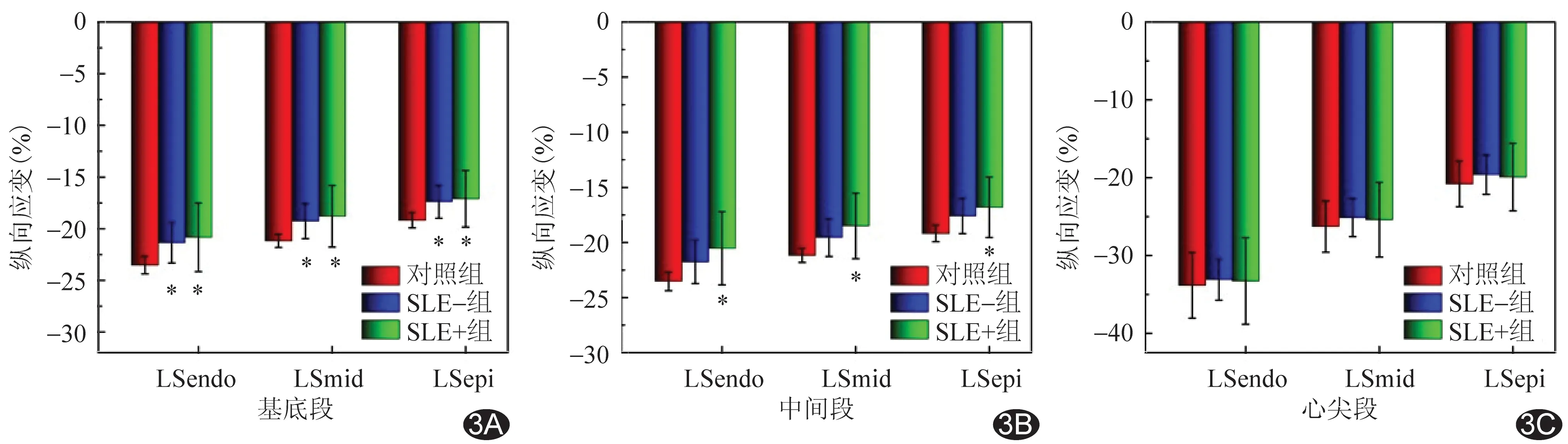
圖3 SLE亞組與對照組左心室節段性3層心肌LS比較 A.基底段; B.中間段; C.心尖段(*:與對照組比較P<0.05)
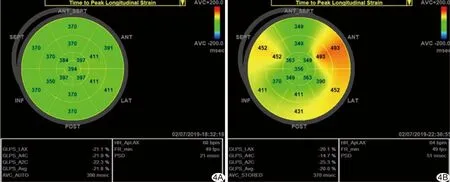
圖4 17節段LS達峰時間牛眼圖 A.對照組; B.SLE組
本研究結果顯示SLE患者左心室心肌LS梯度特征仍與普通人保持一致,由內而外逐層遞減,自基底到心尖逐段遞增[7],但SLE組整體及節段性3層心肌LS均已低于對照組,提示左心室心肌受累時,應變峰值減低早于應變梯度改變。SLE組心尖段各層心肌LS與對照組差異均無統計學意義,提示SLE亞臨床左心室縱向收縮功能受損首先出現在基底段和中間段,而左心室幾何中心在近心尖處,該處心肌對保持左心室沿幾何中心扭轉及維持心腔內血流推向主動脈瓣口壓力有重要作用,心尖段心肌功能受損相對滯后可能是SLE患者左心室心肌早期受損而LVEF保持在正常范圍的原因之一。既往研究[8-9]發現SLE患者早期左心室GLS減低,但未對各層心肌進行逐層追蹤分析,而內、中、外3層心肌對損傷的反應不盡相同[10]。作為評估心肌運動協調性的指標,PSD臨床潛力巨大[11]。本研究應用分層應變技術對左心室心肌進行整體及節段性分層應變分析,發現SLE組PSD高于對照組,提示SLE患者存在亞臨床左心室室壁運動同步性下降。多項研究[12-13]證實以二維斑點追蹤成像獲得LS對預測不同心臟疾病模型具有高度臨床價值,應用基于二維斑點追蹤成像的心肌分層應變成像評價SLE患者心臟損傷及預后臨床應用潛力巨大。
SLE患者病情呈穩定與復發交替。既往研究[14]表明,C3水平與動脈粥樣硬化性心血管疾病關系密切,提示控制C3水平有可能減少SLE患者心肌功能損傷。本研究中活動期與非活動期SLE患者補體C3差異有統計學意義,而LS和PSD差異均無統計學意義,考慮與樣本量較少有關;SLE組中2個亞組左心室心肌縱向收縮功能及同步性均有不同程度改變,且活動期患者心肌受累范圍相對較大,表明隨病情進展,心內膜下心肌首先受累,其次是中間、心外膜下心肌。負責縱向運動的心內膜下心肌主要參與微血管疾病[15],采用縱向分層應變評估心肌異常程度可能為評價SLE病情進展提供參考;但目前尚缺乏相應的診斷標準,其潛在臨床價值有待證實。
本研究的局限性:①分層應變技術對超聲圖像質量及受檢者心率要求高,心內膜顯示不清時追蹤質量差,對心率變異大者無法生成牛眼圖;②未與心臟MRI進行比較;③僅分析LS參數,未觀察病情活動程度、病程、藥物治療時間及劑量等對左心室收縮功能的影響,有待進一步深入。
綜上,縱向分層應變技術能較敏感地評估SLE患者亞臨床左心室收縮功能及同步性改變,早期識別并監測心肌損傷,對臨床及時進行有效干預有一定參考意義。

