迷迭香酸抗動脈粥樣硬化作用研究
林曉琳,張凌云
1濱州醫學院臨床醫學院;2煙臺毓璜頂醫院萊山分院內科,煙臺264003;3濱州醫學院煙臺附屬醫院內分泌科,煙臺 264100
動脈粥樣硬化(atherosclerosis,AS)是指動脈內膜有脂質等血液成分的沉積、平滑肌細胞增生和膠原纖維增多,形成粥糜樣含脂壞死病灶和血管壁硬化[1]。隨著AS的發展,會導致動脈壁增厚變硬、血管腔狹窄,一旦發展到足以阻塞動脈腔,則該動脈所供應的組織或器官將缺血或壞死[2]。近年來,AS的發病率逐漸升高,并且也是冠心病、腦梗死、外周血管病的主要原因,這嚴重威脅著人們的生活健康[3,4]。雖然AS的發病率如此之高,但是臨床上還沒有一種專門治療AS的藥物,目前臨床上主要采用一些降脂藥(如他汀類藥物)治療AS,但這遠遠不能有效解決AS問題。因此,尋找一種安全、低毒、有效的治療AS藥物是迫切需要的。
引起AS的原因有很多,如高脂血癥和高膽固醇血癥[5]。近年來,大量的研究發現,剪切力在AS的發生中起著重要的作用[6]。研究發現低剪切力是誘導AS發生的危險因素之一[7]。低剪切力會增加內皮細胞中活性氧(ROS)的活性,并降低一氧化氮(NO)的活性,造成內皮細胞功能紊亂和氧化應激,促進AS的發生[8]。因此,尋找一種可以改善低剪切力誘導的血管內皮細胞功能紊亂或降脂的藥物來治療AS可能是一條有效的策略。
迷迭香酸是一種天然的多酚類化合物,具有很好的抗炎和抗氧化作用[9,10]。很多研究已經發現,迷迭香酸對心血管有很好的保護作用,如心肌保護作用[11],但是有關治療AS的作用尚未報道。因此,本研究主要研究迷迭香酸的治療AS模型作用。
1 材料
1.1 試劑
斑馬魚幼魚基礎飼料購自上海海圣生物實驗設備有限公司。迷迭香酸標準品(純度≥98%)購自成都曼思特生物科技有限公司。橙色熒光標記膽固醇標準品購自Sigma公司。膽固醇標準品、RPMI 1640培養液、胰酶和蛋白提取試劑盒均購自北京索萊寶生物科技有限公司。其余試劑均為國產分析純。
1.2 儀器
Z-C-D6型集中式斑馬魚養殖單元購自上海海圣生物實驗設備有限公司。SZX7型奧林巴斯體視鏡購自奧林巴斯公司。HH-4數顯恒溫水浴鍋(國華電器有限公司);LEGEND Micro 21R型離心機(Thermo scientific,美國);BS210S電子天平(Sartorius);細胞培養箱(HERA Cell 150);熒光倒置顯微鏡(Olympus);超凈工作臺(蘇凈集團蘇州安泰空氣技術有限公司);iCycler iQ5(Bio-Rad,美國),核酸定量儀(Amerscham biosciences,美國),逆轉錄儀器(Veriti 96,美國ABI)。
1.3 動物
野生型AB品系斑馬魚、轉基因型(flil:EGFP)斑馬魚和轉基因型(mpx:EGFP)斑馬魚購自國家斑馬魚資源中心。
1.4 實驗細胞
人臍靜脈內皮細胞株(EA.hy926)均來源于ATCC公司。
2 方法
2.1 細胞實驗
2.1.1 細胞培養
取生長狀態良好的EA.hy 926細胞,使用含10%胎牛血清、鏈霉素(100 μg/L)、慶大霉素(100 μg/L)的RPMI 1640培養液(pH=7.5),在37 ℃ 5%CO2飽和濕度的培養箱中培養,取對數生長期細胞進行各項實驗。
2.1.2 血管內皮細胞功能紊亂模型建立
采用平行板流動腔建立EA.hy926細胞功能紊亂模型,造模方法與文獻一致[8],大體操作如下:將EA.hy926細胞爬片貼壁后置于可體外模擬LSS的平行板流動腔中,施加剪切力2 dyn/cm2于貼壁的細胞,作用30 min即可。
2.1.3 DHE法檢測EA.hy926細胞中ROS活性
取對數生長期的EA.hy926細胞爬片,并使用不同濃度(0、0.1、1和10 mg/L)的迷迭香酸處理24 h后,進行平行板流動腔實驗。平行板流動腔實驗結束后,采用DHE法檢測各組EA.hy926細胞中ROS活性。平行板流動腔實驗結束后,取出玻片,去除培養液,用PBS洗2次,加入DHE于37 ℃培養箱中避光孵育20 min。用PBS洗三次,收集細胞,在激發波長535 nm,發射波長610 nm處,用熒光酶標儀檢測熒光強度。
2.1.4 DAF-FM DA法檢測細胞中NO活性
取對數生長期的EA.hy926細胞爬片,并使用不同濃度(0、0.1、1和10 mg/L)的迷迭香酸處理24 h后,進行平行板流動腔實驗。平行板流動腔實驗結束后,采用DAF-FM DA法檢測各組EA.hy926細胞中NO活性。平行板流動腔實驗結束后,取出玻片,去除培養液,用PBS洗2次,加入DAF-FM DA于37 ℃培養箱中避光孵育20 min。用PBS洗三次,收集細胞,在激發波長495 nm,發射波長515 nm處,用熒光酶標儀檢測熒光強度。
2.1.5 檢測細胞中ICAM-1和VCAM-1的mRNA表達
取對數生長期的EA.hy926細胞爬片,并使用不同濃度(0、0.1、1和10 mg/L)的迷迭香酸處理24 h后,進行平行板流動腔實驗。平行板流動腔實驗結束后,提取各組細胞中的總RNA,并使用q-PCR法檢測各組EA.hy926細胞中ICAM-1、VCAM-1和GAPDH。引物由Primer3 software設計與合成,引物的序列等信息將表1。細胞總RNA的提取:平行板流動腔實驗結束后,取出玻片放置于培養皿中,后按照RNA提取說明書的方法采用Trizol溶液提取細胞總RNA。
RNA的逆轉錄反應:按照說明書配制RT反應液(5 × PrimeScript RT Buffer 2 μL,總RNA,RNase Free dH2O補足至10 μL),置于逆轉錄儀中反轉錄成cDNA。
熒光定量PCR檢測:以上述反轉錄cDNA為模板,應用熒光定量PCR檢測細胞中ICAM-1、VCAM-1和GAPDH的基因表達。25 μL反應體系:SYBR Premix Ex Taq Ⅱ12.5 μL,上下游引物各1 μL,模板2 μL,滅菌雙蒸水補足至25 μL。擴增條件為預變性95 ℃ 30 s,變性95 ℃ 5 s,退火60 ℃ 30 s,以上兩步擴增循環。每個循環結束后收集熒光信號,反應結束后確認擴增曲線和融解曲線。

表1 引物序列
2.1.6 檢測細胞中ICAM-1和VCAM-1的蛋白表達
平行板流動腔實驗結束后,使用蛋白提取試劑盒提取各組細胞的總蛋白試劑盒。將蛋白樣品加入5×上樣緩沖液后煮沸變性,每孔加入20 μg蛋白,70 V恒壓電泳至溴酚藍指示劑至分離膠濃縮膠分界處,轉為90 V恒壓電泳至指示劑接近凝膠的底部。將電泳完畢的凝膠按照從正極到負極依次為海綿墊-濾紙-膜-凝膠-濾紙-海綿墊的順序夾好,250 mA恒流轉膜,冰浴,轉膜時間1 h。使用脫脂牛奶(5%)封閉2 h后,加入一抗,在25 ℃下孵育1 h,緩慢搖動。使用TBST洗3次,加入合適稀釋度的辣根過氧化酶標記的二抗,室溫孵育1 h后,TBST洗3次。采用ECL化學發光底物顯色,UVP化學發光成像系統獲取圖像信息,Image J軟件分析條帶光密度值,目的蛋白與其對應的內參比較后,再于正常組比較得出相對表達量。
2.2 動物實驗
2.2.1 斑馬魚AS模型建立及血管中斑塊檢測
本研究采用高脂飼料喂食斑馬魚建立斑馬魚AS模型[12],即對受精后5天(dpf)的斑馬魚幼魚喂食含4%膽固醇的高脂飼料10天。為了能夠觀察到血管中斑塊形成情況,本研究采用轉基因型(flil:EGFP)斑馬魚(血管帶有綠色熒光標記)建造AS模型,并在高脂飼料中添加一些橙色熒光標記的膽固醇(比例為10 μg/g)。將5 dpf的flil:EGFP斑馬魚幼魚分成5組:正常組、AS模型組、0.1 mg/L迷迭香酸治療組、1 mg/L迷迭香酸治療組和10 mg/L迷迭香酸治療組。在正常組中,向幼魚喂食正常基礎飼料13天即可。在AS模型組中,先喂食3天正常基礎飼料,在喂食10天含4%膽固醇的高脂飼料(帶有橙色熒光標記的)10天。在3個不同劑量的迷迭香酸治療組中,先喂食3天正常基礎飼料,在喂食10天含4%膽固醇的高脂飼料(帶有橙色熒光標記的)10天,并在喂食高脂飼料的同時給予不用劑量(0.1、1和10 mg/L)的迷迭香酸治療。喂食高脂飼料10天后,禁食24 h,在熒光顯微鏡下可以清楚看到綠色熒光血管中有大量橙色熒光標記的脂質蓄積。已經有研究證明了[13],這些血管中蓄積的脂質與人AS的早期斑塊成分是相似的。故可通過此模型來觀察AS斑塊的形成情況。
2.2.2 檢測斑馬魚的炎癥反應
采用轉基因型(mpx:EGFP)斑馬魚(中性粒細胞帶有綠色熒光標記)建造AS模型。斑馬魚的分組與處理與方法“2.6”中的一致,但是所喂食的高脂飼料不含有橙色熒光標記的膽固醇。喂食高脂飼料10天后,禁食24 h,在熒光顯微鏡下,可通過觀察斑馬魚血管中綠色顆粒狀的中性粒細胞數量來反應炎癥程度。
2.2.3 檢測斑馬魚的氧化應激
采用野生型AB品系斑馬魚建造AS模型。斑馬魚的分組與處理與方法“2.6”中的一致,但是所喂食的高脂飼料不含有橙色熒光標記的膽固醇。喂食高脂飼料10天后,禁食24 h后,使用DCFH-DA活性氧ROS熒光探針,觀察各組斑馬魚ROS活性。
2.2.4 檢測迷迭香酸的降脂作用
采用野生型AB品系斑馬魚建造AS模型。斑馬魚的分組與處理與方法“2.6”中的一致,但是所喂食的高脂飼料不含有橙色熒光標記的膽固醇。喂食高脂飼料10天后,禁食24 h后,使用尼羅紅染色,觀察迷迭香酸對AS斑馬魚血脂水平的影響。
2.3 數據統計
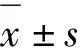
3 結果
3.1 迷迭香酸改善低剪切力誘導的血管內皮細胞功能紊亂
結果如圖1所示,低剪切力顯著升高EA.hy926細胞中ROS活性,并降低NO的活性。1和10 mg/L迷迭香酸能有效改善低剪切力誘導的ROS活性升高和NO活性降低。0.1 mg/L迷迭香酸對低剪切力誘導的ROS活性升高和NO活性降低并沒有顯著影響。

圖1 迷迭香酸降低ROS活性,并升高NO活性(n=3)
3.2 迷迭香酸改善低剪切力誘導的炎癥反應
通過q-PCR和Western blotting檢測一些血管黏附分子(ICAM-1和VCAM-1)的基因和蛋白表達來反應EA.hy926細胞的炎癥情況。q-PCR檢測結果如表2所示,低剪切力顯著升高EA.hy926細胞中ICAM-1和VCAM-1的mRNA表達。1和10 mg/L迷迭香酸能顯著降低低剪切力誘導的ICAM-1和VCAM-1的mRNA表達升高。0.1 mg/L迷迭香酸對ICAM-1和VCAM-1的mRNA表達并沒有顯著影響。western blotting檢測如圖2所示,低剪切力顯著增加ICAM-1的蛋白表達,1和10 mg/L迷迭香酸能顯著降低低剪切力誘導的ICAM-1的蛋白表達升高,但是0.1 mg/L迷迭香酸對ICAM-1的蛋白表達沒有顯著影響。低剪切力顯著增加VCAM-1的蛋白表達,10 mg/L迷迭香酸能顯著降低低剪切力誘導的VCAM-1的蛋白表達升高,但是0.1和1 mg/L迷迭香酸對VCAM-1的蛋白表達沒有顯著影響。

表2 迷迭香酸降低低剪切力誘導的ICAM-1和VCAM-1的mRNA表達升高(n=3)
注:與0 min LSS+ 0 mg/L RosA組比較,##P<0.01;與30 min LSS + 0 mg/LRosA組比較,**P<0.01。
Note:Compared with 0 min LSS + 0 mg/L RosA,##P< 0.01;Compared with 30 min LSS + 0 mg/L RosA,**P< 0.01.
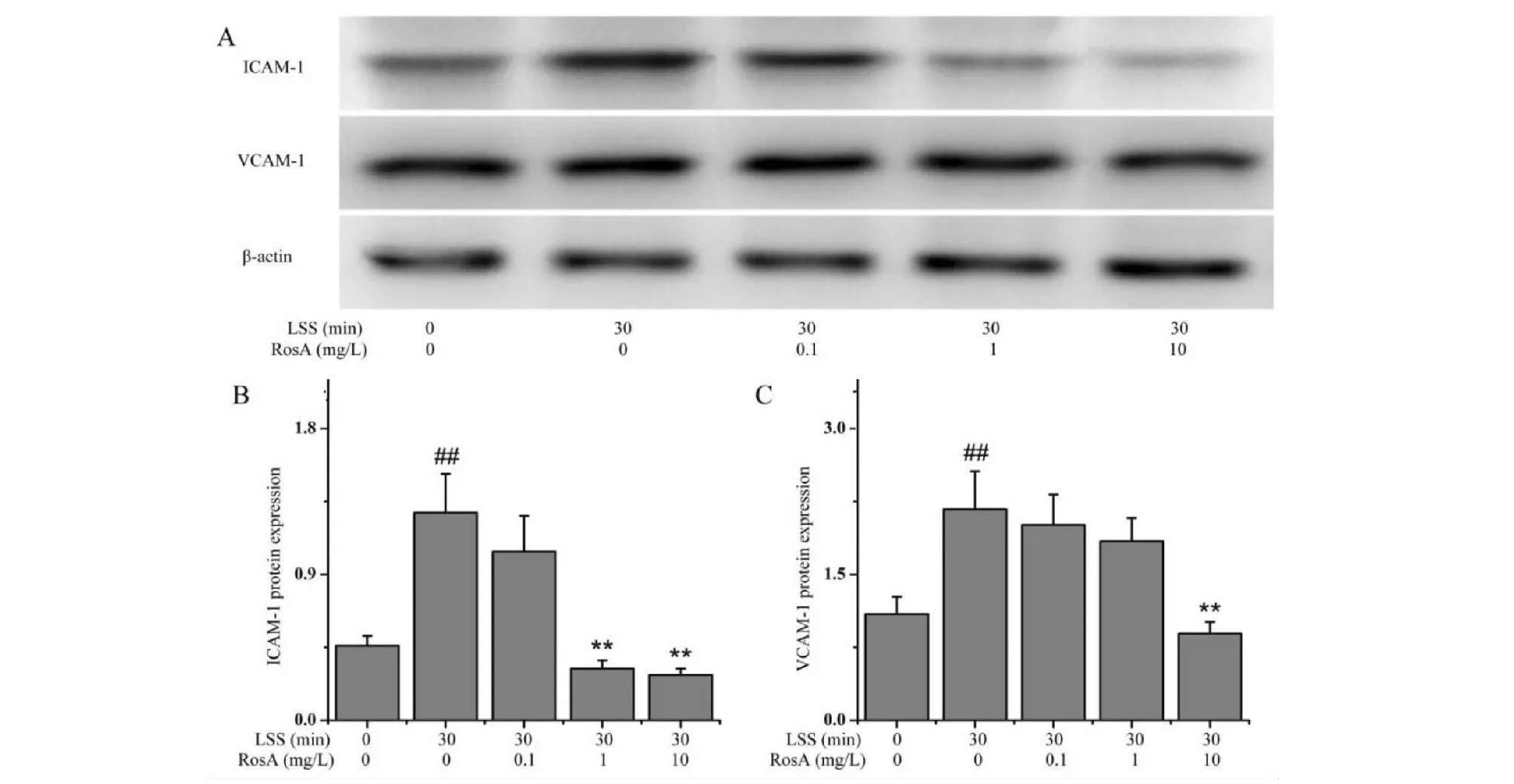
圖2 迷迭香酸降低低剪切力誘導的ICAM-1和VCAM-1的蛋白表達升高(n=3)
3.3 迷迭香酸減輕AS斑馬魚血管中斑塊的形成
通過觀察斑馬魚血管中的脂質蓄積來反應斑塊的形成情況。結果如圖3所示,正常組斑馬魚血管中并未出現斑塊。與正常組比較,AS模型組中出現大量的橙色脂質斑塊。與AS模型組比較,1和10 mg/L迷迭香酸治療均能有效減輕血管中的斑塊形成。0.1 mg/L迷迭香酸治療并不能有效減輕斑塊的形成。
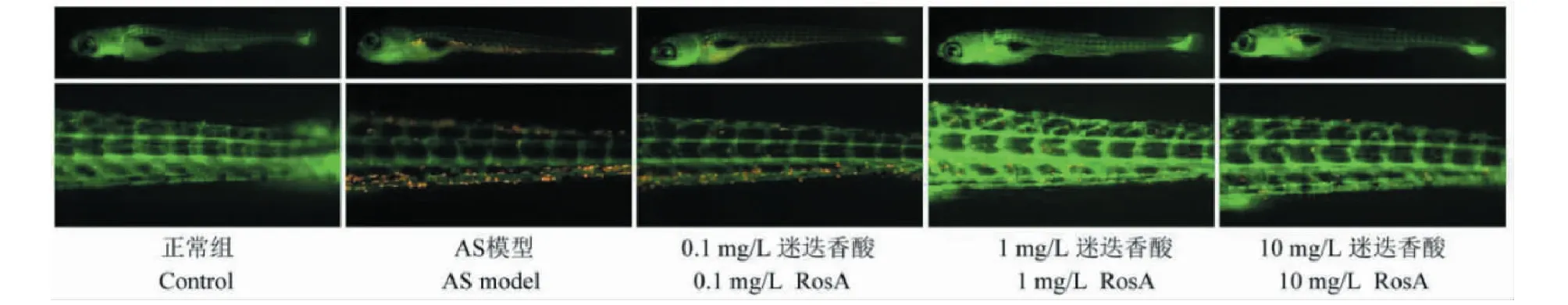
圖3 迷迭香酸減輕AS斑馬魚血管中斑塊的形成(n=6)
3.4 迷迭香酸改善AS斑馬魚的炎癥反應
通過觀察斑馬魚的中性粒細胞來反應炎癥情況。結果如圖4所示,與正常組比較,AS模型組斑馬魚出現大量的中性粒細胞。與AS模型組比較,1和10 mg/L迷迭香酸治療均能有效降低中性粒細胞數目。0.1 mg/L迷迭香酸對AS斑馬魚的中性粒細胞數量并沒有顯著影響。
3.5 迷迭香酸改善AS斑馬魚的氧化應激
通過檢測斑馬魚ROS水平來反應斑馬魚的氧化應激狀態。結果如圖5所示,與正常組比較,AS模型組斑馬魚的ROS水平顯著升高。與AS模型組比較,1和10 mg/L迷迭香酸治療均能有效降低ROS水平。0.1 mg/L迷迭香酸對AS斑馬魚的氧化應激并沒有顯著影響。
圖4 迷迭香酸降低AS斑馬魚的中性粒細胞數量(n=6)
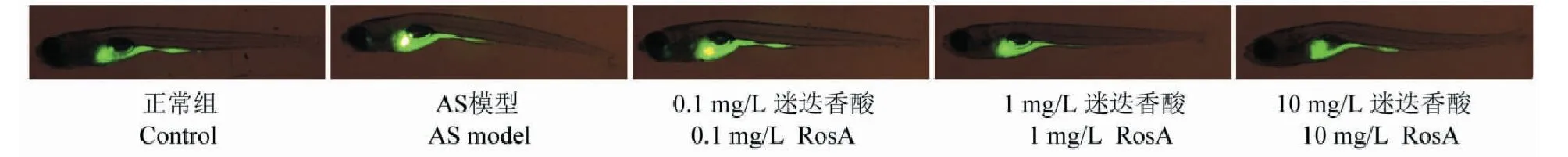
圖5 迷迭香酸降低AS斑馬魚的ROS水平(n=6)
3.6 迷迭香酸降低AS斑馬魚的血脂水平
通過尼羅紅染色觀察斑馬魚的血脂水平。結果如圖6所示,與正常組比較,AS模型組斑馬魚的血脂水平顯著升高。與AS模型組比較,1和10 mg/L迷迭香酸治療均能有效降低血脂水平。0.1 mg/L迷迭香酸對AS斑馬魚的血脂水平并沒有顯著影響。
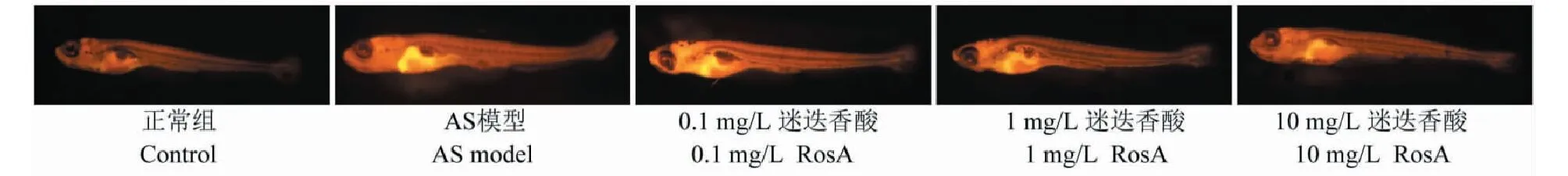
圖6 迷迭香酸降低AS斑馬魚的血脂水平(n=6)
4 討論與結論
斑馬魚是一種常見的熱帶魚,由于斑馬魚基因與人類基因的相似度達到87%,這意味著在其身上做藥物實驗所得到的結果在多數情況下也適用于人體,因此它受到生物學家的重視[14]。斑馬魚已經被用于復制多種人類疾病模型,如腫瘤、非酒精性脂肪肝、心肌缺血再灌注損傷等模型[15-17]。同樣,斑馬魚也被用于建造AS模型,目前研究發現,通過高脂喂食斑馬魚幼魚,可以促進脂質在斑馬魚血管中發生蓄積,并且研究也證明了這些蓄積的脂質與人類早期AS斑塊的成分是相似[12,13]。在本研究中,我們確實發現高脂喂食可以誘導大量的脂質蓄積在斑馬魚的血管中。這也進一步說明了通過高脂喂食建立斑馬魚AS模型是可行的。并且迷迭香酸可以顯著改善高脂喂食誘導的血管中脂質蓄積。這些結果說明,迷迭香酸可能具有治療AS作用。
研究發現,斑塊好發于血管彎曲內側或血管分叉外側,這說明流體力學在AS的發生中也起著重要的作用[18]。隨著研究的深入,研究者們發現剪切力在AS的發生中起著重要的作用[19]。剪切力是指血流與血管內皮間的摩擦所用于血管壁單位面積的力,主要分為高剪切力、低剪切力和湍流剪切力。研究發現,低剪切力會誘導血管內皮細胞功能紊亂,促進AS的發生。最近也有研究通過對斑馬魚進行剪切力檢測,并發現斑馬魚尾部靜脈處為低剪切力(見圖7),證明了斑馬魚也可以用于研究低剪切力誘導AS[20]。在本研究中,我們確實發現,脂質蓄積主要發生在斑馬魚的尾部靜脈中,并且有研究已經證實了這些蓄積在血管中的脂質與人AS斑塊發生位置是相似的[13]。這一結果也進一步說明斑馬魚AS模型是可以用于研究低剪切力誘導的AS。為了能進一步研究迷迭香酸抗AS作用與低剪切力之間的關系,我們采用平行板流動腔體外模擬低剪切力誘導血管內皮細胞功能紊亂模型。結果表明,迷迭香酸可以有效改善低剪切力誘導的血管內皮細胞功能紊亂,主要表現為降低低剪切力誘導的ROS升高、NO活性降低和血管黏附分子(ICAM-1和VCAM-1)mRNA的升高。這些結果說明,迷迭香酸的抗AS作用可能與其改善低剪切力誘導的內皮細胞功能紊亂作用有關。
中性粒細胞在AS的發生中起著重要的作用,一些血管黏附分子(ICAMs)的異常表達會造成中性粒細胞募集在血管內膜上,造成炎癥的發生,促進AS的發生[21]。在本研究中,我們發現AS斑馬魚低剪切力血管中聚集了大量的中性粒細胞,并且細胞實驗也發現了,低剪切力能誘導黏附分子高表達。這寫、些結果說明,低剪切力可能通過增加黏附分子的表達,誘導中性粒細胞向低剪切力血管處募集,誘發血管炎癥,促進AS的發生。而迷迭香酸的治療可以顯著改善這些低剪切力誘導的不良現象。這些結果也進一步說明,迷迭香酸能改善低剪切力誘導的炎癥反應。
引發AS的機制有很多,如高脂血癥、氧化應激和炎癥反應[22,23]。在本研究中,我們確實發現高脂喂食可以顯著升高斑馬魚的血脂水平,同時也誘發了氧化應激和炎癥反應。迷迭香酸治療可以顯著降低血脂水平,并改善氧化應激和炎癥反應。這些結果說明,迷迭香酸的抗AS作用可能與其降血脂、抗氧化和抗炎作用相關。
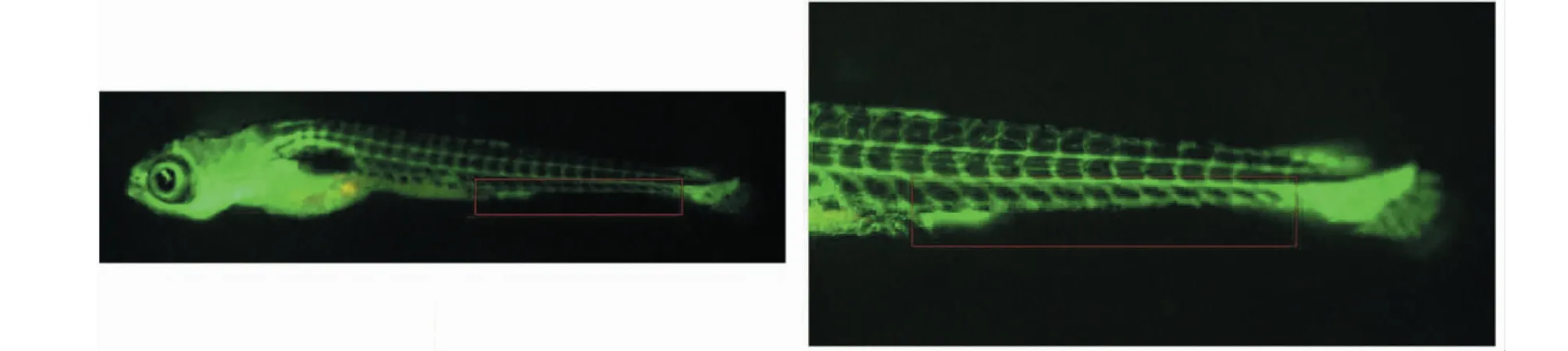
圖7 受精后15天的斑馬魚血管造影,紅色方框區域為低剪切力血流區域。
綜上所述,迷迭香酸有很好的抗AS作用,并且其抗AS作用可能與其降血脂、抗氧化、抗炎和改善低剪切力誘導血管內皮細胞功能紊亂作用相關。

