非節段型白癜風患者皮損單細胞轉錄圖譜的初步研究
林福全 洪為松 周妙妮 許文 金嶸 許愛娥
杭州市第三人民醫院皮膚科310009
通信作者:許愛娥,Email:xuaiehz@msn.com
目前認為,白癜風的發病是皮膚全層細胞群如角質形成細胞、成纖維細胞、免疫細胞等共同作用的結果[1]。既往的白癜風研究基本局限于單純黑素細胞或者共培養的黑素細胞與角質形成細胞,但這些研究不僅存在異質性,也不能充分反映白癜風皮膚原位水平的狀態和相互作用。近年單細胞轉錄組測序(scRNA?Seq)技術迅猛發展,該技術可以為每個細胞創建一個單獨的轉錄組文庫,經降維分析將文庫聚類到不同的細胞群中,更為直接地區分特定疾病中的關鍵細胞群及轉錄譜[2]。
本研究通過單細胞RNA測序對健康人和白癜風患者皮膚組織進行離散亞群鑒定和關鍵分子標注,通過尋找關鍵的細胞亞群和空間分布以及關鍵功能基因來揭示白癜風皮膚中的關鍵細胞譜系,進而了解不同病期白癜風皮損全層細胞的生理狀態。
材料與方法
一、標本收集及分離
2019 年9 月于杭州市第三人民醫院皮膚科門診收集2 例健康人(無免疫性及系統性疾病)正常皮膚和2例非節段型穩定期白癜風患者皮損標本,取材部位均為腰腹部。其中,2 例健康人均為男性,年齡26、38 歲;2 例白癜風患者亦為男性,年齡31、35 歲。本研究獲得安徽醫科大學倫理委員會批準(20170224),受試者均簽署知情同意書。對獲得的全層皮膚進行脂肪分離后放入低鈣基礎培養基中,用胰蛋白酶(美國Thermo Scientific 公司)解離成單個細胞,37 ℃下孵育15 min。用40 μm過濾器過濾解離的細胞懸液,用培養基洗滌,用死細胞去除試劑盒(美國Miltenyi 公司)在scRNA?seq測序前去除死細胞。將分選的細胞1 000 g離心3 min,并重懸于含0.04%牛血清白蛋白的磷酸鹽緩沖液中。后續細胞質檢、cDNA 片段標記及測序均在杭州聯科生物技術有限公司完成。
二、單細胞微流控擴增及高通量檢測
將皮膚細胞濃度調整至700 ~1 200 個/μl,將含有barcode信息的凝膠珠與細胞和逆轉錄及聚合酶的混合物結合,該凝膠珠被位于微流體“雙十字”系統中的油表面活性劑液滴包裹,形成油包水凝珠,流到儲液器中并被收集,凝膠乳自然溶解釋放Barcode 序列,在凝膠體體系中逆轉錄cDNA 片段,以cDNA 為模板進行PCR 擴增。將所有凝膠乳的PCR 產物混合,構建標準測序文庫。最后利用Illumina測序平臺的雙端測序模式對建好的文庫進行高通量測序。
三、基于10×Genomics高通量測序分析
利用10×Genomics 分析軟件Cell Ranger 對原始數據進行過濾、比對、定量,鑒定回收細胞,最終得到各細胞的基因表達矩陣。后續采用Seurat 軟件進一步對細胞過濾、標準化、亞群分類、各亞群差異表達基因分析及標記基因篩選。
四、統計分析
用Seurat軟件R語言模塊標識scRNA?Seq中轉錄亞群的標記基因,Wilcoxon 秩和檢驗進行測試。用richPathway ReactomePA 軟件進行GO 和KEGG途徑富集分析,獨立樣本t檢驗分析基因富集差異,對P 值進行超幾何測試和Benjamini?Hochberg 校正。用SPSS 20.0 軟件對4 個標本細胞亞群比例進行卡方檢驗。P<0.05為差異有統計學意義。
結 果
一、皮膚的單細胞檢測及細胞亞群鑒別注釋
本研究中,單細胞懸液上樣濃度為300 ~700 細胞/μl,上樣體積<10 μl,單樣本捕獲量設定為3 000個細胞,上樣細胞得率為75%~80%,細胞捕獲偏離差異系數低于8%。檢測數據具有較好的可控性和可靠性。共檢測11 000余個細胞,平均每個細胞基因檢測數為2 094。根據標記基因的注釋,共區分出19種細胞亞群,其中角質形成細胞占85%~92%,4 個標本間角質形成細胞總量占比差異無統計學意義(χ2=1.42,P >0.05)。通過注釋標記,還發現成纖維細胞、神經及黑素細胞、內皮細胞、組織干細胞以及以樹突細胞和T細胞為主的免疫細胞群,兩組間樹突細胞和T細胞為主的免疫細胞群及內皮細胞構成比差異無統計學意義(均P >0.05),組織干細胞亞群在白癜風皮損中構成比顯著低于正常皮膚(0.69%比1.34%,χ2= 6.54,P <0.05)。見圖1,表1。
二、角質形成細胞及成纖維細胞在白癜風皮損細胞亞群中的分布及定位
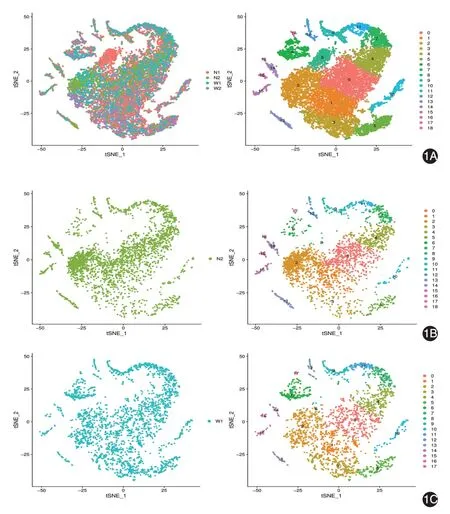
圖1 單細胞亞群分類及分布 簇號0 ~11、17分別代表角質形成細胞亞群0 ~11、12,12代表抗原提呈細胞及T細胞,13代表神經及黑素細胞,14、16分別代表組織干細胞1、2,15 代表內皮細胞,18 代表成纖維細胞。1A:每個點代表1個細胞,不同顏色表示不同樣本的細胞;左圖為正常皮膚和白癜風皮損所有細胞亞群的疊加,右圖基于所有細胞的19個亞群分布。1B、1C:分別表示正常皮膚和白癜風皮損的細胞亞群分類情況;左圖為所有細胞分布,右圖為不同細胞亞群的數量和分布
白癜風皮損成纖維細胞存在缺失和數量不足,在2 例白癜風皮損標本中均未檢測出18 號成纖維細胞,但正常皮膚中成纖維細胞比例分別為0.26%和0.65%(P <0.01)。見表1。
角質形成細胞的分布注釋和擬時序分化分析顯示,白癜風皮損中角質形成細胞亞群5、6、10、12占比均高于正常皮膚(表1),χ2值分別為216.34、284.43、23.38、68.69,均P <0.01。而且,上述4種細胞亞群在白癜風皮損中均位于角質形成細胞外圍,是成熟分化較為末端的細胞,其中角質形成細胞亞群5 和10 位于下端,6 和12 位于左上端,靠近成纖維細胞,見圖1C。
三、不同角質形成細胞亞群的標記基因表達
對不同細胞群體中上調的表達基因進行表達熱圖匯總,結果見圖2A。從不同細胞群體的前10 條標記基因表達熱圖中可以看出,不同類型的細胞亞群差異表達顯著,明亮區域的細胞雖然占比較少,但是明顯區別于其他細胞。而且,角質形成細胞與神經及黑素細胞、內皮細胞、免疫細胞等功能和分化來源完全不同。在這些角質形成細胞群中,編號較大的角質形成細胞亞群雖然占比較少,但是其顯示的標記基因表達卻更顯著和獨特,圖2A中角質形成細胞5、6、9 和10 均有超過20條以上標記基因表達,這些基因不僅數量更多,表達差異也更顯著。角質形成細胞亞群5、6、10的熱力圖見圖2B。
四、與白癜風相關的特殊功能分布的角質形成細胞群鑒別與分析
從圖3 看出,角質形成細胞亞群5 主要高表達角蛋白15(KRT15)、胞外基質蛋白(POSTN)、膠原蛋白17(COL17)以及S100A2 基因。GO 富集分析顯示,相對于其他角質形成細胞亞群,角質形成細胞亞群5細胞黏附及細胞連接功能相關的350余個基因占比高(P <0.01),同時KEGG富集分析也顯示,細胞骨架黏附及ECM 通路是主要的高表達通路(P <0.01)。
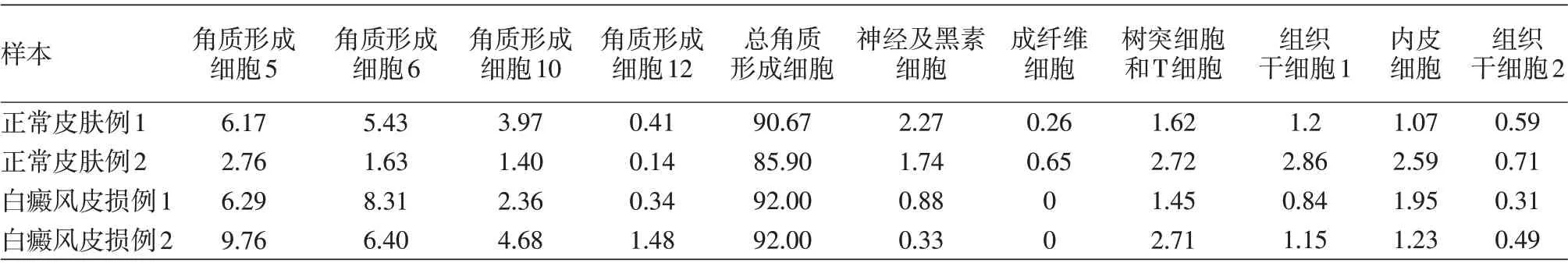
表1 正常皮膚及白癜風皮損中數量差別較大的幾組細胞亞群的細胞數占樣本中細胞總數的比例(%)

圖2 標記基因在各個細胞群體的表達差異 2A:對所有細胞亞群的前10條基因進行熱力圖繪制,圖中黃色代表基因表達水平升高,顏色的亮度代表升高的程度,黃亮度最高的區域代表對應細胞亞群中差異顯著的特異性標記基因;2B:角質形成細胞亞群5、6、10的熱力圖
角質形成細胞亞群6 特異性高表達若干個標記基因,包括分泌型卷曲相關蛋白SFRP1、縫隙連接蛋白GJB家族、SOX9、KRT6等,這些基因均與細胞分化功能相關。GO 分析顯示,該細胞群差異基因功能主要集中在細胞骨架結構、角質形成細胞分化功能以及細胞外識別傳輸及轉導功能。KEGG富集分析顯示,氧化應激通路(如白細胞介素17通路)等應激傳導通路是該群細胞主要的特征性信號通路。

圖3 角質形成細胞亞群5前10位標記基因表達分布與GO分析和KEGG分析 3A:單基因在單細胞水平細胞亞群中的表達絕對量和豐度;3B:在細胞亞群及總細胞群中的表達分布及表達水平 tSNE,t-分布隨機近鄰嵌入;3C:差異基因GO富集性散點圖,富集率(rich factor)表示位于該GO功能的差異基因個數與總基因數的比值,富集率越大,GO富集程度越高;3D:KEGG富集分析,富集率表示位于該KEGG通路的差異基因數與總基因數的比值,富集率越大,KEGG富集程度越高
角質形成細胞亞群10高表達垂體瘤轉化基因1(PTTG1,可抵抗紫外線誘導的細胞凋亡作用并與細胞增殖、細胞轉化有關),此外還特異性高表達CENPF(與細胞惡性分化相關)、高遷移率族蛋白B2(HMGB2)、拓撲異構酶2A(TOP2A)、泛素偶聯酶E2C(UBE2C)基因。GO 分析顯示,其主要與細胞內穩態、染色體以及RNA/DNA 的結合表達功能相關;KEGG 富集分析顯示,富集通路主要集中在細胞周期與DNA 修復通路。而且,與其他角質形成細胞亞群相比,角質形成細胞亞群10 顯示出HMGB家族基因的集體高表達,如HMGB1/2/3基因差異檢驗顯示,t值分別為156.32、356.68、34.74,均P <0.01。
討 論
本研究中,每個細胞平均檢測2 094個基因,與以前的單細胞RNA 序列研究[3]相一致。我們在前期臨床研究中發現,白癜風白斑部位角質形成細胞存在易消化、難培養、難傳代的特點,白斑表皮片存在韌性不足的問題。單細胞轉錄數據顯示,角質形成細胞通過增殖和分化可以分別構成屏障層、毛囊和皮脂腺,且許多不同基因的豐度在細胞分化過程中波動,從而形成具有獨特的轉錄譜特征的細胞亞群[4]。我們通過建立正常皮膚和白癜風白斑的單細胞轉錄組圖譜,以期為深刻認識和理解白癜風奠定基礎。
本研究對皮膚細胞亞群的鑒別和注釋參考傳統皮膚細胞分類法進行,所得細胞亞群主要包括角質形成細胞、成纖維細胞、神經及黑素細胞、內皮細胞、組織干細胞、以樹突細胞和T 細胞為主的免疫細胞群等,其中,白癜風皮損標本未見成熟分化的成纖維細胞群,未成熟分化的干細胞亞群差異在兩組間不顯著。就白癜風發病機制而言,缺失的這一小部分成纖維細胞是否是發病的關鍵值得進一步研究。研究者通過觀察非皮損部位成纖維細胞特征發現,白癜風患者成纖維細胞分化為肌成纖維細胞,且α 平滑肌肌動蛋白高表達,胞內活性氧過度積累。此外,細胞體積增大,黏附蛋白增加,與黑素細胞和角質形成細胞一樣呈現衰老表型[5]。結合本研究結果,推測白癜風白斑部位的成纖維細胞缺失對皮膚微環境的滋養和修復功能障礙可能是影響白癜風發病的重要環節。本研究中未在白癜風皮損處發現成纖維細胞,也可能與取材方法和檢測技術有關。
此外,通過對細胞數量最多的角質形成細胞進行亞群分類及注釋,我們發現,在總細胞比例不變的情況下,部分角質形成細胞亞群在白癜風皮損組織中占優勢,如角質形成細胞亞群5、6、10、12,這幾組細胞亞群不僅在白癜風中數量居多,在t 分布隨機鄰居嵌入(tSNE)分布圖上也遠離主角質形成細胞群,且都標記基因,例如角質形成細胞亞群5高表達KRT15、POSTN、COL17 以及S100A2 基因,亞群6 特異高表達SFRP1、GJB家族、SOX9及KRT6基 因,亞 群10 高 表 達PTTG1、CENPF、HMGB2、TOP2A、UBE2C基因。這幾群細胞正是由于有獨特的表達特征譜,不僅在角質形成細胞分化程度上不同于其他細胞,其功能也與白癜風疾病發生、發展關系密切。角質形成細胞亞群5 與細胞黏附功能最為密切,角質形成細胞亞群6與細胞應激水平相關,角質形成細胞亞群10 與細胞周期和內穩態關系緊密。有研究顯示,白癜風患者來源的角質形成細胞具有凋亡傾向,細胞因子分泌異常可能與局部黑素細胞缺失相關[1]。還有研究顯示,白癜風患者角質形成細胞鈣攝取能力下降,細胞生存時間縮短,衰老標志分子高表達,不能通過共培養維持黑素細胞生長[6]。結合上述研究,推測異常的角質形成細胞在白癜風患者角質形成細胞總數中占比可能不到20%,但是其異常狀態與白癜風發病及進展密切相關,例如角質形成細胞亞群6。
本研究表明,角質形成細胞亞群5和10位置相連,表達譜相似并且重疊較多,角質形成細胞亞群10 的HMGB 家族特異性高表達可能和亞群5 的黏附功能密切相關。核蛋白高遷移率族蛋白超家族的生物學功能主要調節DNA復制、轉錄、重組和修復等,是真核細胞基因調控的動力體現者,它們在染色質的結構與功能及基因表達調控過程中均發揮重要作用。有報道外部刺激如氧化應激和強烈的紫外線照射會引發角質形成細胞釋放HMGB1,HMGB1 的升高觸發自分泌HMGB1 易位和黑素細胞抗原的釋放,抑制Nrf2 和下游抗氧化基因的表達,誘導黑素細胞凋亡,參與促進樹突細胞的成熟和活化,從而參與白癜風的病理過程,促使白癜風發病[7?8]。此外,白癜風皮損中HMGB1表達較正常皮膚更高,且與疾病活動性相關[9]。此外紫外線及UVB照射均能有效激活表皮細胞HMGB家族的表達。
最新研究顯示,除了黑素細胞,白癜風患者的角質形成細胞膜上E鈣黏蛋白也存在表達異常,并且E 鈣黏蛋白的表達量與白癜風的疾病活動度密切相關[10]。由此可見,E鈣黏蛋白在白癜風的發病中具有重要作用,但導致E鈣黏蛋白功能異常的誘發因素以及其參與黑素細胞發病的具體作用機制罕見報道。對于這些角質形成細胞亞群的其他基因組表達水平和功能以及和不同細胞間相互作用的方式和關系有待深入探索,對于白癜風皮損單細胞轉錄組水平的結果也有待進一步驗證和挖掘。本研究的樣本量較小,只比較了2例白癜風皮損和正常對照皮膚,因此結果比較初步,有一定的局限性。
利益沖突 所有作者均聲明不存在利益沖突

