黃芪加味湯防治乳腺癌術后芳香化酶抑制劑相關骨丟失
薛 亭,瞿文超,馮佳梅,高晴倩,邵士珺,萬 華
(上海中醫藥大學附屬曙光醫院乳腺科,上海 201203)
第三代芳香化酶抑制劑(aromatase inhibitors,AIs)是目前臨床激素受體陽性的絕經狀態乳腺癌患者的首選內分泌治療藥物。與他莫昔芬(Tamoxifen,TAM)相比,AIs 能明顯降低患者的復發風險,提高患者的無病生存期及總生存率[1-4]。但AIs 也加速了骨成分的丟失,嚴重影響患者生活質量和服藥依從性。這種由AIs 引起的骨代謝異常、骨密度下降、全身關節酸痛、骨質疏松癥和骨折風險升高等,被稱為芳香化酶抑制劑相關骨丟失(aromatase inhibitor-associated bone loss,AIBL)[5]。黃芪加味湯臨床用于乳腺癌術后關節酸痛、骨質疏松癥的患者,是上海中醫藥大學附屬曙光醫院萬華教授在多年臨證中的經驗總結,方選結合上海市名老中醫陸德銘教授“乳癌術后方”。本研究通過隨機對照的方法,探究絕經狀態乳腺癌術后服用AIs 的患者應用黃芪加味湯干預治療骨密度、骨質疏松癥發生率、骨疼痛等級、生活質量評分及服藥依從性評分的變化。
1 資料與方法
1.1 一般資料 納入2016 年8 月-2019 年1 月在上海中醫藥大學附屬曙光醫院乳腺科、上海交通大學附屬瑞金醫院乳腺疾病診治中心就診的乳腺癌術后應用AIs(來曲唑)行內分泌治療的患者,共120 例,按照隨機數字表分為2 組,其中治療組59 例,對照組61例。治療6 個月,隨訪發現有5 人骨密度診斷為骨質疏松癥,其中治療組2 人,對照組3 人。根據指南要求,骨質疏松癥患者需使用骨代謝類藥物,故此類患者終止試驗,僅納入一般資料和骨質疏松發生率數據。治療組59 例,平均年齡(61.86±6.60)歲,平均絕經年齡(51.36±2.97)歲,體質量指數(24.48±3.43);對照組61 例,平均年齡(61.59±6.02)歲,平均絕經年齡(51.70±3.36)歲,體質量指數(24.46±2.69)。2 組患者一般資料組間比較差異無統計學意義(P >0.05)。
1.2 診斷標準
1.2.1 原發性乳腺癌 經病理學檢查,明確診斷為乳腺惡性上皮性腫瘤,即乳腺癌。
1.2.2 絕經后狀態 參照2018 版《NCCN 乳腺癌臨床實踐指南》[6]:1)雙側卵巢切除術后;2)年齡≥60 歲;3)年齡<60 歲,沒有化療或服用卵巢抑制藥物閉經達12 個月以上,且卵巢刺激激素和雌二醇水平處于絕經后范圍。
1.2.3 激素受體陽性 激素受體陽性是指雌激素受體/孕激素受體陽性,診斷標準參照2010《美國臨床腫瘤學會/美國病理學家學會乳腺癌激素受體免疫組化檢測指南建議》[7]:標本經免疫組化檢測示腫瘤細胞核著色的比例大于1%,則確定為陽性。
1.2.4 骨質疏松癥 參照國內外骨質疏松癥指南及世界衛生組織制定的骨質疏松癥診斷標準[8-9]:1)正常:T 值≥-1.0 標準差(SD);2)骨量減少:-2.5 <T 值<-1.0 SD;3)骨質疏松癥:T 值≤-2.5 SD;4)嚴重骨質疏松癥:T 值≤-2.5 SD,且合并脆性骨折。
1.3 納入及排除標準
1.3.1 納入標準 1)臨床分期為I-III 期的絕經后乳腺癌術后患者,激素受體陽性;2)術后擬接受AIs(來曲唑)治療;3)患者的全身狀態符合美國東部腫瘤協作組織制定的體能狀態評分0~2 分;4)患者知情同意,愿意接受治療觀察和各項檢查。
1.3.2 排除標準 1)除服用AIs,還使用其他抗腫瘤藥物;2)患有其他惡性腫瘤或影響骨代謝的相關性疾病;3)經DXA 射片,CT、ECT、MRI 等并結合臨床證實存在復發轉移;4)骨質疏松癥患者;5)伴有嚴重心、腦、腎等疾病者。
1.3.3 終止標準 1)隨訪中,患者出現了復發、轉移;2)隨訪中,患者骨密度檢測T 值≤-2.5 SD。
1.4 治療方法 所有患者每日服用來曲唑2.5 mg,鈣爾奇D(含鈣元素600 mg 和VitD3125 IU,惠氏制藥有限公司生產,生產批號H10950029)1 片。治療組患者在此基礎上加服黃芪加味湯(黃芪30 g,熟地黃15 g,山藥15 g,山茱萸9 g,澤瀉15 g),每日1 劑,早晚飯后0.5 h 溫服。每6 個月為1 個療程,觀察2 個療程。
1.5 觀察指標及檢測方法
1.5.1 骨密度測定 應用GE lunar 雙源X 線骨密度儀分別測量治療前及治療6 個月、12 個月的患者第1~4腰椎(L1—L4)、股骨頸和全髖骨密度。
1.5.2 骨質疏松癥發生率 分別計算治療組和對照組治療6 個月、12 個月的骨質疏松癥發生率。
1.5.3 骨疼痛等級 采用世界衛生組織口述等級量表(VRS)進行評價[10]。0 級:無疼痛;I 級(輕度疼痛):患者疼痛,但能忍受,不影響其正常生活和睡眠;II級(中度疼痛):患者感到疼痛明顯,不能忍受,要求服用止痛藥,睡眠受到干擾;III 級(重度疼痛):疼痛劇烈,不能忍受,需用止痛劑,睡眠受到嚴重干擾,可伴有植物神經功能紊亂或被動體位。
1.5.4 生活質量評分 采用由美國結局與教育中心研制出的乳腺癌患者生活質量測定表FACT-B 量表[11-12]。分別從生理狀況、社會/家庭狀況、情感狀況、功能狀況、附加關注部分測評。
1.5.5 服藥依從性評分 采用Morisky 治療依從性量表(8-item Morisky medication adherence scale,MMAS-8)[13-14]對患者進行評估。MMAS-8 量表總分為8 分,8 分為依從性高,6~8 分為依從性中等,<6 分為依從性低。
1.6 數據處理 應用SPSS 25.0 統計學軟件進行統計描述和分析。
2 結果
2.1 骨密度 經廣義估計方程分析,2 組患者L1—L4、股骨頸、全髖骨密度組間Wald χ2分別為2.610、0.118、0.054,P值分別為0.106、0.732、0.816,結合秩和檢驗,尚不能認為2 組患者L1—L4、股骨頸、全髖骨密度在各時間點存在差異,見表1。
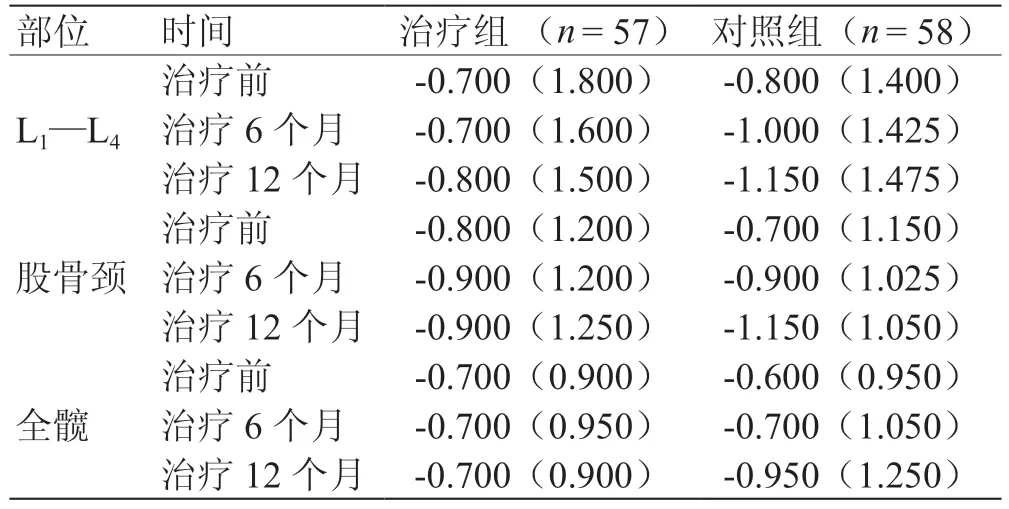
表1 2 組患者骨密度比較 M(MQ)
2.2 骨質疏松癥發生率 治療6 個月、12 個月,治療組骨質疏松癥發生率分別為3.39%、1.76%,對照組分別為4.91%、3.45%。經秩和檢驗,2 組患者治療前、治療6 個月、治療12 個月骨質疏松癥發生率組間差異均無統計學意義,尚不能認為2 組骨質疏松癥發生率有不同,見表2。
2.3 骨疼痛等級 經秩和檢驗,2 組患者治療6 月和治療12 個月的骨疼痛等級,組間比較差異均有統計學意義,結合平均秩次,對照組骨疼痛更顯著,見表3。
2.4 生活質量評分 經重復測量方差分析,球形檢驗W=0.748,P<0.001,2 組的組間變異P<0.001,差異有統計學意義,可認為生活質量評分的變化可因組別不同而發生改變。經t檢驗,治療前2 組患者生活質量評分組間比較差異無統計學意義,組間均衡;治療6 個月和治療12 個月,組間對比差異有統計學意義,結合平均值,治療組患者生活質量評分高于對照組,見表4。
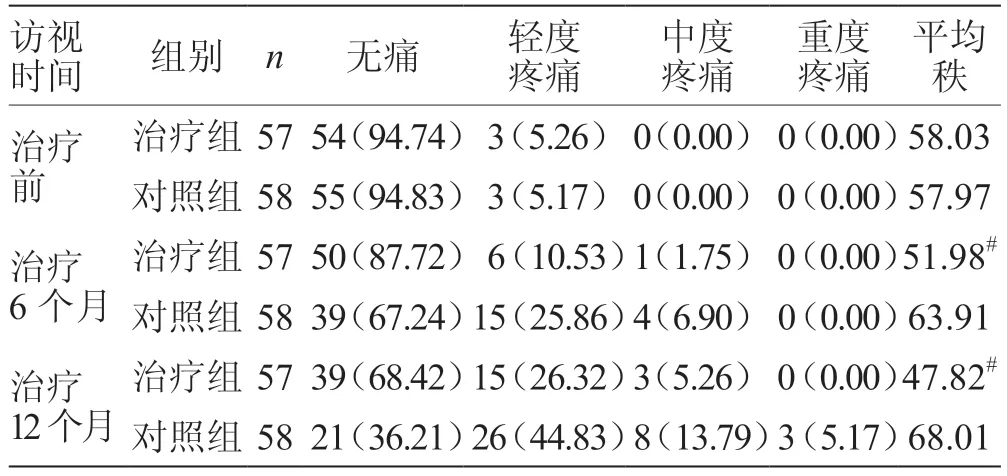
表3 2 組患者骨疼痛等級 例(%)

表4 2 組患者生活質量評分比較
2.5 服藥依從性評分 經廣義估計方程分析,2 組患者服藥依從性評分組間Wald χ2=3.955,P=0.047,可認為2 組患者服藥依從性組間差異有統計學意義。結合秩和檢驗,2 組患者治療12 個月服藥依從性評分P=0.019,組間比較差異有統計學意義,根據平均秩次,認為治療組服藥依從性高于對照組,見表5。
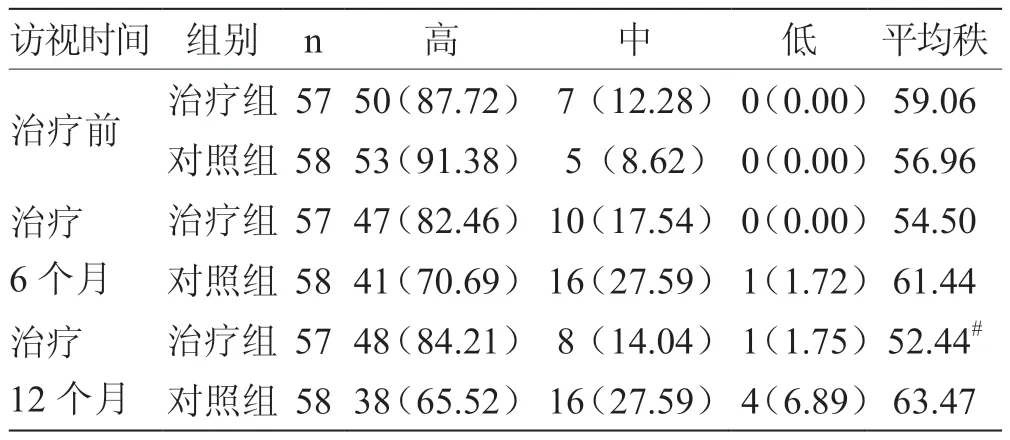
表5 2 組患者服藥依從性評分 例(%)
3 討論
乳腺癌占全球女性腫瘤發病率的29%,且在我國呈上升趨勢[15]。據上海市疾病預防控制中心2018 年公布的數據顯示:上海市乳腺癌發病率為46.95/10 萬,其中60%~70%患者為激素受體陽性,2/3 激素受體陽性的患者處于絕經后狀態[16]。隨著醫學研究的進步,乳腺癌的治療呈現多元化,術后放療、化療、內分泌治療、分子靶向治療等綜合應用使乳腺癌患者的生存期得到了明顯的延長。在乳腺癌的綜合治療中,內分泌治療已成為乳腺癌綜合治療的重要組成部分。以美國國家癌癥綜合網(National Comprehensive Cancer Network,NCCN)指南和瑞士St1Gallen 乳腺癌會議為代表,已達成乳腺癌內分泌治療的專家共識,將第3代AIs 作為激素受體陽性的絕經后乳腺癌患者的首選內分泌用藥,推薦用藥時間為5~10 年[17-18]。
芳香化酶屬于細胞色素P450 酶復合體,存在于卵巢、肝臟等組織中,可將雄激素的A 環芳香化,促使雄烯二酮等雄激素轉化為雌酮與雌二醇[19]。AIs 通過抑制芳香化酶,降低睪酮、雄烯二酮向雌酮與雌二醇轉化,減少血清雌激素水平,達到治療激素受體陽性乳腺癌的目的,但同時也破壞了骨形成和骨丟失之間的平衡,加速了骨量下降,導致骨代謝異常。多個大型研究已證實,對于激素受體的陽性的絕經后乳腺癌患者,5 年的AIs 優于5 年的TAM,但服用AIs 的骨質疏松癥風險也高于TAM[1,3-4,20],嚴重影響患者的生活質量及服藥依從性。指南[21-22]中指出,接受AIs 治療的乳腺癌患者應鼓勵體育鍛煉,并每日補充維生素D及鈣劑,若患者骨密度的T 值<-2.5 SD 則推薦雙磷酸鹽治療。
在防治骨代謝異常方面,中醫藥具有一定的優勢。中醫認為人是有機的整體,“成骨”與“破骨”同陰陽對立存在,當陰陽失衡,則導致骨丟失。中醫將這種骨丟失歸為“骨枯”“骨痹”“骨瘺”的范疇,治療多從“補腎”入手。萬華教授通過觀察臨床患者癥狀及體征,辨證以“脾氣虧虛、肝腎不足”為主,故治法以“益氣健脾,滋補肝腎”以補骨。萬華教授經驗結合上海市名中醫陸德銘教授治療乳腺癌術后的經驗方“乳癌術后方”,最終化裁黃芪加味湯:黃芪30 g,熟地黃15 g,山藥15 g,山茱萸9 g,澤瀉15 g。方以熟地黃、黃芪同為君藥,重用黃芪,補氣、生津養血;熟地黃,補血滋陰,填精益髓;臣以山藥雙補脾腎,既補脾氣,又固腎精;山茱萸,補養肝腎,并能澀精;腎為水臟,又陰虛而火動,《醫方論》有云:“有熟地黃之膩補腎水,即有澤瀉之宣泄腎濁以濟之”,故佐澤瀉利水滲濕泄熱之品,同時,瀉相火保真陰。全方補中有瀉,以補為主,肝脾腎三臟三陰皆補,尤以腎陰為重,且方中僅澤瀉一味“瀉藥”,使得大量的滋補藥補而不滯,動靜結合。此方雖藥味不多,但方小而精,其“益氣健脾、滋補肝腎”的治法與骨質疏松癥“脾腎虧虛”的病因病機相合。
本研究結果顯示,治療12 個月后,2 組骨密度差異無統計學意義(P>0.05);但治療組骨疼痛級別明顯下降,生活質量及服藥依從性顯著提升,差異均有統計學意義(P<0.05)。以上研究結果提示,黃芪加味湯有降低芳香化酶抑制劑引起的骨密度下降的趨勢,可有效改善AIs 帶來的關節不利、晨僵、全身酸痛等臨床癥狀,明顯優化患者的生活質量,提高患者的服藥依從性。本研究中,隨訪骨密度組間差異雖無統計學意義,但治療組骨密度較對照組有下降緩慢趨勢,推測可能因骨密度變化緩慢,隨訪時間短,未出現明顯差異,故本課題將繼續隨訪,進一步觀察黃芪加味湯對骨密度的影響,為指導臨床用藥提供依據。

