利拉魯肽提高肥胖不孕多囊卵巢綜合征婦女臨床妊娠率的研究
郝建民,盧 濤,邱 娟,張 鑫,李春紅,孟憲英
0 引言
多囊卵巢綜合征(Polycystic ovary syndrome,PCOS)是無排卵不孕的最常見病因,超過20%的育齡婦女受到PCOS疾病影響[1-2]。近一半PCOS女性患者超重或肥胖。肥胖對體外受精(In vitro fertilization,IVF)結果的影響還不清楚,但大量研究表明,PCOS患者的植入率、臨床妊娠和分娩率較低,流產率較高,可收集和受精的卵母細胞更少、周期更長、需要較高劑量的促性腺激素[3-8]。IVF術前減重與妊娠率(Pregnancy rates,PR)和活產率顯著提高密切相關,進行減重干預可減少妊娠所需的IVF周期數,改善孕前的生活方式也可改善后代的長期健康狀況。專家建議將改變生活方式作為肥胖不孕的PCOS女性的一線治療方案,而克羅米芬檸檬酸鹽(Clomiphene citrate,CC)仍然是誘導排卵的二線治療方法[9]。與CC相比,二甲雙胍在改善患者排卵率、妊娠率、活產率、流產率和多胎妊娠率方面療效較差。而二甲雙胍與CC聯合用藥對體重指數(Body mass index,BMI)>35 kg/m2的患者療效更佳。長效胰高血糖素樣肽-1(Glucagon-like peptide-1,GLP-1)受體激動劑(Receptor agonist,RA)利拉魯肽對肥胖PCOS女性的減重和血糖穩態有積極的促進作用。與二甲雙胍單獨給藥和改變生活方式相比,利拉魯肽與二甲雙胍聯合用藥可帶來更顯著的減重效果[10-12]。其減重機制既包括直接作用患者下丘腦而減少食物攝入,也可以通過自主神經系統介導的中樞作用延遲胃排空。關于利拉魯肽對PCOS肥胖患者IVF結果影響的研究較少。利拉魯肽是一種有效的胰島素增敏劑,動物實驗表明,GLP-1通過激素釋放進行神經內分泌調節,進而起到影響患者下丘腦-垂體-卵巢軸的作用[13-14]。因此,本研究采用前瞻性、隨機、對照方法,評價利拉魯肽與二甲雙胍聯合給藥和二甲雙胍單獨給藥,對通過改變生活方式減重效果較差的PCOS不孕患者臨床妊娠率及累計妊娠率的影響,同時比較兩種用藥方法對卵母細胞和胚胎質量、減重以及代謝和內分泌指數的影響。
1 資料與方法
1.1 研究對象 選取2017年6月至2018年12月在我院治療的186例PCOS肥胖不孕患者。診斷標準:根據ESHRE/ASRM在2003年制定的鹿特丹標準對PCOS進行診斷,即下列3項標準具備2項即可診斷為PCOS:①臨床或實驗室指標表現高雄激素血癥,包括多毛、脫發及痤瘡等;②盆腔超聲或陰道超聲檢查有卵巢多囊性改變;③閉經或月經稀發。納入標準:①符合上述PCOS診斷標準;②BMI≥30 kg/m2;③年齡≤38歲;④患者第1次或第2次進行IVF治療,并均經一線減重治療失敗;⑤男方無嚴重的不育癥。排除標準:①1型或2型糖尿病患者;②有癌癥病史的患者;③個人或家族有多發性內分泌腺瘤病2型病史的患者;④嚴重的心血管、腎臟或肝臟疾病患者;⑤研究前90 d使用除二甲雙胍以外的已知或懷疑會影響生殖、代謝功能的藥物或他汀類藥物患者;⑥子宮內膜異位癥Ⅲ級與Ⅳ級、卵巢低儲備、卵巢早衰患者;⑦產生高雄激素及高泌乳素的其他內分泌疾病患者;⑧不能耐受妊娠及有嚴重內外科疾病不適宜接受促排卵治療的患者。本研究經過我院倫理委員會的批準同意,患者或家屬均簽署了知情同意書。
1.2 治療方法 根據隨機數字表法,將186例患者分為聯合用藥組(聯合組)與二甲雙胍組,每組93例。二甲雙胍組服用二甲雙胍片(石家莊以嶺藥業股份有限公司,批準文號:國藥準字H20054790)治療,初始劑量500 mg/次,1次/d,3 d后增加至1 000 mg,2次/d。聯合組在對照組治療的基礎上,加用利拉魯肽(丹麥諾和諾德公司,注冊證號:國藥準字J20160037)皮下注射治療,初始劑量為0.6 mg,1次/d,3 d后增加至1.2 mg。所有患者均治療12周。研究開始時對所有患者進行積極生活方式干預。要求患者降低食物熱量至500~800 kcal/d,食物中超過50%為低血糖指數碳水化合物,20%蛋白質和30%單不飽和脂肪和多不飽和脂肪,飽和脂肪含量低于10%。鼓勵患者每天增加纖維、全谷物、谷物、水果和蔬菜攝入,并進行每天至少30 min中等強度的身體活動。在藥物治療1個月后給予患者IVF手術。
1.3 IVF治療 以GnRH-A短方案作為患者的促排卵方案。根據患者的年齡、基礎卵泡刺激素、基礎卵泡數給予患者果納芬150~225 IU/d皮下注射,當優勢卵泡直徑達到14 mm時,給予患者西曲瑞克(Merck Serono Europe Limited,批準文號:注冊證號 H20140476)皮下注射,劑量0.25 mg/d,直至人絨毛膜促性腺激素(Human chorionic gonadotropin,HCG)注射日。通過B超監測患者卵泡直徑和數量,如果直徑為16~18 mm的卵泡數量>3個,則停止注射GnRH-A。給予患者HCG肌注治療,劑量5 000~10 000 IU,34~36 h后在陰道超聲引導下進行穿刺取卵,受精2~3 d后在超聲引導下取出1~5個優質胚胎,并經宮頸進行胚胎移植(Embryo transfers,ET)。移植后給予患者注射黃體酮以進行黃體支持,劑量60 mg/d。移植2周后抽血HCG或驗尿以確定患者是否妊娠,臨床妊娠是指胚胎移植6~7周后采用B超見到患者原始胎心管搏動或孕囊。
1.4 指標檢測 收集患者的臨床資料,包括患者在基線期的不孕史數據,基線期與治療后的人體測量參數、內分泌參數、體脂分布參數及治療后的IVF結果。基線期不孕史數據包括年齡、不孕期、既往CC與芳香酶抑制劑(Aromatase inhibitors,AI)用藥史、腹腔鏡治療史;人體測量參數包括體重、BMI、腰圍、內臟脂肪質量、體積及面積。代謝參數包括穩態模型胰島素抵抗指數(Homeostasis model assessment-insulin resistance,HOMA-IR)、空腹血糖、餐后2 h血糖、空腹胰島素、餐后2 h胰島素。內分泌參數包括游離睪酮(Free testosterone,FT)、總睪酮(Total testosterone,TT)、性激素結合球蛋白(Sex hormone-binding globulin,SHBG)及雄烯二酮。采用雙能量X射線骨密度儀(Dual energy X-ray absorptiometry,DXA)測量患者脂肪含量。采用標準葡萄糖氧化酶法測定患者血糖,采用免疫放射測定法測量患者胰島素水平。HOMA-IR=空腹血糖(mmol/L)×空腹胰島素(mU/L)/22.5。糖耐量受損(Impaired glucose tolerance,IGT)是指口服葡萄糖耐量試驗(Oral glucose tolerance test,OGTT)2 h后血漿血糖值為7.8~11.1 mmol/L。采用西門子Immulite 2000分析儀測定FT、TT、SHBG、雄烯二醇及胰島素水平。成熟卵母細胞是指減數分裂中期Ⅱ(MⅡ)卵母細胞,主要表現為出現卵周隙,胞質均勻,可見第一極體。未成熟卵母細胞是指生殖泡卵母細胞和減數分裂數分裂中期Ⅰ(MⅠ)卵母細胞。受精率=受精數/獲卵數,卵母細胞閉鎖率=退化卵母細胞數/獲卵數,卵母細胞未成熟率=未成熟卵母細胞數/獲卵數,囊胚形成率=形成的囊胚數/轉入囊胚培養的胚胎數,胚胎種植率=著床胚胎數/移植胚胎數,根據Gardner囊胚分級系統對形成的囊胚進行分級。妊娠診斷在HCG給藥14 d后通過β-HCG血清測定,在ET 4周后通過經陰道超聲檢查來進行。臨床妊娠率=臨床妊娠周期數/移植周期數。累計妊娠率=所有妊娠患者數量/患者總數。治療結束后,對患者進行12個月隨訪,記錄患者自然妊娠情況。
2 結果
2.1 兩組患者人口特征與基線結果比較 共納入186例不孕的PCOS患者,患者年齡27~38歲,平均(30.7±4.3)歲,患者不孕期平均(54.6±22.3)個月,所有患者均經一線減重治療失敗。二甲雙胍組與聯合組患者基線期人體測量參數、代謝參數、內分泌參數、不孕史比較差異無統計學意義(P>0.05),具有可比性。見表1~表3。
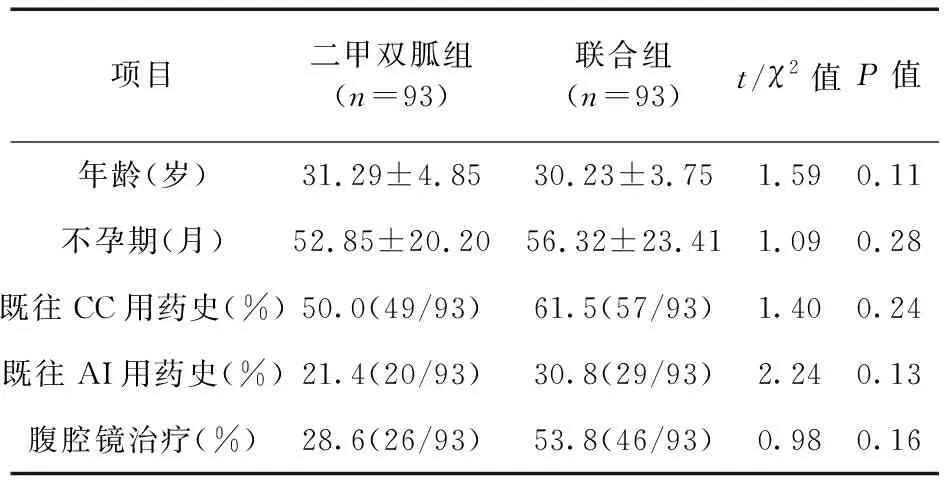
表1 兩組患者不孕史比較
2.2 兩組患者人體測量參數變化比較 治療后,聯合組與二甲雙胍組患者體重均較基線期顯著降低,差異有統計學意義(t=2.65,P<0.01;t=4.05,P<0.01)。二甲雙胍組和聯合組患者體重分別下降(5.98±5.03)kg和(7.52±3.90)kg。與二甲雙胍組比較,聯合組患者體重較基線降低值顯著提高,差異有統計學意義(t=2.33,P=0.02)。186例患者中,有117例(62.9%)患者是3個月內減重超過5%的高反應者[聯合組64例(68.8%),二甲雙胍組53例(57.0%),χ2=2.79,P=0.10]。沒有患者體重增加。見表2。
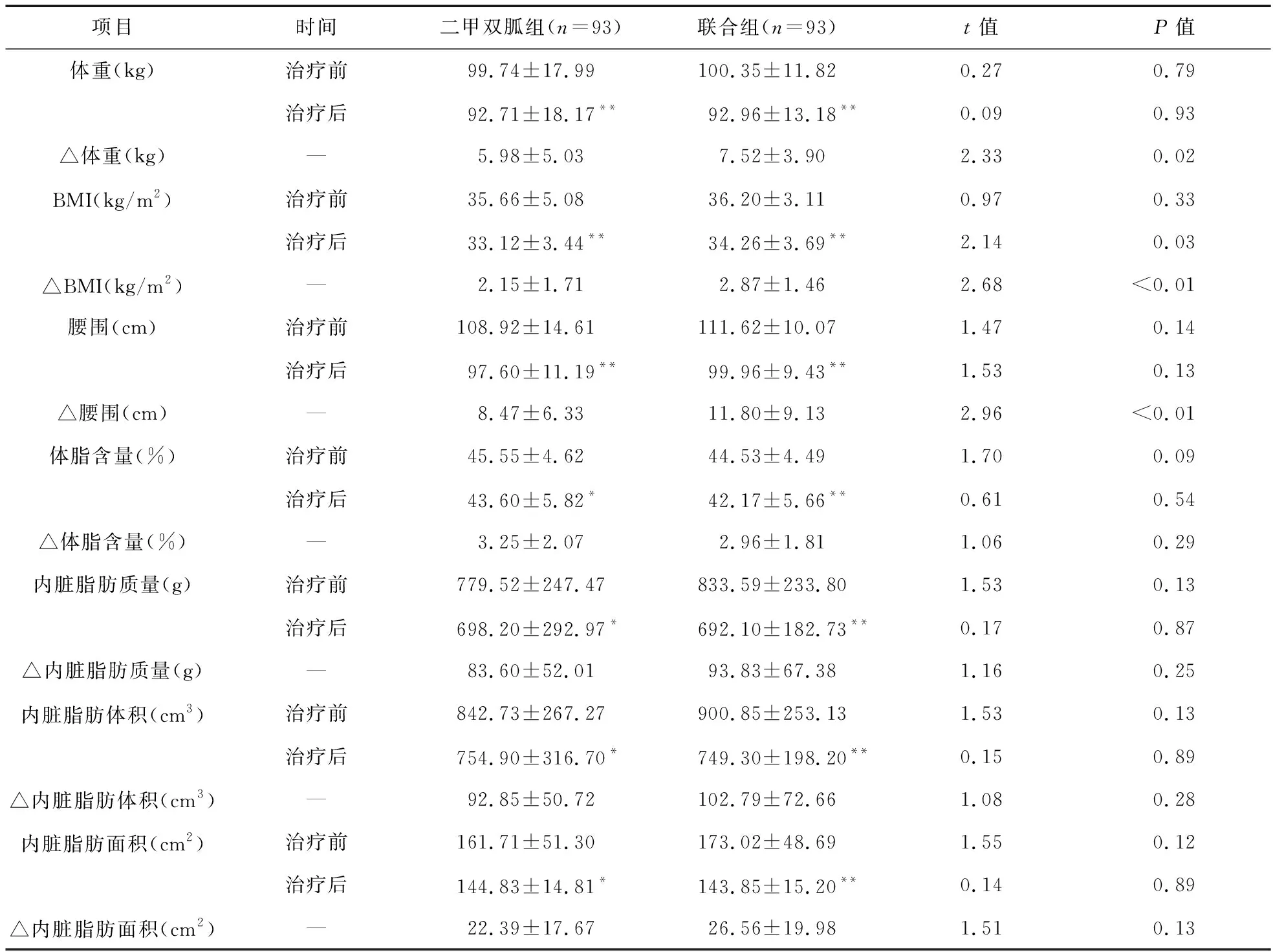
表2 兩組患者基線期和治療后的人體測量特征比較
注:與治療前比較,*P<0.05,**P<0.01
治療后,二甲雙胍組和聯合組患者BMI與腰圍均較治療前顯著降低,差異有統計學意義(P<0.05)。二甲雙胍組和聯合組患者BMI分別降低(2.15±1.71)kg/m2和(2.87±1.46)kg/m2,聯合組患者BMI降低值較二甲雙胍組顯著提高,差異有統計學意義(t=2.68,P<0.01)。治療后,二甲雙胍組和聯合組患者腰圍值分別降低(8.47±6.33)cm和(11.8±9.13)cm,聯合組患者腰圍降低值較聯合組顯著提高,差異有統計學意義(t=2.96,P<0.01)。見表2。 DXA測量結果表明,兩組患者內臟脂肪含量、體積和面積均較治療前顯著降低,差異有統計學意義(P<0.05)。在3個月時,兩組的平均內臟脂肪組織面積均降至160 cm2以下,二甲雙胍組與治療組內臟脂肪組織面積平均值分別為(144.83±14.81)cm2與(143.85±15.20)cm2,160 cm2是與女性心血管疾病的高風險閾值。
2.3 兩組患者代謝參數變化比較 在研究開始時,35例(二甲雙胍組13例,聯合組22例)患者發生IGT。治療后,聯合組有21例患者對葡萄糖負荷的反應恢復正常。治療后,聯合組HOMA-IR指標較治療前顯著降低,差異有統計學意義(t=2.19,P=0.03)。與二甲雙胍組比較,聯合組HOMA-IR指標差值大于二甲雙胍組,差異有統計學意義(t=2.47,P=0.02)。 治療后,聯合組空腹血糖和餐后2 h血糖均較治療前顯著降低,差異有統計學意義(t=3.80、2.66,P<0.01)。與二甲雙胍組比較,聯合組空腹血糖和餐后2 h血糖差值大于二甲雙胍組,差異有統計學意義(t=9.15,t=8.63,P<0.01)。見表3。
2.4 兩組患者內分泌參數變化比較 治療后,二甲雙胍組與聯合組患者的SHBG均較治療前顯著提高,差異有統計學意義(t=2.30,P=0.03;t=2.72,P<0.01),但兩組SHBG差值比較差異無統計學意義(t=1.85,P=0.07)。見表3。
2.5 兩組患者妊娠和IVF參數 聯合組中93例患者有64例(68.8%)在1年內妊娠。7例患者在治療后立即自然妊娠,42例在IVF手術后妊娠,15例在IVF失敗后自然妊娠。二甲雙胍組93例患者有35例(37.6%)在1年內妊娠,6例在治療后立即妊娠,14例在接受IVF手術后妊娠,15例在IVF失敗后自然妊娠。與二甲雙胍組比較,聯合組的臨床妊娠率(χ2=30.42,P<0.01)和累計妊娠率(χ2=18.16,P<0.01)顯著提高,差異有統計學意義。但兩組間總Gn劑量、獲卵數、成熟、受精和退化的卵母細胞數、胚胎數、第5天胚胎數比較差異無統計學意義(P>0.05)。見表4。
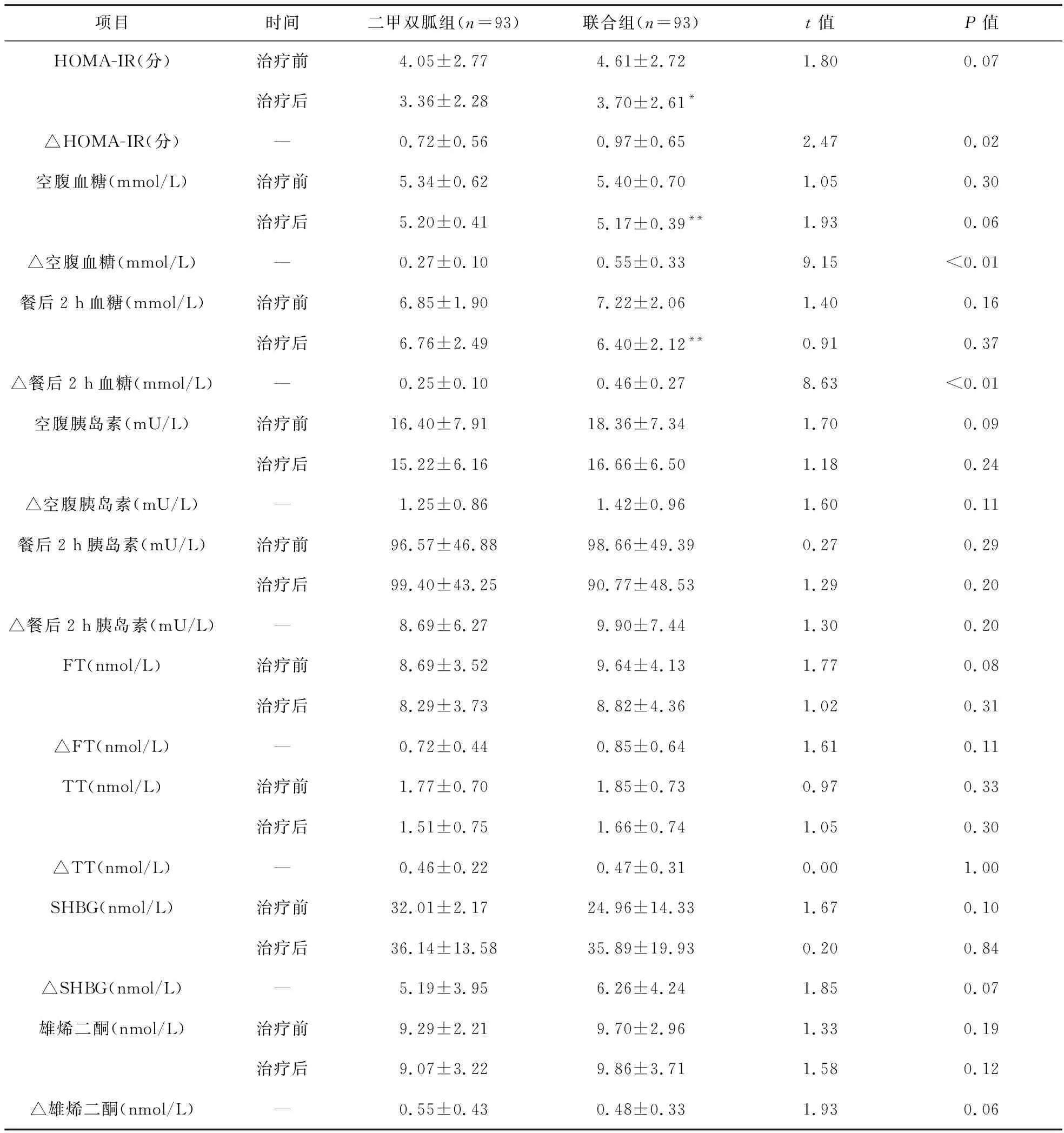
表3 兩組患者基線期和治療后的內分泌參數比較
注:與治療前比較,*P<0.05,**P<0.01

表4 兩組患者IVF治療結果比較
2.6 兩組患者藥物不良反應發生情況比較 二甲雙胍組患者發生惡心6例、腹瀉7例,聯合組患者發生惡心11例、腹瀉10例。兩組患者惡心與腹瀉發生率比較差異無統計學意義(χ2=1.56,P=0.21;t=0.58,P=0.45),利拉魯肽的低劑量和逐漸滴定降低了胃腸不良反應發生率。
3 討論
本研究結果表明,低劑量利拉魯肽聯合二甲雙胍對肥胖不孕的PCOS患者進行短期干預,可以顯著提高患者的臨床妊娠率和累計妊娠率,并顯著降低患者的體重、內臟脂肪、代謝和內分泌參數,但沒有顯著提高患者的藥物不良反應發生率。目前的國際指南推薦肥胖女性自然妊娠前或IVF手術前減輕體重,但缺乏減重最佳幅度和時間的數據。一些前瞻性隨機對照研究評價了肥胖育齡婦女接受IVF前進行短期減重的情況,而關于IVF妊娠結果的研究較少。Sim等[15]的研究評價了減重干預對肥胖婦女妊娠率的影響,結果顯示,減重組在飲食、運動和行為支持下的臨床妊娠率和活產率更高(48%vs.14%,P<0.01;44%vs.14%,P=0.02)。Espinós等[16]的研究表明,減重后的PCOS患者累計活產率顯著提高(61.9%vs.30%)。在一項對澳大利亞的非PCOS肥胖患者研究中,患者通過科學飲食和運動在5~9周內減重(3.8±3.0)kg,干預組和對照組的臨床妊娠率和活產率差異無統計學意義,妊娠率增加與腰圍降低有關[17]。但Mutsaerts等[18]的一項有290例肥胖女性參與的多中心研究顯示,IVF之前減重未能改善生殖結果。
本研究中,聯合組中68.8%的女性和二甲雙胍組中57.0%的女性在通過12周的藥物干預和生活方式改變減重超過5%。二甲雙胍組患者平均減少(6.98±6.03)kg,而聯合組患者減少(7.52±3.90)kg。聯合組的減重幅度與之前的研究結果一致,二甲雙胍組的減重幅度超出預期,因為使用二甲雙胍的PCOS肥胖女性有記錄的最大絕對減重約為2.7 kg,小于體重的5%。本研究中二甲雙胍組患者減重幅度更大,其原因可能是本研究中內分泌學醫生和婦科醫生等多學科團隊通過教育,讓患者認識到與母親肥胖相關的妊娠和胎兒風險,極大地提高了患者改變生活方式的積極性。
目前關于胰高血糖素樣肽-1受體激動劑(Glucagon-like peptide-1,GLP-1)類似物對不孕患者生殖影響的研究較少。利拉魯肽可能通過幾種不同的機制影響患者生殖系統,減重是其中最重要的機制之一。Liu等[19]進行了一項為期24周的前瞻性隨機臨床研究,比較了176例接受短效GLP-1RA艾塞那肽(Exenatide,Exe)和二甲雙胍的PCOS超重/肥胖女性的妊娠情況,結果表明,短期Exe治療與體重顯著減輕[(4.29±1.29)kg vs.(2.28±0.55)kg,P<0.001]、總脂肪減少百分比、IR改善和月經頻率提高有關,Exe治療患者12周內的自然妊娠率顯著高于二甲雙胍治療患者(43.60%vs.18.70%)。其研究提示減重改善了月經周期和排卵的機制,并主要通過減少內臟脂肪和改善胰島素敏感性實現。
利拉魯肽的第2種作用機制是通過減重改善患者IR來提高患者臨床妊娠率。相關研究深入評價了IR和高胰島素血癥在PCOS疾病中的作用,結果表明,IR和高胰島素血癥在PCOS和無排卵的病理生理學中發揮重要作用[20]。胰島素可通過增加卵巢雄激素分泌來增強黃體生成素(Luteinizing hormone,LH)的作用。胰島素還能夠抑制肝臟分泌SHBG,促進睪酮水平提高。胰島素敏感性的改善在卵巢功能恢復過程中起著關鍵作用[1,21]。在本研究中,聯合組HOMA-IR指標顯著降低,二甲雙胍組和聯合組中SHBG的增加降低了雄激素的生物利用度。兩組患者大多數雄激素均有所下降,不過降低值比較差異無統計學意義。
盡管兩組患者內臟脂肪組織和雄激素生物利用度的降低程度相似,但聯合組對臨床妊娠率的影響更顯著。這一結果提示,利拉魯肽對生殖潛力的影響超過了減重和IR改善。動物實驗表明,GLP-1通過下丘腦-垂體系統參于生殖系統的調節,側腦室注射GLP-1可提高大鼠血漿LH水平[22]。近期的一項大鼠研究發現,在發情周期中大鼠GLP受體在下丘腦、垂體和卵巢的表達發生變化。在發情前用天然GLP-1緊急治療,可使大鼠LH變化幅度加倍并導致黃體期黃體酮增加。這些變化增加了成熟格雷夫氏卵泡數量,提高了大鼠生殖能力。但應用EXE治療具有與GLP-1相反的作用,可使LH波動降低50%。下丘腦-垂體軸調節系統可使月經周期更加規律,促進排卵,并調節饑餓感和飲食習慣。研究假設GLP-1參與了下丘腦-垂體系統中這兩種活動的耦合,并作為生殖系統的代謝信號。在空腹48 h后,垂體LH迅速減少時,大鼠的下丘腦GLP-1水平顯著降低。重新喂食后,GLP-1有恢復正常的趨勢,可能有助于恢復LH分泌[23]。
動物研究表明,由于在子宮內膜上皮和基質層中被誘導的細胞毒性,糖尿病與子宮內膜的結構和功能的變化相關[21]。被誘導的子宮內膜改變可能導致植入失敗、妊娠失敗和胎盤缺陷,這在PCOS患者中較為常見。子宮內膜基質纖維化和變性增加在糖尿病大鼠中得到證實,短效GLP-1類似物Exe改善了動物模型中的子宮內膜功能。其所觀察到的Exe效應可能主要是由于拮抗氧化應激和轉化生長因子β水平降低減少了子宮內膜的纖維化。
研究表明,GLP-1 RA在2型糖尿病患者和無糖尿病的肥胖患者中有著良好的8年風險-效益平衡。有關人類在妊娠期間應用GLP-1 RA的研究較少,這些研究均為單一的病例報告,例如Artunc-Ulkumen等[24]的研究顯示,妊娠13周的患有2型糖尿病患者應用利拉魯肽后妊娠結果正常。Yang等[25]的病例報告報道了1例患有PCOS和IR的超重女性應用GLP-1 RA Exe進行短期的孕前干預,患者成功自然妊娠,治療過程中Exe沒有引起患者的藥物不良反應。Liu等[19]的臨床研究評價使用Exe進行妊娠前干預對超重/肥胖PCOS患者的生殖和代謝功能的影響,結果表明,Exe沒有發生重大的安全性問題。利拉魯肽在2型糖尿病和肥胖受試者中具有良好的短期安全性,因此用其對PCOS受試者進行短期孕前治療是可行的。
二甲雙胍是肥胖糖尿病患者臨床治療的一線藥物,其既有降糖作用,也有顯著的降低體重的作用,但是關于二甲雙胍減重的機制目前還不清楚,其中可能的機制包括:①實驗室研究表明,二甲雙胍加入到含有脂肪前體細胞培養基后,蘇氨酸上的AMP蛋白激酶被磷酸化,進而破壞了細胞內脂質的聚集,抑制了脂肪的合成;②二甲雙胍可以激活棕色脂肪的P44/P41MAPK,進而減少了瘦素分泌,并最終達到對食欲的抑制作用。這一效應有劑量依賴性,與PI3K完全不相關[26]。本研究顯示,以二甲雙胍為基礎用藥,同時聯合利拉魯肽患者的減重效果更好。利拉魯肽是一種GLP-1受體激動劑,最初是作為降糖藥物上市的。利拉魯肽能夠特異性地結合胰島B細胞上的GLP-1受體,并激活G蛋白信號通路,進一步活化環磷酸腺苷(Cyclic adenosine monophosphate,cAMP),激活依賴cAMP的蛋白激酶A(Protein kinase A,PKA),PKA可以使蛋白質磷酸化,進而促進機體分泌胰島素,這些蛋白質在葡萄糖轉導途徑中起到關鍵作用。同時,利拉魯肽可以磷酸化和活化CREB核轉錄因子,使CREB結合胰島素原基因啟動子區的關鍵DNA序列,提高了胰島素原基因的轉錄效率,促進胰島素基因轉錄到胰島素的生物合成作用。另外,利拉魯肽具有較長的半衰期,每天僅需要注射1次,能夠最大限度地降低患者的痛苦[27]。 綜上所述,低劑量利拉魯肽聯合二甲雙胍對超重不孕的PCOS患者進行短期干預,可以顯著提高患者的臨床妊娠率和累計妊娠率,并顯著降低了PCOS患者的體重、內臟脂肪組織,沒有顯著增加患者的藥物不良反應。

