具防病并提高植物耐旱功能的小鏈霉菌HS57的篩選
牛紅杰 荊玉玲 郭榮君 李世東


摘要 本研究旨在尋找防治黃瓜枯萎病并提高植物抗逆能力的多功能菌株。從連作田健康黃瓜根際土中分離篩選到1株放線菌HS57。平板對峙法測定菌株HS57對尖孢鐮刀菌、茄病鐮刀菌和立枯絲核菌的抑制作用,平皿對扣共培養法測定其揮發性物質對尖孢鐮刀菌的抑制作用,溫室盆栽法測定其對黃瓜枯萎病的防病效果及對小麥耐旱能力的影響,結合菌株形態特征和16S rRNA基因序列分析對其進行鑒定。結果表明,菌株HS57可抑制3種病原菌生長,其中對尖孢鐮刀菌的抑制率為52.4%;其揮發性物質對尖孢鐮刀菌的抑制率為32.1%。濃度為107 個/mL的HS57孢子懸浮液浸種對黃瓜枯萎病的防效最好,為51.0%;小麥種子經濃度為107、108個/mL的HS57孢子懸浮液浸種,麥苗經連續7 d缺水處理后再澆水,比對照恢復得更好。初步鑒定HS57菌株為小鏈霉菌Streptomyces parvus,是一株非常有潛力的多功能菌株。
關鍵詞 小鏈霉菌; 黃瓜枯萎病; 防病; 耐旱能力
中圖分類號: S 476.1
文獻標識碼: A
DOI: 10.16688/j.zwbh.2019224
Screening of Streptomyces parvus HS57 with the biocontrol function and ability to enhance the plants tolerance to water shortage stress
NIU Hongjie, JING Yuling, GUO Rongjun, LI Shidong
(Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193, China)
Abstract
The purpose of this study is to find a multifunctional strain to control cucumber wilt disease and enhance the plants tolerance to unfavorable conditions. An actinomycete strain HS57 with strong antagonistic effect on Fusarium oxysporum f.sp. cucumerinum (Foc) was isolated from the rhizosphere soil of the healthy cucumber plants. The inhibitive activity of strain HS57 on mycelial growth of F.oxysporum, F.solani and Rhizoctonia solani was determined by using pair-culturing method. In addition, the effect of its volatiles on Foc growth was determined by using an up-down co-culturing method with the plates separately inoculated with HS57 and Foc. The efficacy of strain HS57 in suppressing cucumber wilt disease and its ability to improve the wheat tolerance to water shortage stress were tested in the greenhouse by seed soaking with different concentrations of HS57 spores. Strain HS57 was identified based on the morphological characteristics and 16S rRNA gene sequence analysis. The results showed that strain HS57 inhibited the mycelial growth of F.oxysporum, F.solani and R.solani. Among the three fungi, F.oxysporum was suppressed with an inhibitive rate of 52.4%. Moreover, the volatiles produced by strain HS57 also had a good ability to inhibit F.oxysporum growth with an inhibitory rate of 32.1%. In the greenhouse assay, strain HS57 showed good control efficacy (51.0%) against cucumber fusarium wilt at the concentration of 107 spores/mL. Seed treatments with 107 and 108spores/mL of strain HS57 also enhanced the wheat tolerance to water shortage stress, demonstrated by better recovery of the seedlings than the control after 7 d-non-irrigation and re-irrigation. Strain HS57 was identified as Streptomyces parvus based on its morphological characteristics and its 16S rRNA gene sequence analysis. As a multifunctional strain, HS57 showed a great potential for practical application.
Key words
Streptomyces parvus; cucumber fusarium wilt; disease control; water shortage tolerance
黃瓜枯萎病是由尖孢鐮刀菌黃瓜專化型Fusarium oxysporum f.sp. cucumerinum (Foc)引起的典型土傳病害,在我國及全球黃瓜種植區普遍發生[1]。我國黃瓜枯萎病常年發病率為10%~30%,嚴重時可達80%~90%,甚至導致絕產,該病已成為制約我國黃瓜生產的重要因素之一[2]。黃瓜枯萎病在黃瓜整個生育期內均可發生,尤以開花結果期最為嚴重,防治較為困難。目前生產上主要以預防為主,選用抗病品種,采用輪作或嫁接等栽培管理措施,并配合使用化學農藥等方法,達到綜合防治該病害的目的[3]。化學農藥長期使用會導致抗藥性產生、藥物殘留、污染環境等問題,而且針對維管束類病害目前并沒有特別有效的化學農藥。嫁接在一定程度上可控制病害的發生,但會造成黃瓜口感的下降;抗病品種防治黃瓜枯萎病雖經濟有效[4],但長期種植會導致枯萎病菌致病力上升[5],可能導致抗性丟失,重新選育新的抗病品種所需時間較長,致使抗性品種在黃瓜枯萎病的防治上存在一定局限性[6];而生物防治安全友好,無殘留、無污染、無毒害,更加符合現代農業可持續發展的思路。
國內外學者開展了利用生防微生物防治黃瓜枯萎病的研究。目前已經報道具有生防作用的生防微生物主要有木霉Trichoderma spp.、芽胞桿菌Bacillus spp.、假單胞菌Pseudomonas spp.和鏈霉菌Streptomyces spp.。Chen等[7]、Cao等[8]研究發現枯草芽胞桿菌B579、SQR9對病原菌有抑制作用。劉愛榮等[9]研究表明,哈茨木霉對Foc的抑制率可達66.7%~85.8%;108 個/mL的孢子懸浮液在田間試驗防效可達50%。Li等[10]鑒定了3株對尖孢鐮刀菌有抑制作用的木霉,分別為T.asperellum 525,T.harzianum 610和T.pseudokoningii 886,盆栽試驗表明3株木霉對黃瓜枯萎病的防效均超過78%,還能提高黃瓜品質和產量。路丹丹等[11]從龜裂鏈霉菌M527發酵液中分離到活性化合物龜裂殺菌素;盆栽試驗表明,施用17.56 mg/L 的龜裂殺菌素溶液14 d 和 21 d 對黃瓜枯萎病的防治效果分別為78.3%和70.6%。上述研究取得了一定的效果,而生產中常遇到干旱或水澇等惡劣天氣,嚴重影響作物產量,獲得可提高作物防病能力以及應對短時間旱澇脅迫能力的多功能生防菌株,對實際生產具有重要的意義。
本研究從河北廊坊采集了連作黃瓜田健康黃瓜根際土,并進行了拮抗菌的分離,旨在發現可更好定殖于連作土壤的生防菌。經分離篩選獲得一株對黃瓜枯萎病菌Foc有較好抑制作用的放線菌HS57,經鑒定為小鏈霉菌S.parvus。平板對峙、平板對扣共培養顯示菌株HS57能抑制尖孢鐮刀菌菌絲的生長,該菌株不僅對黃瓜枯萎病具有較好的防病效果,還可以增強小麥耐干旱能力,是一株具有防病抗旱功能的多功能菌株,具有很大的應用潛力。
1 材料與方法
1.1 材料
1.1.1 供試作物品種
黃瓜枯萎病感病品種‘中農6號,購于中蔬種業科技(北京)有限公司;小麥無抗病基因品種‘銘賢169,由中國農業科學院植物保護研究所小麥病害課題組惠贈。
1.1.2 供試菌株
菌株HS57分離自中國農業科學院植物保護研究所廊坊中試基地的健康黃瓜根際土,保存于本實驗室;尖孢鐮刀菌黃瓜專化型F.oxysporum f.sp. cucumerinum、立枯絲核菌Rhizoctonia solani、茄病鐮刀菌F.solani,均由本實驗室保存;青枯勞爾氏菌Ralstonia solanacearum由中國農業科學院植物保護研究所馮潔老師惠贈;果膠桿菌Pectobacterium spp.由中國農業大學張力群老師惠贈。
1.1.3 供試培養基
固體培養基:高氏一號培養基[12]、HV培養基[13]、NA培養基[14]、PDA培養基、WA-N培養基[15]、ISP2培養基[16]、剛果紅培養基[17]。
液體培養基:Armstrong液體培養基[18]。
種子液:GYMM[19]、SNGY[20]、PDB。
發酵液:MA1[20]、MA2[21]、M1:可溶性淀粉15 g、牛肉膏2 g、 葡萄糖1 g、酵母粉3 g、蛋白胨2 g、CaCO3 3 g、蒸餾水 1 000 mL, pH 7.2。
1.1.4 供試土壤
采集自中國農業科學院植物保護研究所溫室外菜地,過2 mm網篩,備用。
1.2 方法
1.2.1 菌株HS57的分離
2017年6月,從中國農業科學院植物保護研究所廊坊基地連作數年的健康黃瓜根際采集土樣,帶回實驗室保存于4℃備用。土樣過2 mm的網篩,于避光處自然風干5~9 d,取風干后土樣10 g于裝有90 mL無菌水和玻璃珠的三角瓶中,置于15℃、180 r/min搖床中振蕩45 min,然后進行系列梯度稀釋,吸取100 μL均勻涂布于添加有50 mg/L放線菌酮和20 mg/L的萘啶酮酸的高氏一號和HV培養基平板上,28℃培養箱中培養。3 d后挑取顏色、形狀外觀不同的單菌落,多次劃線純化。
1.2.2 菌株HS57拮抗性測定
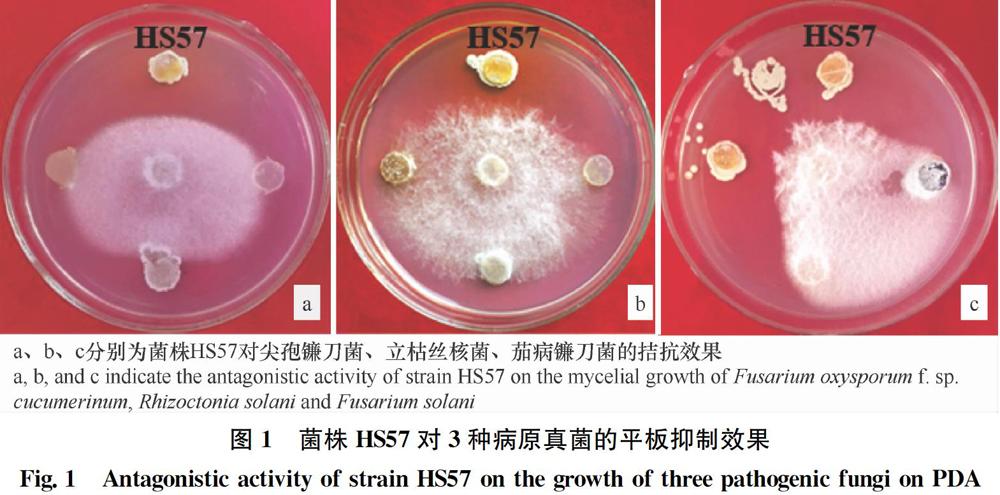
對病原真菌的拮抗性測定:平板對峙法[22],先將直徑8 mm的不同放線菌菌塊分別接種在距培養皿中心3 cm處,28℃培養24 h后,將病原菌接種于PDA平板中央。對病原細菌的拮抗性測定:先將菌體濃度為108? cfu/mL的病原細菌涂布于NA平板,立即將直徑為8 mm的放線菌菌塊分別接種在距培養皿中心3 cm處,試驗重復3次,置于28℃培養箱培養3~7 d,觀察抑菌效果。
2.5 菌株HS57對黃瓜枯萎病的防治效果
試驗結果(表2)表明,不同濃度放線菌HS57孢子液浸種處理的黃瓜種子出苗率與對照組無差異,病原菌浸種處理種子出苗率低于對照。各處理間病情指數差異顯著,其中HS57孢子液濃度為107個/mL時發病率最低,病情指數最小,防治效果最好,可達51.0%。
CK1:黃瓜種子用無菌水浸泡30 min;CK2:黃瓜種子在105 個/mL的尖孢鐮刀菌黃瓜專化型 (Foc) 孢子液中浸泡30 min;T1、T2、T3:黃瓜種子在濃度為105 個/mL的Foc孢子液和濃度分別為106、107和108個/mL的菌株HS57孢子液的混合液中浸泡30 min。
The data in the table are the means±standard deviation. The different letters in the same column indicate that the difference was significant at P<0.05 by the Duncans test.
CK1: Cucumber seeds are soaked in sterile water for 30 min; CK2: Cucumber seeds are soaked in spore suspension of the pathogen Fusarium oxysporum f.sp. cucumerinum (105 spores/mL) for 30 min; T1, T2, T3: Cucumber seeds are soaked in the mixture of Foc spore suspension (105 spores/mL) and strain HS57 spore suspension at the concentration of 106, 107 and 108 spores/mL, respectively.
2.6 放線菌HS57對小麥耐旱能力的影響
經不同濃度HS57孢子液處理的小麥,在苗期缺水處理后再澆水,麥苗的恢復能力不同。107 個/mL和108 個/mL浸種處理比106 個/mL處理和清水對照更耐干旱,表現為干旱處理后萎蔫干黃的葉片部分恢復變綠,如圖5A、5B所示,表明該菌株處理后可使小麥更耐旱。
2.7 菌株HS57的初步鑒定
菌株HS57在高氏一號培養基上生長形態如圖6 a。光學顯微鏡觀察,菌株HS57的氣生菌絲多分枝,無橫隔膜,氣生菌絲頂端分化呈松散螺旋狀孢子絲,孢子呈短桿狀(圖6 b、c)。采用16S rRNA基因擴增引物從菌株HS57的基因組DNA中擴增到一條約1 500 bp左右的條帶,序列提交到GenBank(登錄號:MG551267);與NCBI數據庫中相似序列同源比對,發現其16S rRNA基因序列與小鏈霉菌Streptomyces parvus的同源性為99.86%。采用鄰接法(neighbor-joining method, NJ)構建系統發育
進化樹(圖7),菌株HS57與S.parvus聚在同一分支。根據形態特征結合16S rRNA基因序列分析,將放線菌HS57初步鑒定為S.parvus。
3 討論
放線菌能產生豐富的次級代謝產物,作為重要的生防資源,具有廣闊的應用前景。國內外利用放線菌防治黃瓜枯萎病的研究已有報道。張璐等[26]從黃瓜根際土壤篩選的放線菌SG-126對黃瓜枯萎病的防治效果為42.86%,能顯著促進黃瓜的生長發育,同時提高黃瓜葉片保護酶活性和葉綠素含量,降低電解質滲透率;梁銀等[27]從土壤中分離出的拮抗鏈霉菌對黃瓜枯萎病的防效為51.58%。但是目前這些菌株都尚未商品化。其中重要原因是生防菌應用于田間可能不適應田間土壤條件,特別是連作田,因此挖掘更多的生防菌資源是一項重要的任務。為此,本研究開展了黃瓜連作田中拮抗菌的分離篩選工作,并獲得1株對黃瓜枯萎病具有良好拮抗效果的S.parvus菌株HS57,溫室防效可達51.0%。雖然前人對小鏈霉菌曾有一些研究,但大部分研究集中在對植物病毒[28]、醫學耐藥菌株[29]、植物細菌病害[30]的抑制作用以及代謝產物[31]方面,有關小鏈霉菌對植物真菌病害的研究尚未見報道。菌株HS57的獲得豐富了黃瓜枯萎病的生防菌資源。
在篩選生防菌時,除考慮菌株的拮抗效果外,生防菌在土壤中的快速繁殖和定殖是其發揮生防潛力的重要前提條件,因此篩選生防菌時需考慮菌株的生長速度。菌株HS57在常用的高氏一號、PDA、ISP2等放線菌培養基上均可快速生長,說明該菌株生長迅速,具備在土壤中快速占位的潛力。此外,生防菌的工業化生產性能也是需要我們注意的一個因素,很多生防效果非常好的菌株常因規模化生產存在一定難度而得不到推廣和應用。菌株HS57在文獻報道的放線菌發酵培養基MA1、MA2中不產孢或產孢很慢。經篩選,我們獲得了發酵培養基M1,菌株HS57在M1中培養3 d即可大量產孢,比一般的放線菌的發酵周期短[32],而且經過進一步優化后,48 h即可完成發酵(已申請專利,申請號:201810017582.2),具有可規模化生產的潛力,有利于該菌株的商品化。除上述特點外,菌株HS57還具有提高植物耐旱能力和降解纖維素的能力,具有應用于有機肥或與其他載體混和使用的潛力。
綜上所述,小鏈霉菌HS57是一株非常有潛力的多功能菌株,具有很大的應用潛能。后續將開展生防菌在植物根際土壤中的定殖及其防病機理研究,以便更好地促進小鏈霉菌HS57的應用。
參考文獻
[1] ZHOU Xingang, WU Fengzhi. Dynamics of the diversity of fungal and Fusarium communities during continuous cropping of cucumber in the greenhouse [J]. FEMS Microbiology Ecology, 2012, 80(2): 469478.
[2] 郭晉云, 胡曉峰, 李勇, 等. 黃瓜枯萎病對黃瓜光合和水分生理特性的影響[J]. 南京農業大學學報, 2011, 34(1): 7983.
[3] 林璐璐. 黃瓜枯萎病的研究[J]. 農業災害研究, 2011, 1(2): 2329.
[4] 徐彥剛, 賀振, 李瑞, 等. 黃瓜枯萎病研究進展[J]. 中國瓜菜, 2018, 31(6): 16.
[5] HUANG Xiaoqing, SUN Manhong, LU Xiaohong, et al. Serial passage through resistant and susceptible cucumber cultivars affects the virulence of Fusarium oxysporum f. sp. cucumerinum [J/OL]. Microbiology Open, 2019, 8(2): e00641. DOI:10.1002/mb03.641.
[6] 毛愛軍, 張峰, 張麗蓉, 等. 不同黃瓜材料對枯萎病的抗性評價[J].華北農學報,2008,23(2):214216.
[7] CHEN Fang, WANG Min, ZHENG Yu, et al. Quantitative changes of plant defense enzymes and phytohormone in biocontrol of cucumber Fusarium wilt by Bacillus subtilis B579 [J]. World Journal of Microbiology and Biotechnology, 2010, 26(4): 675684.
[8] CAO Yun, ZHANG Zhenhua, LING Ning, et al. Bacillus subtilis SQR 9 can control Fusarium wilt in cucumber by colonizing plant roots [J]. Biology and Fertility of Soils, 2011, 47(5): 495506.
[9] 劉愛榮, 陳雙臣, 陳凱, 等. 哈茨木霉對黃瓜尖孢鐮刀菌的抑制作用和抗性相關基因表達[J]. 植物保護學報, 2010, 37(3): 249254.
[10]LI Mei, MA Guangshu, LIAN Hua, et al. The effects of Trichoderma on preventing cucumber fusarium wilt and regulating cucumber physiology [J]. Journal of Integrative Agriculture, 2019, 18(3): 607617.
[11]路丹丹, 趙艷芳, 馬正, 等. 龜裂鏈霉菌M527抗真菌物質的分離鑒定及其在黃瓜枯萎病防治中的應用[J]. 中國生物防治學報, 2016, 32(6): 783787.
[12]趙珂. 攀西地區藥用植物內生及根際放線菌的多樣性與抗菌活性研究[D]. 雅安:四川農業大學, 2010.
[13]夏廣欣. 土壤放線菌的篩選、鑒定及其發酵產物的活性研究[D]. 哈爾濱:東北農業大學, 2012.
[14]韓如月, 李睿瑞, 楊帆, 等. 一株水稻根內生拮抗細菌SM13的分離及鑒定[J]. 微生物學通報, 2019, 46(5): 10301040.
[15]GARBEVA P, DE BOER W. Inter-specific interactions between carbon-limited soil bacteria affect behavior and gene expression [J]. Microbiology Ecology, 2009, 58(1): 3646.
[16]SHIRLING E B, GOTTLIEB D. Methods for characterization of Streptomyces species [J]. International Journal of Systematic Bacteriology, 1966, 16(3): 313340.
[17]廖敏. 四川阿壩地區藥用植物內生拮抗放線菌的篩選及其防病促生機制研究[D]. 雅安:四川農業大學, 2016.
[18]黃曉慶. 連作土壤中黃瓜枯萎病菌的致病力變化規律及強、弱致病力菌株的轉錄組分析[D]. 北京:中國農業科學院, 2018.
[19]趙韻宇, 孫偉, 彭崇勝, 等. 海洋放線菌Streptomyces variabilis strain 6-1次級代謝產物的研究[J]. 現代生物醫學進展, 2012, 12(26):50015004.
[20]劉亮山, 林茂松, 鄢小寧, 等. 生防鏈霉菌JH108-2的發酵培養基優化[J]. 植物病理學報, 2006, 36(3): 259266.
[21]黃雋, 林甲檀, 周敏, 等. 吸水鏈霉菌HS023 milF基因敲除構建產5-酮米爾貝霉素基因工程菌[J]. 微生物學報, 2015, 55(1):107113.
[22]金鑫. 稻瘟病生防菌Af1、Af4的初步研究[D]. 武漢:華中農業大學, 2010.
[23]高毓晗. 產surfactin枯草芽胞桿菌168重組菌株構建及其對黃瓜枯萎病的控制作用[D]. 北京:中國農業科學院, 2015.
[24]韓秀芳. 土壤放線菌分離菌株的分類鑒定與拮抗性篩選[D]. 北京:北京理工大學, 2015.
[25]WEISBURG W G, BARNS S M, PELLETIER D A, et al. 16S ribosomal DNA amplification for phylogenetic study [J]. Journal of Bacteriology, 1991, 173(2): 697703.
[26]張璐, 杜秉海, 魏珉, 等. 黃瓜枯萎病拮抗菌的生防效果及其對植株生長代謝的影響[J]. 山東農業科學, 2007(4): 8992.
[27]梁銀, 張谷月, 王辰, 等. 一株拮抗放線菌的鑒定及其對黃瓜枯萎病的生防效應研究[J]. 土壤學報, 2013, 50(4): 810817.
[28]田兆豐, 劉偉成, 劉霆, 等. 小鏈霉菌Yn168發酵產物抗植物病毒活性的研究[J]. 中國生物防治學報, 2011, 27(4): 569572.
[29]康銀花, 王旻. 抗MRSA小鏈霉菌NIM521發酵工藝的優化[J]. 藥物生物技術, 2008, 15(3): 208211.
[30]孫建龍, 于基成, 劉秋, 等. 響應面法優化小鏈霉菌產抗生素發酵條件[J]. 沈陽農業大學學報, 2012, 43(2): 168172.
[31]田兆豐, 劉霆, 吳慧玲, 等. 小鏈霉菌Yn168抗病毒活性組分的分離及其穩定性研究[J]. 華北農學報, 2015, 30(2):124127.
[32]路春玲, 王杰, 王立剛, 等. 產藍色色素放線菌的分離鑒定及發酵工藝條件優化[J]. 藥物生物技術, 2014, 21(6): 550553.
(責任編輯:田 喆)
收稿日期: 20190429?? 修訂日期: 20190707
基金項目:國家重點研發計劃(2016YFD0201000);中央級公益性科研院所基本科研業務費專項資金(S2018XM10);內蒙古自治區科技重大專項(zdzx2018009)
致? 謝: 參加本試驗部分工作的還有江代禮、譚翰杰、張能和紀燁斌等同學,特此一并致謝。
通信作者E-mail:guorj20150620@126.com
#為并列第一作者

