基于黃酮類成分含量構成特征和體外抗病毒活性的不同產地黃芩的質-效評價研究
李化 張明曉 白羽琦 楊濱
中圖分類號 R282 文獻標志碼 A 文章編號 1001-0408(2020)10-1166-06
DOI 10.6039/j.issn.1001-0408.2020.10.03
摘 要 目的:評價黃芩道地藥材與非道地藥材中主要黃酮類成分含量構成特征及其抗病毒活性,以探討黃芩藥材的質-效關系及藥效物質基礎。方法:制備8批不同產地黃芩(S1~S8)的水提物凍干粉,采用超高效液相色譜法測定水提物中黃芩苷、漢黃芩苷、黃芩素、漢黃芩素等4種黃酮類成分的含量并計算其含量構成比。按不同產地黃芩的黃酮類成分含量構成比,制備上述4種成分混合物作為對應的黃酮類成分模擬樣品(E1~E8)。以利巴韋林為陽性對照,采用MTT法和細胞病變程度法,考察8批黃芩水提物樣品及其對應的模擬樣品對人喉癌細胞Hep-2的半數有毒濃度(TD50)和對呼吸道合胞病毒(RSV)的半數抑制濃度(IC50),并計算治療指數(TI)。采用SPSS 17.0軟件對黃芩苷、漢黃芩苷、黃芩素、漢黃芩素含量與其抗RSV活性(IC50值)進行Pearson相關性分析。結果:樣品S4(產地為河北承德)的黃芩苷、漢黃芩苷含量最高,樣品S6(產地為內蒙古-2)的黃芩素、漢黃芩素含量最高;上述4種成分含量最低的分別為樣品S6、S6、S7(產地為北京)、S4。樣品S4中黃酮苷類成分含量較高,相應的苷元類成分含量較低,其黃芩苷、漢黃芩苷、黃芩素、漢黃芩素的含量構成比為1 ∶ 0.224 ∶ 0.111 ∶ 0.013;樣品S6中黃酮苷類成分含量較低,相應的苷元類成分含量較高,上述4種成分的含量構成比為1 ∶ 0.241 ∶ 0.713 ∶ 0.106。不同產地黃芩水提物對Hep-2細胞的TC50均高于50 μg/mL,對RSV的IC50為11.11~51.74 μg/mL,TI為1.86~5.20;其對應的黃酮類成分模擬樣品的TC50為23.11~52.23 μg/mL,對RSV的IC50為4.87~14.61 μg/mL,TI為1.85~4.75。道地產區(河北承德)黃芩(S4)的水提物及其對應模擬樣品(E4)的抗RSV作用最強。相關性分析顯示,4種黃酮類成分的含量與其抗病毒活性的相關系數均小于0.5,兩者無顯著相關性。結論:當黃芩中4種主要黃酮類成分的含量構成比為1 ∶ 0.224 ∶ 0.111 ∶ 0.013時,其對RSV的抑制作用較強。道地產區黃芩樣品具有較優的黃酮類成分構成特征,該特征可能是道地藥材發揮最佳抗病毒療效的重要物質基礎。
關鍵詞 黃芩;道地藥材;黃酮類成分;含量測定;抗病毒活性;質-效關系
Study on Quality-efficiency Evaluation of Scutellaria baicalensis from Different Origins Based on Content Constituent Characteristics of Flavonoids and in vitro Antiviral Activity
LI Hua,ZHANG Mingxiao,BAI Yuqi,YANG Bin(Institute of Chinese Materia Medica,China Academy of Chinese Medical Sciences,Beijing 100700,China)
ABSTRACT? ?OBJECTIVE: To evaluate content constituent characteristics and antiviral activity of main flavonnoids in genuine and non-genuine Scutellaria baicalensis, and to investigate quality-efficiency relationship and effective substance. METHODS: Totally 8 batches of S. baicalensis from different origins (S1-S8) were collected to prepare its water extract lyophilized powder. UPLC method was used to determine the contents of baicalin,wogonoside,baicalein and wogonin, and calculate their content constituent ratio. According to the content constituent ratio of flavonoids in S. baicalensis from different origins, the mixture of the above four components was prepared as the corresponding simulated sample of flavonoids (E1-E8). Using ribavirin as positive control, MTT assay and CPE method were used to investigate half toxic concentration (TD50) of the water extract from 8 batches of S. baicalensis and their corresponding simulated samples to human laryngeal carcinoma cell Hep-2 and their half inhibition concentration (IC50) to respiratory syncytial virus (RSV); treatment indexes (TI) were calculated. Pearson correlation analysis for the content of baicalin,wogonoside,baicalein and wogonin with their anti-RSV activity (IC50) was performed by SPSS 17.0 software. RESULTS: The contents of baicalin and wogonoside in sample S4 (from Hebei Chengde) were the highest, and the contents of baicalein and wogonin in sample S6 (from Inner Mongolia-2) were the highest. The contents of above 4 components were the lowest in sample S6, S6, S7 (from Beijing), S4. The contents of flavonoid glycosides in sample S4 were relatively higher, while those of corresponding glycosides were relatively lower; the content constituent ratio of baicalin,wogonoside,baicalein and wogonin was 1 ∶ 0.224 ∶ 0.111 ∶ 0.013. The contents of flavonoid glycosides in sample S6 were relatively lower, while those of glycosides were relatively higher; the content constituent ratio of above 4 components was 1 ∶ 0.241 ∶ 0.713 ∶ 0.106. TC50 of S. baicalensis water extracts from different origins to Hep-2 cells was all higher than 50 μg/mL, IC50 to RSV was 11.11-51.74 μg/mL; TI was 1.86-5.20. TC50 of corresponding simulated samples of flavonoids was 23.11-52.23 μg/mL, while IC50 to RSV was 4.87-14.61 μg/mL; TI was 1.85-4.75. The anti-RSV effects of water extract of S4 from genuine origins (Hebei Chengde) and its corresponding simulated sample E4 were the strongest. Correlation analysis showed that the correlation coefficient between the contents of 4 flavonoids and antiviral activity was less than 0.5, and there was no significant correlation between them. CONCLUSIONS: When the content constituent ratio of 4 main flavonoids in S. baicalensis was 1 ∶ 0.224 ∶ 0.111 ∶ 0.013, it has a strong inhibition effect on RSV. S. baicalensis from genuine origins has better constituent characteristics of flavonoids, which may be the important material basis for the best antiviral effect of genuine medicinal material.
KEYWORDS? ?Scutellaria baicalensis;Genuine medicinal material; Flavonoids; Content determination;Antiviral activity; Quality-efficiency relationship
黃芩是唇形科植物黃芩(Scutellaria baicalensis Georgi)的干燥根,其入藥始見于《神農本草經》。黃芩性寒、味苦,歸肺、膽、脾、大腸、小腸經,具有清熱燥濕、瀉火解毒等作用[1-2]。在我國,其主要分布于北部地區,河北地區的“熱河黃芩”為道地藥材,品質最佳[3]。黃芩中的主要活性成分是黃酮類成分,其中以黃芩苷、漢黃芩苷、黃芩素和漢黃芩素這4種成分的含量較高[4-6]。現代研究表明,黃芩藥材提取物及分離所得的黃酮類單體成分均具有抗病毒活性[7-11],且臨床療效確切[12-14]。已有研究發現,不同產地黃芩提取物的抗病毒作用差異顯著,道地黃芩的抗病毒作用明顯優于非道地藥材[15-16]。但尚未有研究探索造成不同產地黃芩抗病毒藥效差異的物質基礎以及道地藥材質優的化學本質特征。為此,本研究通過建立體外感染呼吸道合胞病毒(RSV)的細胞模型,考察不同產地黃芩水提物及其黃酮類成分模擬樣品的體外抗病毒活性,同時結合黃芩中4種主要黃酮類成分的含量及其構成特征,探討不同比例構成的黃酮類成分對黃芩抗RSV活性的影響,為初步闡明黃芩抗病毒作用的物質基礎提供思路,為黃芩藥材的質-效評價提供參考。
1 材料
1.1 儀器
ACQUITY H-Class UPLCTM型超高效液相色譜(UPLC)儀(美國Waters公司);2004MBP6型半微量電子天平(德國Sartorius公司);KQ-100DE型控超聲波清洗器(昆山市超聲儀器有限公司);FW-80型高速萬能粉碎機(天津市泰斯特儀器有限公司);ALPHR 2-4 LD Plus型冷凍干燥機(德國Christ公司);NU-425-400S型生物安全柜(美國Nuaire公司);EXL-808型酶聯免疫檢測儀(美國BioTek儀器公司);MCO-15AC型CO2培養箱(日本Sanyo公司);CKX-41型倒置式生物顯微鏡(日本Olympus公司);Milli-Q型超純水制備儀(美國Millipore公司)。
1.2 藥品與試劑
黃芩苷對照品(批號:15062716,純度:>98%)、漢黃芩苷對照品(批號:15080512,純度:>98%)、黃芩素對照品(批號:15031608,純度:>98%)、漢黃芩素對照品(批號:15080513,純度:>98%)均購自成都曼斯特生物科技有限公司;利巴韋林原料藥(新鄉制藥股份有限公司,批號:20081227,純度:99%);MTT試劑(美國Sigma公司);F-12K Nutrient Mixture(1×)培養基、胎牛血清(FBS)、青鏈霉素雙抗混合液(美國Gibco公司);乙腈、甲酸(美國Thermo Fisher Scientific公司)均為色譜純,二甲基砜(DMSO)等其余試劑(北京化工廠)均為分析純,水為自制超純水。
8批黃芩藥材均于2014年采集或收集,產地分別為內蒙古-1、陜西、山西、河北承德(黃芩道地產區)、甘肅、內蒙古-2、北京、山東等8個地區,依次編號為S1~S8(注:其中2批藥材均購自內蒙古,但并非同時、同地購進,故將產地分為內蒙古-1和內蒙古-2以示區別),每批藥材干質量約200 g。上述藥材經中國中醫科學院中藥研究所李化副研究員鑒定為唇形科植物黃芩(S. baicalensis Georgi)的干燥根。藥材粉碎后,過40目篩,密閉包裝后保存于防潮柜中,備用。
1.3 細胞和病毒
人喉癌細胞Hep-2由中國科學院上海生命科學研究院細胞資源中心提供;RSV購自美國典型菌種保藏中心(ATCC)。
2 方法與結果
2.1 不同產地黃芩中黃酮類成分的含量測定
采用本課題組前期研究建立的UPLC法[5]測定黃芩中黃芩苷、漢黃芩苷、黃芩素和漢黃芩素的含量。
2.1.1 黃芩水提物的制備 參考文獻方法[17]并略作調整,取黃芩藥材粉末25 g,精密稱定,依次加入10、8、8倍量水(mL/g,下同),煎煮3次,每次1 h;濾過,合并3次濾液,經預凍后再冷凍干燥,得水提物凍干粉(得率為35%~45%),置于-20 ℃冰箱保存,備用。
2.1.2 混合對照品溶液的制備 分別精密稱取黃芩苷、漢黃芩苷、黃芩素、漢黃芩素對照品各適量,加20%乙腈水溶液溶解制成質量濃度分別為64.8、31.0、28.0、2.72 μg/mL的混合對照品溶液。
2.1.3 供試品溶液的制備 取“2.1.1”項下黃芩水提物凍干粉0.1 g,精密稱定,置于具塞錐形瓶中,精密加入70%乙醇100 mL,稱定質量,超聲(功率:200 W,頻率:40 kHz)提取1 h;放冷,稱定質量,以70%乙醇補足減失質量;濾過,取續濾液,過0.2 μm微孔濾膜,即得。
2.1.4 色譜條件 色譜柱:Aquity BEH C18(50 mm×2.1 mm,1.7 μm);流動相:0.1%甲酸水溶液(A)-乙腈(B),梯度洗脫(0~0.5 min,18%B;0.5~2.0 min,18%B→20%B;2.0~6.0 min,20%B→30%B;6.0~8.0 min,30%B;8.0~10.0 min,30%B→60%B;10.0~12.0 min,60%B);柱溫:40 ℃;流速:0.4 mL/min;檢測波長:280 nm;進樣量:1 μL。
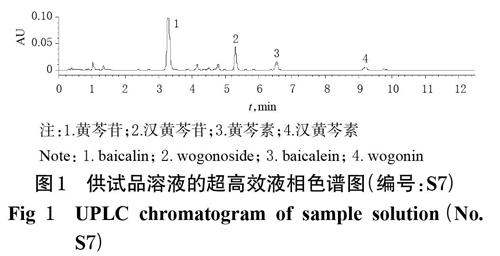
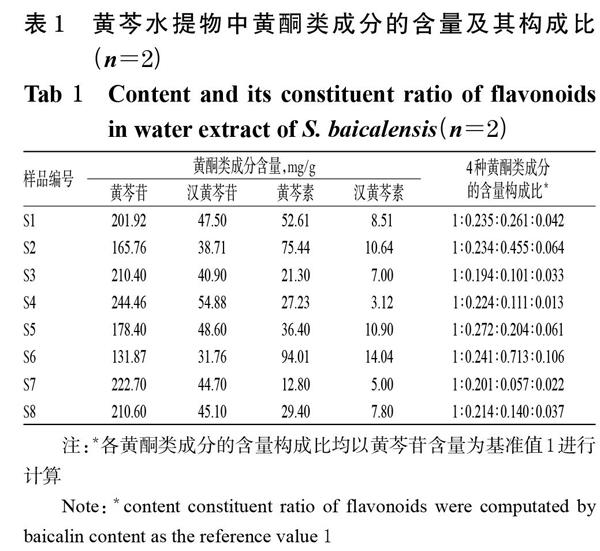
2.1.5 不同產地黃芩中4種黃酮類成分的含量測定 取8批黃芩樣品粉末,先后按“2.1.1”“2.1.3”項下方法制備水提物凍干粉及供試品溶液,另取“2.2.1”項下混合對照品溶液,按“2.2.3”項下色譜條件進樣測定,記錄色譜圖,按外標法計算黃芩苷、漢黃芩苷、黃芩素、漢黃芩素的含量。每批樣品平行2份操作,取平均值并計算不同黃酮類成分的含量及其構成比。色譜圖示例見圖1(其余色譜圖及方法學考察內容略,可參見前期研究[5]),含量測定結果見表1。
注:*各黃酮類成分的含量構成比均以黃芩苷含量為基準值1進行計算
Note:*content constituent ratio of flavonoids were computated by? baicalin content as the reference value 1
由表1可見,8批不同產地黃芩提取物中黃芩苷、漢黃芩苷、黃芩素、漢黃芩素含量差異較大。其中,S4樣品(產地:河北承德)中黃芩苷、漢黃芩苷含量最高,S6樣品(產地:內蒙古-2)中黃芩素、漢黃芩素含量最高;S6樣品(產地:內蒙古-2)中黃芩苷、漢黃芩苷含量最低,S7樣品(產地:北京)中黃芩素含量最低,S4樣品(產地:河北承德)中漢黃芩素含量最低。從4種成分的含量構成特征來看,S4樣品(產地:河北承德)中黃酮苷類成分含量較高,相應的苷元類成分含量較低,其黃芩苷、漢黃芩苷、黃芩素、漢黃芩素的含量結構比為1 ∶ 0.224 ∶ 0.111 ∶ 0.013;而S6樣品(產地:內蒙古-2)中黃酮苷類成分含量較低,相應的苷元類成分含量較高,4種成分含量結構比為1 ∶ 0.241 ∶ 0.713 ∶ 0.106。
2.2 黃芩水提物和黃酮類成分模擬樣品的細胞毒性和抗病毒活性評價
2.2.1 黃芩水提物樣品溶液的配制 取8批不同產地黃芩藥材粉末,按“2.1.1”項下方法制備水提物凍干粉。取該凍干粉末適量,精密稱定,以DMSO配制成母液(臨用新配);取該母液適量,用細胞培養液[含10%FBS+100 u/mL青鏈霉素雙抗的F-12K Nutrient Mixture(1×)培養基,下同]稀釋至不同濃度,備測。
2.2.2 黃酮類成分模擬樣品溶液的配制 精密稱取黃芩苷、漢黃芩苷、黃芩素、漢黃芩素對照品各適量,按“2.2.5”項下測得的8批不同產地黃芩水提物凍干粉中上述4種黃酮類成分的含量構成比進行混合、研勻,得到8種代表不同產地黃芩中黃酮類成分組成特征的模擬樣品(分別編號為E1~E8)。取該模擬樣品粉末適量,精密稱定,以DMSO配制成母液(臨用新配);取該母液適量,用細胞培養液稀釋至不同濃度,備測。
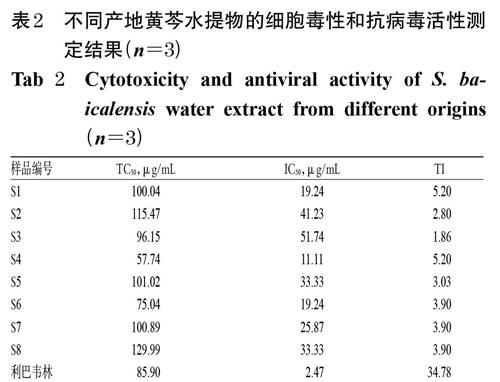
2.2.3 兩種樣品的細胞毒性評價 參照文獻方法[18]并略作調整后,采用MTT法考察兩種樣品對Hep-2細胞的毒性。取對數生長期的Hep-2細胞,分別按5×103個/孔接種于96孔板中,在37 ℃、5%CO2、飽和濕度條件下(以下培養條件相同)培養24 h后,分別加入“2.2.1”“2.2.2”項下不同質量濃度的黃芩水提物樣品(5、10、20、40、80、160、320、640 μg/mL,以水提物計)和黃酮類成分模擬樣品(5、10、20、40、80、160、320、640 μg/mL,以混合對照品總量計)溶液100 μL,繼續培養72 h。吸棄原培養液,每孔加入5 mg/mL MTT溶液10 μL,反應4 h后,加入DMSO 150 μL終止反應,采用酶聯免疫檢測儀在490 nm波長處測定每孔吸光度。本研究同時設置對照組和陽性對照組,其中對照組加入細胞但不加入藥物,陽性對照組加入細胞和利巴韋林(2、4、8、16、32、64、128、256 μg/mL),同法處理并測定。各給藥組劑量均參照文獻[18]和前期預試驗結果設定。試驗重復3次操作。采用Reed-Muench法[18]計算各目標藥物對Hep-2細胞的半數有毒濃度(TC50)。不同產地黃芩水提物及其對應黃酮類成分模擬樣品的細胞毒性測定結果見表2、表3。
由表2、表3結果可知,不同產地黃芩水提物對Hep-2細胞的TC50均高于50 μg/mL,其對應的黃酮類成分模擬樣品的TC50為23.11~52.23 μg/mL。
2.2.4 兩種樣品的抗病毒活性評價 參照文獻方法[18-19]并略作調整后,采用細胞病變程度(CPE)法考察兩種樣品對RSV的抗毒性活性。取RSV,以維持液(按照文獻方法[18]配制)稀釋至滴度為100倍半數組織培養感染劑量(TCID50)。取上述病毒稀釋液100 μL,分別與“2.2.1”“2.2.2”項下不同質量濃度藥物溶液(黃芩水提物:2、5、10、20、40、80、160、320 μg/mL,以水提物計;模擬樣品:2、5、10、20、40、80、160、320 μg/mL,以混合對照品總量計)100 μL混合。取對數生長期Hep-2細胞,分別以5×103個/孔接種至96孔板中,培養16 h后,加入上述藥物與病毒的混合液,在倒置顯微鏡下觀察各給藥孔細胞的CPE,直至CPE值達到4+(即細胞死亡比例為75%~100%[18])時,記錄各組細胞病變情況。試驗同時設置對照組和陽性對照組,其中對照組加入細胞但不加入藥物,陽性對照組加入細胞和利巴韋林(0.2、0.5、1、2、4、8、16、32 μg/mL),同法處理并測定。各給藥劑量均參照文獻[18]和前期預試驗結果設定。試驗重復3次操作。采用Reed-Muench法[18]計算兩種樣品對RSV病毒的半數抑制濃度(IC50),并結合“2.2.3”項下測得的TD50值計算藥物的治療指數(TI):TI=TC50/IC50。當TI>1時判定為藥物有效;且該值越大,其安全范圍越大[18]。結果顯示,不同產地黃芩水提物及其黃酮類成分模擬樣品和陽性對照利巴韋林對RSV均有抗病毒作用(TI>1),抗病毒作用的強弱順序依次為利巴韋林>黃酮類組分模擬樣品>黃芩水提物(按IC50排序)。不同產地黃芩水提物及其對應的黃酮類成分模擬樣品的抗病毒活性測定結果詳見表2、表3。
由表2可知,S4樣品(產地:河北承德)水提物的IC50 最小(11.11 μg/mL),S3樣品(產地:山西)水提物的IC50最大(51.74 μg/mL);S1樣品(產地:內蒙古-1)和S6樣品(產地:內蒙古-2)水提物的IC50均為19.24 μg/mL;S5樣品(產地:甘肅)和S8樣品(產地:山東)水提物的IC50均為33.33 μg/mL。綜合考慮TI值大小后認為,S4樣品(產地:河北承德)水提物的抗病毒作用最強(TI=5.2),S3樣品(產地:山西)水提物的抗病毒作用最弱(TI=1.9)。
由表3可知,8批黃酮類成分模擬樣品都呈現出不同程度的抗RSV活性。綜合考慮IC50值和TI值的大小,按照4種成分含量構成比1 ∶ 0.235 ∶ 0.261 ∶ 0.042配制的E1樣品(模擬內蒙古-1產黃芩)和按照含量構成比1 ∶ 0.224 ∶ 0.111 ∶ 0.013配制的E4樣品(模擬河北承德產黃芩)的TI較大(均大于4),且后者的IC50明顯更低,因此認為E4樣品的抗病毒作用更強。而按照4種成分含量構成比1 ∶ 0.194 ∶ 0.101 ∶ 0.033配制的E3樣品(模擬山西產黃芩)IC50較大(13.37 μg/mL)、TI較小(1.85),表現出較弱的抗病毒活性。
2.3 兩種樣品中黃酮類成分含量與其抗病毒活性相關性分析
采用SPSS 17.0軟件分別對不同產地黃芩樣品的黃芩苷、漢黃芩苷、黃芩素、漢黃芩素含量與其抗RSV活性(以IC50值為指標)進行Pearson相關性分析。結果顯示,上述4種成分的含量與抗病毒活性的相關系數(r)依次為0.132 7、0.343 9、0.153 3、0.164 0(均小于0.5)。根據r值判斷黃芩中各黃酮類成分含量與其抗病毒活性無顯著相關性。
3 討論
已有多項研究證實,黃芩具有確切的抗病毒作用,且其療效的發揮與其所含的黃酮類成分密切相關[7-14]。大量文獻報道了不同產地、不同生長年限、野生與栽培黃芩中主要黃酮類成分的含量[20-24]。結合本課題組的前期研究,筆者初步總結了黃芩中黃酮類成分的含量構成特征。據郭玲玲等[20]的報道,不同生長年限(1、2、3年生)陜西產栽培黃芩中的黃酮類成分的含量情況如下:隨著生長年限的延長,黃芩苷和漢黃芩苷的含量呈上升趨勢,黃芩素和漢黃芩素的含量呈下降趨勢。申潔等[21]的研究結果則略有不同:河北、山西產3年生黃芩中上述黃酮苷類和苷元類成分的含量普遍高于1、2年生黃芩。本課題組也曾對陜西、山西、河南、山東產的不同生產年限(1、2、3年生)栽培黃芩中上述4種成分的含量進行了考察。結果發現,陜西、山西、河南產2年生栽培黃芩中上述黃酮類成分含量普遍高于1、3年生黃芩,而山東產3年生栽培黃芩的上述成分含量則高于1、2年生黃芩。筆者綜合上述已有研究[20-21]的含量測定數據發現,不同生長年限黃芩中黃芩苷含量(6.98%~22.59%)、漢黃芩苷含量(0.85%~6.14%)、黃芩素含量(0.11%~2.45%)、漢黃芩素含量(0.08%~0.34%)的變化均較大,其含量最高值是最低值的數倍甚至數十倍。黃酮類成分的含量構成特征受產地和生長年限等的影響很大,同一產地的黃芩因其生長年限不同,其黃酮類成分的含量構成比不同;同一生長年限的黃芩,因其產地不同,其黃酮類成分的含量構成比也不同。同時上述文獻數據顯示,除黃芩素與黃芩苷的含量構成比(0.006~0.713)波動較大外,漢黃芩苷、漢黃芩素與黃芩苷的含量構成比均相對較穩定,漢黃芩苷與黃芩苷含量構成比為0.194~0.280,漢黃芩素與黃芩苷的含量構成比為0.06~0.106。
李云靜等[22]研究了野生黃芩和栽培黃芩中黃芩苷、漢黃芩苷、黃芩素、漢黃芩素等的含量,結果表明栽培品的黃芩苷和漢黃芩苷含量高于野生品,而黃芩素和漢黃芩素含量無顯著差異,栽培品的質量整體優于野生品。這與李韋等[23]的研究結果相似,但與申潔等[21]、王丹等[24]的研究結果“野生黃芩中黃芩苷含量高于栽培黃芩”有所不同。筆者繼續對上述研究中4種黃酮類成分的含量構成比進行分析后發現,李云靜等[22]測得野生黃芩中4種成分的平均含量結構比為1 ∶ 0.316 ∶ 0.091 ∶ 0.043,栽培黃芩則為1 ∶ 0.301 ∶ 0.112 ∶ 0.043;申潔等[21]測得野生黃芩中4種成分的平均含量結構比為1 ∶ 0.186 ∶ 0.042 ∶ 0.022,而栽培黃芩則為1 ∶ 0.182 ∶ 0.034 ∶ 0.023。上述兩項研究結果表明,在黃芩野生品與栽培品中這4種黃酮類成分的含量構成比沒有顯著差異。
前期相關研究表明,不論在道地產區還是非道地產區,受不同生長因素(如溫度、光照、濕度、降水量、土壤)和栽培方式的影響,不同生長年限的黃芩野生品或栽培品都存在質量不均一的情況,即使同一產地、同一生長年限的栽培品或野生品,其質量也存在不均一的問題[20-24]。迄今為止,關于“黃芩藥材質量的優劣與黃酮類成分含量高低有關,還是與黃酮類成分的特定構成有關”的觀點尚無定論。基于此,本研究選擇了8個不同產地的黃芩道地藥材和非道地藥材,對主要4種黃酮類成分含量、構成特征及其抗RSV活性進行了研究。與王劍等[7]和Ma SC等[25]的研究證實的黃芩提取物對RSV病毒具有不同程度的抑制作用一致,本課題組的研究也得到了類似的結果:8批不同產地黃芩水提物對RSV均具有抑制作用,其IC50為11.11~51.74 μg/mL,TI為1.86~5.20;道地產區(河北承德)的黃芩樣品(S4)對RSV的抗病毒作用優于其他7個產地樣品。朱立革[15]和宋琳莉[16]的藥理研究結果證實,道地產區黃芩的抗病毒作用優于非道地產區黃芩,本文結果與之基本一致。本研究通過4種黃酮類成分含量與抗病毒活性的相關性分析發現,黃芩抗RSV病毒作用與其所含的黃酮類單體成分含量無顯著相關性(r<0.5);而以黃芩苷、漢黃芩苷、黃芩素、漢黃芩素的含量構成比為1 ∶ 0.224 ∶ 0.111 ∶ 0.013配制的模擬樣品(E4)對RSV的抑制作用最強,這提示黃芩的抗病毒活性可能是多成分協同作用的結果。本研究按不同產地黃芩樣品的含量構成特征制備模擬樣品并比較其抗病毒作用,結果顯示,8個模擬樣品都具有抗RSV活性,其IC50為4.87~14.61 μg/mL,TI為1.85~4.75,并以模擬樣品E4(4種成分含量結構比為1 ∶ 0.224 ∶ 0.111 ∶ 0.013)對RSV的抑制作用為最強。E4對應的黃芩樣品S4即為道地產區河北承德產樣品,提示道地產區(河北承德)的黃芩具有較優的黃酮類成分含量構成特征,該特征可能是黃芩道地藥材發揮最強抗病毒療效的重要物質基礎,也是其“優質”的重要體現。這一研究結果與張明華等[26]報道的“藥材道地性的物質基礎本質,即組分構成的獨特性”的觀點相吻合。
綜上所述,本研究初步驗證了當黃芩樣品中主要黃酮類成分具有適當的含量構成比(1 ∶ 0.224 ∶ 0.111 ∶ 0.013)時,其抗病毒作用較強。鑒于產地、生長年限、品種來源等因素均會影響黃芩藥材中黃酮類成分的含量及構成特征,加之水提物與黃芩藥材本身的成分也可能存在一定差異,因此關于黃芩道地性的“質-效”本質還有待進一步深入研究予以驗證。此外,因研究條件有限,本研究僅收集了8批不同產地的樣品,樣本量較小,故后續研究不僅需要擴大樣本量,同時還需要開展道地藥材中最優含量構成比組分形成的影響因素規律研究,為保證道地藥材“質優效佳”的穩定性和持續性提供更多的數據支持。
參考文獻
[ 1 ] 國家藥典委員會.中華人民共和國藥典:一部[S]. 2015年版.北京:中國醫藥科技出版社,2015:301-302.
[ 2 ] 宋揚文,陳忻.中藥黃芩藥理作用研究進展[J].中國中醫藥科技,2010,17(4):375-377.
[ 3 ] 李子,郝近大.黃芩道地產區形成與變遷的研究[J].時珍國醫國藥,2010,21(12):3290-3292.
[ 4 ] 李化,賀敬霞,牟倩倩,等. BBD-RSM結合多指標法優選黃芩黃酮的紅外快提工藝[J].中藥材,2017,40(9):2133-2137.
[ 5 ] 李化,劉靜,董紅敬,等. HPLC法與UPLC法同時測定黃芩中5種黃酮類成分含量的比較[J].中國藥房,2014,25(35):3293-3296.
[ 6 ] LEE KJ,JUNG PM,OH YC,et al. Extraction and bioactivity analysis of major flavones compounds from Scutellaria baicalensis using in vitro assay and online screening HPLC-ABTS system[J]. J Anal Methods Chem,2014. DOI:10.1155/2014/563702.
[ 7 ] 王劍,侯林,陳亞喬,等.黃芩提取物體外抗病毒藥效學研究[J].中成藥,2017,39(9):1924-1927.
[ 8 ] 姜茗宸,汪受傳,徐秋月.黃芩素抗病毒作用研究[J].吉林中醫藥,2016,36(7):753-756.
[ 9 ] 丁嬋,褚秀玲,蘇建青,等.黃芩苷抗病毒作用研究進展[J].中獸醫醫藥雜志,2016,35(2):27-29.
[10] 徐珊,王樂,楊巧芳,等.黃芩抗病毒藥理作用研究述評[J].中華中醫藥學刊,2007,25(7):1355-1357.
[11] 吳瑩,金葉智,吳珺,等.黃芩主要成分體外抗甲型流感病毒作用的研究[J].北京中醫藥大學學報,2010,33(8):541-545.
[12] 彭海亭.中藥柴胡、黃芩治療流感300例療效觀察[C]//? ? 98全國中藥研究暨中藥房管理學術研討會論文匯編.北京:中華中醫藥學會,1998:87-88.
[13] 郭曉松,位寧,王影霞.黃芩苷聯合抗病毒藥物治療重癥流感的效果觀察[J].中外女性健康研究,2016(18):186、193.
[14] 施恒飛.黃芩苷抗呼吸道合胞病毒感染作用研究[D].南京:南京大學,2016.
[15] 朱立革.道地黃芩與非道地黃芩的藥效學實驗研究[D].哈爾濱:黑龍江中醫藥大學,2010.
[16] 宋琳莉.基于不同來源黃芩物質基礎拮抗流感病毒的實驗研究[D].北京:北京中醫藥大學,2009.
[17] 龍翠華,田其學,唐正平.黃芩水提工藝的研究[J].湖南中醫雜志,2005,21(3):115-116.
[18] 王輝強,馬琳琳,蔣建東,等.重組人干擾素α2b體外廣譜抗呼吸道病毒藥效學研究[J].藥學學報,2014,49(11):1547-1553.
[19] 傅繼華.病毒學實用實驗技術[M].濟南:山東科學技術出版社,2001:61.
[20] 郭玲玲,劉毅,祿夢杰,等. HPLC法同時測定陜西產不同生長年限野生和栽培黃芩中9種化學成分的含量[J].中草藥,2018,49(4):935-940.
[21] 申潔,李珮,劉雙雙,等.河北與山西產黃芩藥材中主要黃酮類成分的含量比較研究[J].中國現代中藥,2019,21(4):487-493.
[22] 李云靜,張建逵,王冰,等.不同產地黃芩藥材中黃芩苷等5種黃酮類成分含量的比較[J].時珍國醫國藥,2016,27(12):2985-2988.
[23] 李韋,李化,楊濱,等.栽培黃芩和野生黃芩化學成分比較研究[J].中國中藥雜志,2008,33(12):1425-1429.
[24] 王丹,張秋燕,楊興鑫,等.基于HPLC指紋圖譜的黃芩道地藥材與非道地藥材的鑒別研究[J].中國中藥雜志,2013,38(12):1951-1960.
[25] MA SC,DU J,BUT PP,et al. Antiviral Chinese medicinal herbs against respiratory syncytial virus[J]. J Ethnopharmacol,2002. DOI:10.1016/S0378-8741(01)00389-0.
[26] 張明華,封亮,胡紹英,等.藥材道地性的物質基礎本質:組分結構的獨特性[J].中國中藥雜志,2013,38(1):136-140.
(收稿日期:2019-09-16 修回日期:2020-04-01)
(編輯:段思怡)

