骨肽原液對骨髓間充質干細胞成骨分化作用的影響
張 媛, 吳彥霖, 納 濤, 楊澤岸, 胡文言, 高 華
(1.中國食品藥品檢定研究院化學藥品檢定所藥理室, 北京 102629; 2.中國生化制藥工業協會,北京 100068)
骨肽類藥物是由新鮮或冷凍的豬、鹿或胎牛四肢骨經生物技術提取的骨活性物質精制而成,內含有骨形成蛋白(bone morphogenetic protein,BMPs)等多種多肽類骨代謝活性因子,以及多種骨修復所需的無機元素、氨基酸及微量元素等[1,2]。目前骨肽類藥物作為治療骨折的臨床常用藥物,主要通過刺激成骨細胞增殖,對鈣磷代謝進行調節,使得鈣沉積有效增加,從而幫助新骨形成[3-4]。骨髓間充質干細胞(marrow mesenchymal stem cells,BMSCs)是骨髓中的一種多能干細胞,具有干細胞的所有共性,即自我更新和多向誘導分化能力,具有來源廣泛、獲取簡單、易于培養、體外增殖能力強和自體移植無排斥反應等特點,廣泛應用于組織工程及再生醫學領域,被公認為是骨組織工程最為常用的種子細胞[5]。機體骨折后的修復過程類似于胚胎期骨形成,需要骨折部位局部聚集足夠數量的BMSCs來進行骨修復,近年來許多體外研究以不同藥物作為誘導劑加入BMSCs細胞培養體系中,對其進行成骨誘導分化。在BMSCs誘導分化過程中,多種骨代謝因子發揮了重要作用,骨肽中含有多種骨誘導活性因子,具有誘導BMSCs成骨細胞分化的潛質。因此,本研究選用BMSCs為研究對象,探索骨肽原液誘導胎兒骨髓間充質干細胞(fetal marrow mesenchymal stem cells, F-BMSCs)成骨分化的分子作用機制,并對不同廠家的骨肽原液進行比較。
1 實驗材料
1.1 藥物與試劑BMSCs完全培養基(HUXMF-90011)、0.1%茜素紅S染液,購于賽業生物科技有限公司;Fetal Bovine Serum(10099141C)、0.25%Trypsin-EDTA(25200056)、Stempro成骨誘導分化試劑盒(A1007201)購于Gibco;磷酸鹽緩沖液(SH30256.01B)購于Hyclone;CCK-8細胞增殖-毒性檢測試劑盒(CK04)購于Dojindo;4%多聚甲醛(P1110-100ml)購于索萊寶;ALP檢測試劑盒(P0321)、SDS-PAGE蛋白上樣緩沖液(6×)(P0015F)、 Western及IP細胞裂解液(無抑制劑)(P0013J)購于碧云天;TRIzol(15596026)購于Invitrogen;DEPC-treated water(R0601)、RevertAid? First Strand cDNA Synthesis Kit(K1622)購于Fermentas;Runx2 Monoclonal Antibody(AMAB90591)、Anti-Actin antibody(A3853-100UL)購于Sigma;Osteocalcin Polyclonal Antibody (PA5-11849)、Western blotting顯影液(34095)購于Thermo;兔源二抗(NA9340-1ML)、鼠源二抗(NXA931-1ML)購于GE;脫脂奶粉(232100)購于DIFCO;硝酸纖維素膜(IPVH00010)購于PALL;人間充質干細胞分析試劑盒(562245) 購于BD。 骨肽原液來源于4個生產廠家:廠家A、B、C、L。
1.2 細胞株大鼠骨肉瘤細胞株(UMR106),購于中國協和醫科大學基礎醫學院細胞中心;胎兒骨髓間充質干細胞(F-BMSCs),購于賽業生物科技有限公司。
1.3 儀器生物安全柜,Thermo,型號:1389 A2;二氧化碳培養箱,Thermo,型號:3141;高速離心機,Beckman Coulter,型號:6R;細胞計數儀,Beckman Coulter,型號:Z2;多功能微板檢測儀酶標儀,Biotek,型號: SYNERGY HT;電熱恒溫水浴鍋,上海森信,型號:DK S26;紫外分光光度計,北京普析,型號:TU-1901;實時熒光定量PCR儀,Applied Biosystems,型號:AB7500 FAST;PeqSTAR 96 universal gradient PCR儀,PeqlabGmbH,型號:BCS015850;超微量分光光度計,Malcom,型號E-SPECT;醫用洗片機,泰興市泰晟醫療器械廠,型號 TS435-A;流式細胞儀,BD FACS Calibur;電泳儀,Bio-Rad PowerPac;超純水機,ADVANTAGE,型號:A10。
2 實驗方法
2.1 促UMR106細胞增殖作用[6]UMR106細胞融合度達到80%~90%時,用0.25% Trypsin進行消化。將消化下來的細胞用1%FBS培養基稀釋成細胞懸液,調整細胞濃度為2×107·L-1接種至96孔板,每孔加入100 μL。細胞貼壁24 h后,吸棄孔內培養基,設不同組別,更換培養基。其中,陰性對照組加入含PBS(與加入藥物等體積)的1%FBS的培養基,供試品組加入含不同濃度骨肽原液的1%FBS培養基,另設不含細胞的完全空白組。將廠家A、B、C、L骨肽原液配制為0.06、0.125、0.25、0.5、1.0、2.0 g·L-1濃度的含藥1%FBS培養基,每孔分別加入對應的組別藥物100 μL,作用48 h、72 h后使用CCK-8法進行測定,計算細胞增殖率,以細胞增殖率的大小評價骨肽原液促UMR106細胞增殖活性。細胞增殖率/%=[(供試品組OD值-完全空白組OD值)/(陰性對照組OD值-完全空白組OD值)]×100%
2.2 F-BMSCs免疫表型檢測F-BMSCs置于37 ℃,5%CO2培養箱中培養,當細胞融合度達到80%~90%時,用人間充質干細胞分析試劑盒中的抗體標記細胞,并用流式細胞儀檢測。用FlowJo軟件對間充質干細胞表面標志蛋白CD73、CD90、CD105和陰性對照標志蛋白CD11b、CD19、CD34、CD45、HLA-DR進行分析。
2.3 CCK-8法檢測骨肽原液對F-BMSCs的影響當培養的F-BMSCs融合度達到80%~90%時,消化并調整細胞濃度為2×107·L-1接種至96孔板,每孔培養體系為100 μL。24 h后,吸棄孔內完全培養基,每孔加入含1 g·L-1骨肽原液的完全培養基100 μL,繼續培養,并于加藥后72 h、96 h、144 h使用 CCK-8法進行測定,實驗操作參照試劑盒說明書。
2.4 骨肽原液對F-BMSCs誘導成骨ALP活性檢測當培養的F-BMSCs融合度達到80%~90%時,消化并調整細胞濃度5×107·L-1接種至12孔板中,每孔培養體系為1 mL。培養24 h后,不同組別更換培養基,每孔加入1 mL相應培養基。設置陰性對照組:含PBS(與加入藥物等體積)的完全培養基;誘導組:含PBS(與加入藥物等體積)的誘導液;供試品組:含1.0 g·L-1骨肽原液的誘導液。每2~3 d更換新鮮的各組培養基。誘導5 d、7 d 時,去除12孔板中培養基,用1 mL PBS洗1遍,盡量將PBS除凈,每孔加入100 μL Western及IP裂解液(無抑制劑),用槍吹打數下,使裂解液與細胞充分接觸,收集細胞裂解液。按照ALP活性測定試劑盒說明書進行測定。
2.5 茜素紅S礦化結節染色當培養的F-BMSCs融合度達到80%~90%時,消化并調整細胞濃度5×107·L-1接種至12孔板中,每孔培養體系為1 mL。培養24 h后,不同組別更換培養基,每孔加入1 mL相應培養基。設置陰性對照組:含PBS(與加入藥物等體積)的完全培養基;誘導組:含PBS(與加入藥物等體積)的誘導液;供試品組:含1 g·L-1骨肽原液的誘導液。每2~3 d更換新鮮的各組培養基。每2~3 d更換新鮮的各組培養基。誘導14 d 時,經4%多聚甲醛固定30 min,茜素紅S染色,顯微鏡觀察,拍照。
2.6 Real time RT-PCR檢測
2.6.1RNA抽提 當培養的F-BMSCs融合度達到80%~90%時,消化并調整細胞濃度5×107·L-1接種至6孔板中,每孔培養體系為2 mL。培養24 h后,不同組別更換培養基,每孔加入2 mL相應培養基。設置陰性對照組:含PBS(與加入藥物等體積)的完全培養基;誘導組:含PBS(與加入藥物等體積)的誘導液;供試品組:含1 g·L-1骨肽原液的誘導液。每2~3 d 更換新鮮的各組培養基。分別在第誘導6、8 d 時,用TRIzol裂解并提取各組細胞RNA。
2.6.2cDNA鏈的合成 每組取1 μg RNA進行反轉錄制備得到cDNA用于后續實驗。
2.6.3Real time RT-PCR 利用引物設計軟件Primer Premier 5.0 進行引物設計,內參為GAPDH。引物信息見下Tab 1。
以SYBR Green定量的Real time-PCR方法檢測基因表達,以GAPDH作為內參,采用法計算mRNA的相對表達水平(根據2-△Ct法計算樣品中檢測基因相對于內參基因GAPDH的相對表達量,具體算法如下:相對表達量=2-(Ct檢測基因-Ct GAPDH))。

Tab 1 Primer sequences used for real-time PCR
2.7 Western blot檢測當培養的F-BMSCs融合度達到80%~90%時,消化細胞并調整細胞濃度5×107·L-1接種至6孔板中,每孔培養體系為2 mL。培養24 h后,不同組別更換培養基,每孔加入2 mL相應培養基。設置陰性對照組:含PBS(與加入藥物等體積)的完全培養基;誘導組:含PBS(與加入藥物等體積)的誘導液;供試品組:含1 g·L-1骨肽原液的誘導液。每2d ~3 d 更換新鮮的各組培養基。
在誘導第6 d、8 d、10 d時,使用細胞蛋白裂解液裂解細胞,并將收取的蛋白樣品置于-20 ℃保存備用。各組蛋白樣品采用SDS-PAGE電泳后,濕轉,并將濕轉后的硝酸纖維素膜封閉,然后膜與一抗(1 ∶ 1 000)4 ℃孵育過夜后,與二抗(1 ∶ 10 000)室溫孵育1 h,最后用化學發光液顯色成像。
3 實驗結果
3.1 促UMR106細胞增殖作用骨肽原液藥物濃度在0.06~2.0 g·L-1范圍內對UMR106細胞的影響具體結果詳見Fig 1。廠家A的骨肽原液對UMR106細胞無促進增殖作用;廠家B、C、L的骨肽原液對UMR106細胞有促進增殖作用,且在0.06~1.0 g·L-1范圍內對UMR106細胞增殖作用呈時間-劑量依賴性。
3.2 F-BMSCs免疫表型檢測各表面標志蛋白表達陽性的細胞占細胞總體的比例:CD73為99.6%,CD90為99.0%,CD105為98.5%,均大于95%;各表面標志蛋白表達陰性的細胞占細胞總體的比例:CD11b/CD19/CD34/CD45/HLA-DR為0%。測定結果符合目前國際干細胞協會提出的干細胞鑒別標準。結果詳見Fig 2。
3.3 CCK-8法檢測骨肽原液對F-BMSCs的影響CCK-8細胞增殖-毒性檢測試劑盒測定結果表明,廠家A、B、C、L四個生產廠家的骨肽原液,在1.0 g·L-1濃度作用下,對F-BMSCs的增殖未見明顯改變。具體測定結果詳見Fig 3。
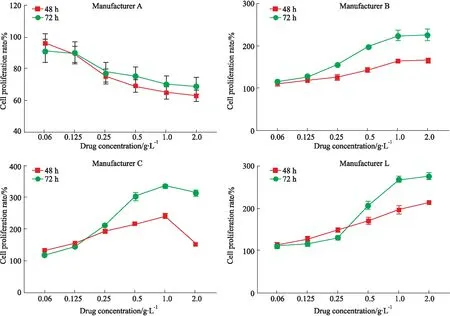
Fig 1 Effect of proliferation on UMR106 cells of ossotide stock solution from four n=3)
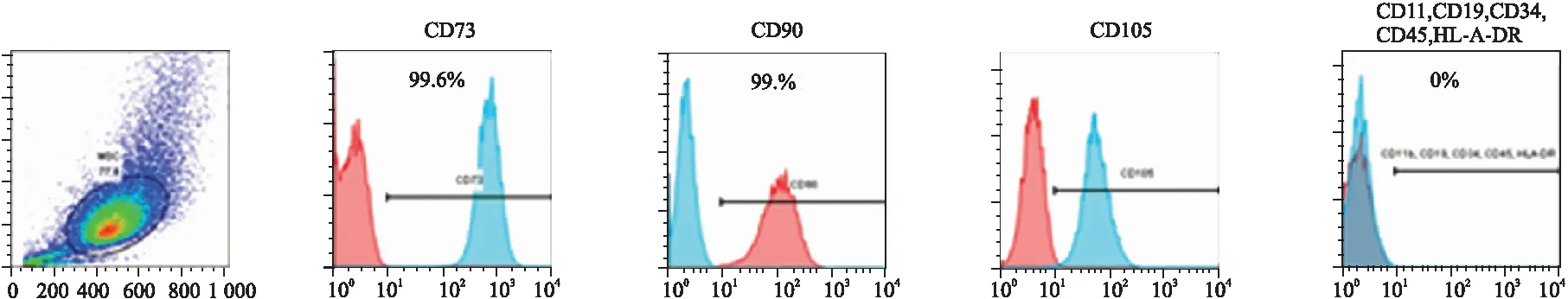
Fig 2 Expression rate of various surface marker proteins of F-BMSCs
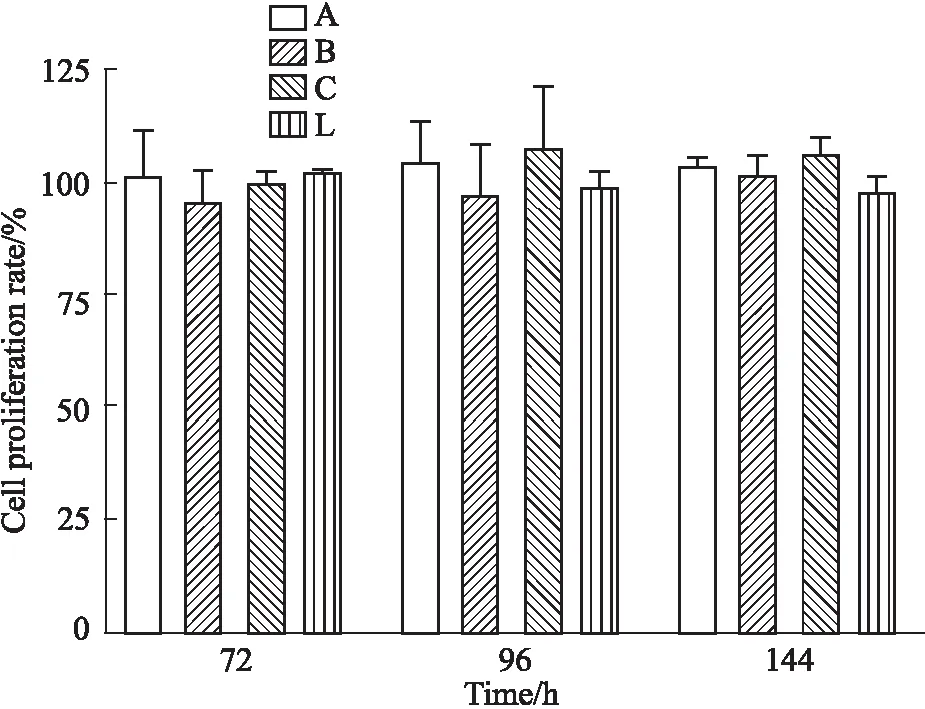
Fig 3 Effect of proliferation on F-BMSCs of ossotide stock solution from four manufacturers n=6)
A,B,C,L :represent for manufacture A,B,C,L
3.4 骨肽原液對F-BMSCs誘導成骨ALP活性檢測F-BMSCs誘導7 d 時,與陰性對照組相比,誘導組F-BMSCs的ALP活性為(1.40±0.046)mmol·L-1,明顯增加(P<0.05),表明誘導成功。與誘導組相比,供試品組中廠家C骨肽原液處理的F-BMSCs ALP活性明顯增高分別為(2.46±0.148)mmol·L-1,差異有顯著性(P<0.05);廠家B、L骨肽原液處理的F-BMSCs ALP活性高于誘導組,但差異無顯著性(P>0.05)。具體結果詳見Fig 4。
3.5 茜素紅S礦化結節染色F-BMSCs誘導第14 d,與陰性對照組相比,誘導組F-BMSCs茜素紅染色呈陽性,表明誘導成功F-BMSCs。與誘導組相比,肉眼觀察供試品組(廠家B、C、L)骨肽原液處理的F-BMSCs紅色明顯增強;顯微鏡下,廠家B、C、L骨肽原液處理的F-BMSCs茜素紅染色陽性結節狀覆蓋面積增多。染色結果見Fig 5。
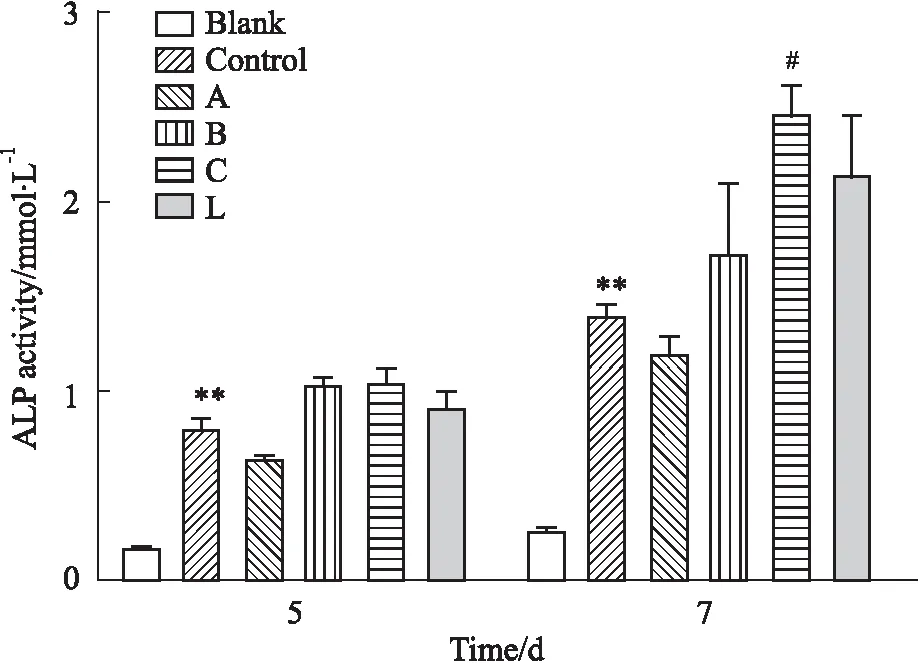
Fig 4 Effect of ossotide stock solution on ALP
**P<0.01vsblank group;#P<0.05vscontrol group. Blank for negative group, control for osteoinduction group;A,B,C,L for ossotide group(manufacturer A,B,C,L).
3.6 Real time RT-PCR測定結果F-BMSCs誘導6 d時,與陰性對照組相比,誘導組、供試品組(廠家B)F-BMSCs中成骨分化標志物基因OPN、OCN、Runx2、ALP的mRNA表達量無明顯變化;誘導8 d 時,供試品組F-BMSCs 上述mRNA的表達量增加,且高于誘導組。檢測結果見Fig 6。
3.7 Western blot檢測結果F-BMSCs誘導第6~8 d 時,與陰性對照組相比,誘導組與供試品組(廠家B)F-BMSCs的Runx2、Osteocalcin(OCN)蛋白表達均增加,但兩組無明顯差別;誘導第10 d 時,供試品組F-BMSCs Runx2、OCN蛋白表達明顯高于誘導組。檢測結果見Fig 7。
4 討論
BMSCs作為骨組織工程的常用細胞,具有成骨細胞群的增殖和分化行為,即高ALP活性和形成礦化骨基質的能力。BMSCs在體外向成骨細胞方向誘導分化時,大致主要經歷細胞增殖期和細胞分化期:首先根據細胞所在微環境進行譜系定向;繼而進入細胞增殖階段;之后為成骨早期,細胞分泌大量ALP,促進細胞外基質成熟;最后為成骨后期,即基質礦化階段,成熟的成骨細胞礦化活力增加,促進細胞外基質礦化,形成鈣化結節[7-8]。因而,ALP及礦化結節分別是BMSCs向成骨細胞分化的早期及晚期的特異性標志。因此,ALP活性測定和茜素紅染色是成骨分化最為常用的鑒定手段[9]。本研究選取4個不同生產廠家的骨肽原液進行成骨分化實驗,部分廠家的骨肽原液作用于BMSCs后,供試品組F-BMSCs的ALP活性及茜素紅染色均較誘導組明顯增強,且兩指標測定結果基本一致。表明骨肽原液可一定程度促進BMSCs的成骨作用。

Fig 5 Results of Alizarin red staining assay. Blank for negative group, control for osteoinduction group.
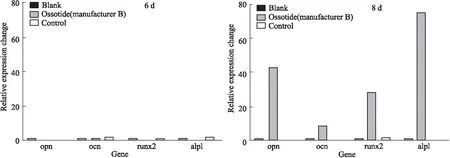
Fig 6 The expression results of osteogenic differentiation related marker genes detected by RT-PCR after osteogenic induction of F-BMSCs by ossotide (manufacturer B)
Blank for negative group, control for osteoinduction group.
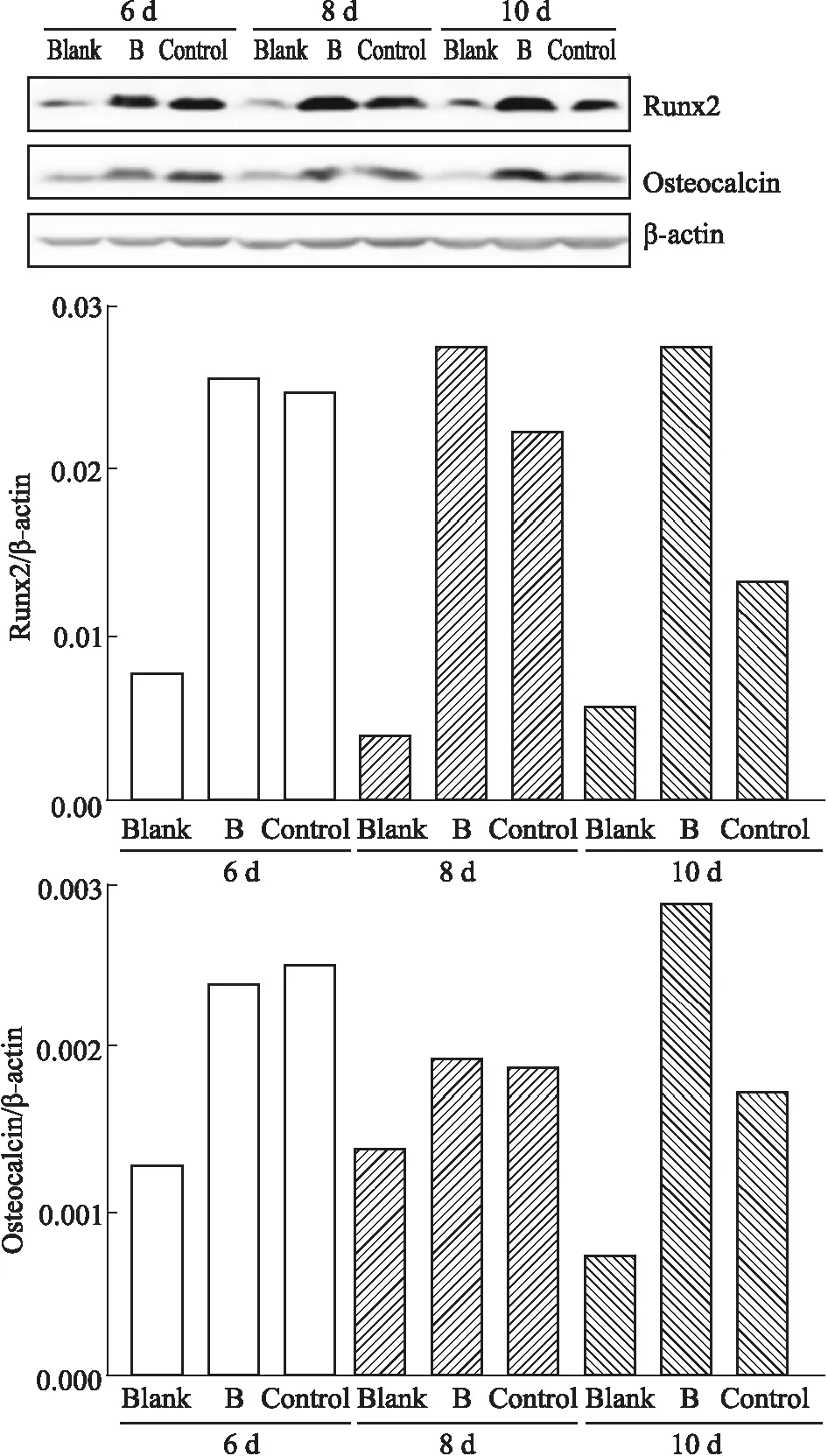
Fig 7 The expression results of osteogenic differentiation related protein detected by Western blot after osteogenic induction of F-BMSCs by ossotide (manufacturer B)
Blank for negative group, control for osteoinduction group, B for ossotide group(manufacturer B).
成骨相關基因的表達亦是BMSCs 向成骨細胞分化的特點,這是體內成骨的典型特征。ALP、Runx2、OCN、OPN等基因是成骨細胞標志基因。成骨分化過程中,ALP、Runx2、OCN、OPN等成骨相關基因表達上調,這些基因在成骨分化不同時期表達,調控骨基質的分泌和礦化。其中,Runx2 是 Runx 家族的轉錄因子之一,可與許多其他轉錄因子和共調節因子在其靶基因的轉錄調控中相互作用,是成骨分化和骨形成過程中關鍵的轉錄因子,亦是骨形成過程中早期并最具特征性的標志蛋白[10-12]。OCN是由成熟成骨細胞分泌的最豐富的非膠原蛋白之一,促進骨形成礦化物質沉積的正常鈣化,維持骨的正常礦化速率,與羥磷灰石結合抑制其結晶的形成,并抑制軟骨細胞礦化的速率,從而促進骨組織礦物質沉積的正常鈣化過程,是成骨細胞分化晚期的特異性指標[13-14]。實驗結果顯示:與誘導組相比,BMSCs細胞經骨肽原液處理后,可使得ALP、Runx2、OCN、OPN基因的 mRNA表達量顯著上調,Runx2、OCN蛋白表達量增加,表明骨肽原液具有促進誘導F-BMSCs成骨細胞分化的作用。
此外,本研究采用王燦等[6]報道的骨肽類藥物體外活性測定方法,對4個生產廠家的骨肽原液進行活性測定,測定結果顯示廠家A生產的骨肽原液對UMR106細胞無促進增殖作用;廠家B、C、L生產的骨肽原液對UMR106細胞有促進增殖作用,且在一定劑量范圍內對UMR106細胞增殖作用呈時間-劑量依賴性。以上結果表明,骨肽原液的生物活性高低與其促進BMSCs誘導成骨作用的強弱基本一致。
綜上所述,骨肽原液可通過上調ALP、Runx2、OCN、OPN等成骨相關標志基因,促進Runx2、OCN等成骨相關蛋白的表達,發揮促進骨形成的活性作用。

