基于磁性材料的適配體傳感器在赭曲霉毒素超靈敏檢測中的研究進展
蔡小霞,苑靜,林童,郭徐靜,熊勇華,吳科盛,郭亮*
1(南昌大學 食品科學與技術國家重點實驗室,江西 南昌,330047) 2(南昌大學 中德聯合研究院,江西 南昌,330047) 3(江西省獸藥飼料監察所,江西 南昌,330029)
赭曲霉毒素是一類由曲霉屬(Aspergillus)和青霉屬(Penicillium)產生的有毒次級代謝產物,主要包括赭曲霉毒素A(ochratoxin A,OTA),赭曲霉毒素B(ochratoxin B,OTB)和赭曲霉毒素C(ochratoxin C,OTC)。其中OTA毒性最大,對人和動物具有致畸性、致癌性及免疫毒性等多種毒性作用,已被世界衛生組織國際癌癥研究署定為2B類致癌物[1]。OTA因其化學性質穩定而廣泛存在于谷糧類食品和飼料等農產品中,對人畜健康和世界經濟造成的危害僅次于黃曲霉毒素B1(aflatoxin B1,AFB1)[2]。目前食品中OTA的定性、定量檢測方法主要包括色譜法、酶聯免疫法(enzyme linked immunosorbent assay,ELISA)和免疫層析試紙條法(immunochromatographic test strip,ICA)等。其中,高效液相色譜法是當前常用的確證定量檢測方法,但是該方法需要昂貴的大型儀器設備、繁復費時的樣品前處理過程以及相應的專業技術人員,檢測成本高且耗時費力[3]。ELISA和ICA均為基于抗原、抗體特異性結合的免疫學檢測方法,具有特異性好、經濟簡便、耗時少等優點,已被廣泛用于食品中有害物質的快速篩查及現場檢測。但是免疫學檢測中使用的抗體穩定性差、制備過程復雜、批間差異大且成本高,檢測結果的重復性難以控制,檢測條件及檢測產品保存條件要求較高[4]。
核酸適配體是通過指數富集配體系統進化技術從隨機寡核苷酸文庫中篩選獲得的,能與相應配體進行高親和力特異性結合的寡核苷酸序列(DNA或RNA)。它與配體間的親和力可與抗原抗體間相互作用相媲美,同時具有抗理化因素干擾能力強、可體外人工合成、制備成本低且無批間差異及易運輸保存等諸多優點。因此,以適配體替代抗體作為識別元件的生物傳感器已逐漸成為分析檢測領域的研究熱點之一。CRUZ-AGUADO等[5]于2008年首次篩選出具有高親和力和高特異性的OTA核酸適配體并已被廣泛應用,但迄今OTB和OTC適配體尚未見報道。適配體傳感器常用的檢測模式與免疫學檢測方法類似,包括競爭型和夾心型2類。其中,對真菌毒素等小分子化合物的檢測多采用目標物和互補DNA(complementary DNA,cDNA)競爭結合適配體的模式進行。雖然適配體傳感器已被廣泛用于真菌毒素等各類目標物的分析,但是由于樣品基質可干擾檢測信號及目標物的識別,因此其仍難以實現對復雜樣品中痕量目標物的快速超靈敏檢測。
表面功能化磁性微納米材料,尤其是磁性亞微米或納米材料,因其比表面積大、磁操作簡便、溶液中懸浮性良好,可有效提高磁珠表面的反應或吸附效率,并實現待測物或檢測探針與樣品基質的快速分離及富集濃縮[6]。因此,磁性微納米材料在復雜樣品前處理[7]、傳感器構建[8]和即時檢測新方法建立[9]等分析測試領域均有廣泛應用。其中,基于磁性材料以核酸適配體為識別元件的磁性適配體傳感器,具有識別反應效率高的特點,可通過快速分離富集待測物或信號探針提高復雜基質檢測時的信噪比,進而提高適配體傳感器的檢測靈敏度,以及簡化操作并縮短檢測時間等。基于上述優點,近年來適配體傳感器、基于磁性材料的傳感器以及磁性適配體傳感器的相關研究數量均迅速增加(圖1)。其中,磁性適配體傳感器相關研究的增長最為顯著,近十年來開始逐步受到關注。
圖1 由Web of Science提供歷年來磁性傳感器、適配體傳感器、磁性適配體傳感器的相關論文發表情況Fig.1 Publishment on magnetic sensor, aptasensor andmagnetic aptasensor over the years from Web of Science
由于適配體與靶標識別后不能產生可檢測的特殊信號,故需將其識別過程通過標記探針或化學反應,轉換成易識別的物理或化學信號。根據輸出信號的不同,可將適配體傳感器分為光學傳感器、電化學傳感器、核酸定量型傳感器等。近年來,隨著納米技術的快速發展,納米材料已被廣泛應用于改進或替代上述各類傳感器的傳統信號生成模式,以提高其檢測靈敏度及穩定性。此外,基于核酸擴增反應的生物技術亦被越來越多地應用于適配體傳感器的信號放大。本文綜述了2011年以來基于磁性材料的適配體傳感器在赭曲霉毒素超靈敏檢測中的應用,其中著重對近5年來此類傳感器在設計思路、適配體檢測探針的制備方法以及應用納米材料和生物技術提高其檢測靈敏度等方面的最新進展進行了詳細分析,以期為相關科研工作者在真菌毒素的超靈敏檢測提供一定的理論及應用參考依據。
1 光學磁性適配體傳感器
光學適配體傳感器是指將適配體和目標分子之間的特異性相互作用轉變為可測定的光學信號的裝置,具有操作簡便、靈敏度高、成本低等特點[10]。各類光學磁性適配體傳感器在OTA檢測方面的應用及其機理如下所述。
1.1 比色法適配體傳感器
比色法是光學傳感器中最為常見且簡便的一種檢測模式,主要借助顏色反應對溶液中的化合物進行檢測。該方法不需要昂貴復雜的儀器,且可實現裸眼檢測。由于酶可提高顯色反應速率、放大顯色信號,因此酶促顯色反應在比色傳感器中最為常用。LIN等[11]以適配體為識別元件,并利用適配體連接表面修飾cDNA片段的磁珠和裝載大量辣根過氧化物酶(horseradish peroxidase,HRP)的脂質體制備三元復合物作為磁性檢測探針。檢測時,OTA可競爭結合適配體、破壞檢測探針,從而產生游離脂質體。磁分離去除未反應的檢測探針后,通過裂解磁吸上清中的脂質體釋放HRP,即可催化3,3′,5,5′-四甲基聯苯胺(3,3′,5,5′-tetramethylbenzidine,TMB)反應顯色進行檢測。與傳統ELISA相比,該方法的競爭反應在懸浮于溶液中的磁珠表面進行,而非孔表面,反應面積大大增加,通過磁分離可快速簡便地實現競爭反應產物和檢測探針的分離,避免了包板、洗板等繁復的操作步驟。因此,磁珠的應用有效地提高了反應效率,同時簡化了檢測流程。此外,因單個脂質體中包裹了大量HRP,該傳感器檢測靈敏度較高,其檢出限(limit of detection,LOD)可達0.023 ng/mL。
由于天然酶的穩定性較差、價格昂貴,近年來具有模擬酶活性的各種納米材料因催化活性高、穩定性好、價格低廉且可大量制備等優點,在傳感、環境處理及醫學等領域的應用進步顯著[12]。WANG等[13]設計了一種基于表面修飾cDNA的金磁納米粒子的OTA比色傳感器。該金磁納米粒子由金納米粒子(Au nanoparticles,AuNPs)和Fe3O4納米粒子摻雜而成,同時具備類過氧化物酶活性和氧化鐵的磁學特性。當反應體系中存在OTA時,金磁納米粒子可從固相支持物上被競爭下來,同時通過磁吸實現催化劑的富集與分離。在該傳感器中,信號探針自身具有磁性,因此可簡便地通過磁富集提升信號強度,從而增高檢測靈敏度。TIAN等[14]則將堿性磷酸酶(alkaline phosphatase,ALP)和具備類過氧化物酶活性的MnO2納米片聯用構建了一種“turn off”型OTA比色傳感器。當OTA存在時,通過適配體和cDNA雜交雙鏈結合于納米磁珠表面的ALP被競爭下來,并催化抗壞血酸磷酸鹽產生抗壞血酸(ascorbic acid,AA)。由于AA具有還原性,可將Mn4+轉化為Mn2+,破壞MnO2納米片的結構和模擬酶活性,從而使TMB顯色降低。
此外,變色染料(如酸堿指示劑)也可用于輸出比色信號。和常見酶促反應顯色相比,這類試劑具有顯色步驟簡單、價格低廉等特點。HAO等[15]構建了一種基于(磁性)石墨烯、適配體和4種變色染料的比色傳感器,用于4種毒素的同時檢測。該傳感器中的磁性石墨烯通過4種適配體,分別與荷載不同變色染料的石墨烯結合。當某種待測物存在時,其相應適配體連接的荷載染料的石墨烯與磁性石墨烯分離。由于4種變色染料的釋放及顯色條件不同,競爭反應體系經磁分離后,通過調節溶液pH值,可依次釋放不同染料并呈現不同的顏色。其中,對OTA的檢測范圍及LOD分別為5~250 ng/mL和5 ng/mL。
1.2 化學發光適配體傳感器
化學發光(chemiluminiscence,CL)是物質在進行化學反應過程中伴隨的一種電磁輻射現象。化學發光分析法靈敏度高、檢測限寬、儀器相對簡單、操作較簡便且可實現全自動化,目前在生物學、臨床醫學等領域應用廣泛。在眾多化學發光體系中,過氧化物酶催化H2O2氧化魯米諾發光最為常見。因此,具備類過氧化物酶活性的AuNPs也被作為催化劑應用于基于魯米諾發光反應的化學發光檢測體系中。例如李素等[16]將多條生物素標記的cDNA片段2,通過適配體連接至修飾有cDNA片段1的磁珠表面,作為檢測探針。競爭反應后,利用磁回收的檢測探針上殘留的生物素標記的cDNA片段2,捕獲鏈霉親和素標記的AuNPs,并加入羥胺/Au3+使檢測探針上的AuNPs繼續生長以增強其化學發光能力,進而提高檢測靈敏度,該方法LOD低至1.58 pg/mL。
由于適配體傳感器中的競爭反應產物是DNA分子,核酸反應可用于競爭反應信號的放大以提高檢測靈敏度。HUN等[17]構建了一種利用DNA聚合酶和內切酶進行信號放大的OTA化學發光傳感器,該傳感器由2種核酸修飾的納米磁珠、cDNA和輔助DNA(與cDNA部分互補并含缺口內切酶Nb. Bbvcl的識別位點)組成。其中表面修飾適配體的磁珠可與cDNA雜交形成探針復合物。當OTA存在時,競爭反應產生的游離cDNA磁吸后殘留在上清中,并與輔助DNA部分序列雜交形成復合物。以cDNA為引物,Phi29 DNA聚合酶可催化聚合形成完整的輔助DNA互補鏈。該互補鏈可被Nb. Bbvcl切割成cDNA和一條短單鏈DNA(short single-stranded DNA,ssDNA)。其中,新生成的cDNA又可引發新的聚合及切割過程產生新的ssDNA。因此,經多次“聚合-切割”循環后,一個競爭反應產物(cDNA)即可引發形成大量報告分子(ssDNA),從而放大反應信號。在化學發光階段,該ssDNA可作為連接臂,通過DNA序列互補配對作用,連接另一種核酸修飾的納米磁珠和異魯米諾標記的SiO2納米粒子,形成三元雜交復合物。最后磁富集該復合物,并引入化學發光底物H2O2和催化劑Co2+反應產生化學發光信號。在該傳感器設計中,2種寡核苷酸修飾的納米磁珠分別起到了從反應體系中分離未反應的cDNA和捕獲濃縮ssDNA的作用,提高了傳感器設計的靈活性和檢測靈敏度。該適配體傳感器檢測OTA的線性范圍為1×10-3~50 ng/mL,LOD可達0.3 pg/mL。
1.3 熒光適配體傳感器
熒光是指熒光分子或熒光納米材料從激發態返回基態時發出的光。基于熒光信號的適配體傳感器具有較高的特異性、靈敏度,可分為標記和無標記2大類。近年來,基于磁性材料的OTA熒光適配體傳感器的相關研究見表1。
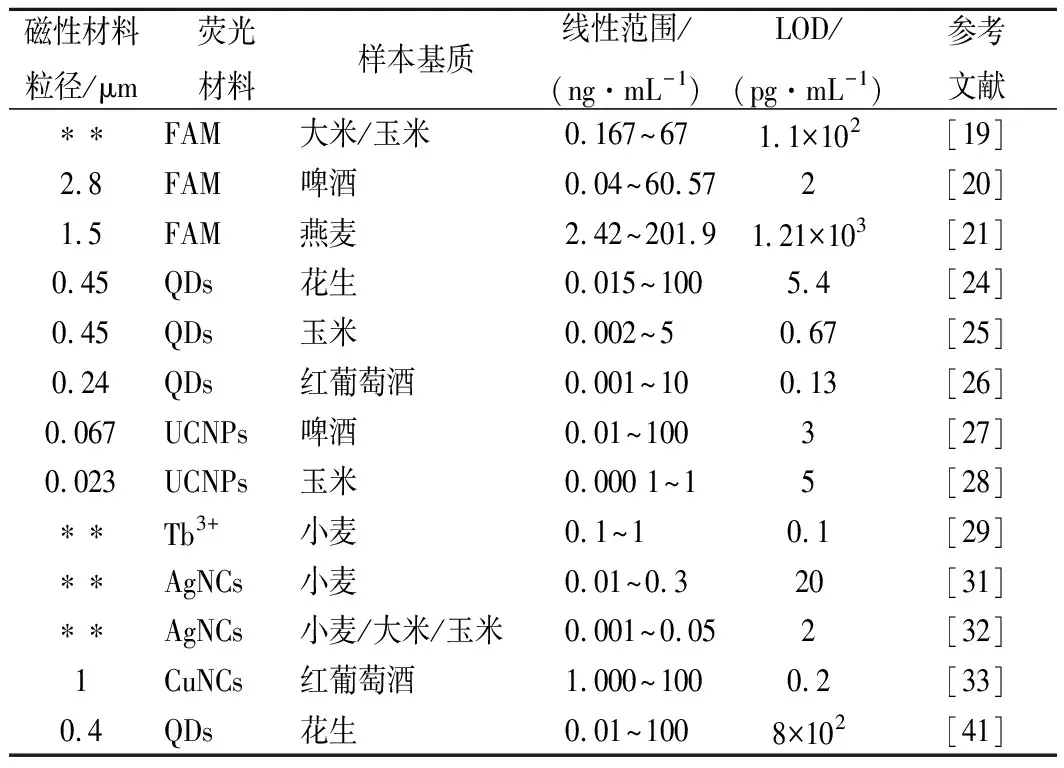
表1 基于磁性材料的熒光適配體傳感器在OTA檢測中的應用概況Table 1 Applications of fluorescent aptasensors based onmagnetic material in ochratoxin A detection
注:**,表示文獻中未見報道(下同)
多數熒光檢測采用標記檢測法,其常用標記物包括有機熒光分子、熒光團及熒光納米粒子等。熒光分子廉價易得,但熒光較弱,因此研究者將一些共軛熒光聚合物作為激發光能量傳遞體,引入以熒光分子為標記物的光學傳感器中,以提高其靈敏度[18]。聚(9,9-雙(6′-N,N,N-三甲基銨)己基)-亞芴基亞苯基二溴化物(poly(9,9-bis(6′-N,N,Ntrimethylammonium)hexyl)-fluorenylene phenylene dibromide,PFP)是一種典型的陽離子共軛熒光聚合物,具有特定的主鏈和大量重復的吸收單元,其可通過靜電相互作用,與帶負電的熒光分子標記的DNA形成穩定的聚電解質復合物,并將激發光能量通過熒光共振能量轉移作用傳遞給DNA上的熒光分子,使其熒光信號增強。LIU等[19]首次結合使用PFP、羧基熒光素(carboxyfluorescein,FAM)標記的cDNA以及適配體修飾的磁珠用于檢測OTA,其LOD為0.11 ng/mL,比未使用PFP時靈敏度提高6倍。為進一步提高檢測靈敏度,HAYAT等[20]用含有大量FAM分子的熒光微球標記適配體,并以其為信號探針建立了基于表面偶聯抗原的磁珠的OTA間接競爭檢測法。由于熒光微球熒光強度遠高于單個FAM分子,其LOD降至2 pg/mL。此外,WANG等[21]利用FAM的熒光信號可被轉化為消逝波信號的原理,開發了一種基于適體的消逝波全纖維(evanescent wave all-fiber,EWA)生物傳感器用于OTA的檢測。該傳感器具有優良的穩定性,可重復使用300次。
與有機熒光分子相比,熒光納米材料具有更高的熒光強度和良好的光穩定性。其中,量子點(quantum dots,QDs)具有激發光譜廣、發射光譜窄、量子產率高等特點,常被作為熒光標記物用于真菌毒素檢測[22]。而以含有大量QD的熒光微球為探針,可進一步增強探針熒光強度,進而提高檢測靈敏度[23]。WANG等[24]成功設計了一種以內部和表面帶有大量CdTe量子點的SiO2亞微米球為熒光探針,表面修飾適配體的金磁粒子為捕獲探針的OTA適配體傳感器。其中金磁粒子表面的金殼層使磁性材料可簡便、高效地與末端巰基化核酸鏈(適配體或cDNA)結合,并提高磁性材料的生物穩定性。檢測時,OTA可將cDNA修飾的熒光探針從金磁粒子表面競爭下來,通過測定磁回收后,對上清中游離探針的熒光強度進行OTA定量檢測,其LOD達5.4 pg/mL。QIAN等[25]則采用類似方法,以2種表面偶聯不同顏色QDs的硅球為探針,同時檢測小麥中的AFB1和OTA,其中OTA的LOD達0.67 pg/mL。在上述各檢測體系中,每發生一次競爭反應僅對應產生一個熒光探針的信號,信號強度仍然有限。因此,YAO等[26]借助滾環擴增技術(rolling cycle amplification,RCA),建立了一種單次競爭反應對應多個熒光探針信號的新型OTA檢測方法。該方法所用磁性檢測探針表面偶聯有含適配體的DNA片段,其序列與環狀模板部分互補。當體系中無OTA時,含適配體的DNA片段可作為引物在環狀模板上反復滾環擴增,形成含大量重復DNA片段的長鏈核酸。該擴增產物可與大量QDs標記的cDNA信號探針雜交,使磁珠產生強烈的熒光信號。而當OTA存在時,檢測探針上的環狀模板脫落,使磁珠表面的RCA反應因缺少模板無法進行,磁珠熒光信號顯著降低。該方法通過磁吸可地除去多余的信號探針并濃縮磁珠,進而提高信噪比和靈敏度,其LOD可達0.13 pg/mL。
上轉換納米粒子(upconversion nanoparticles,UCNPs)是一類含有鑭系離子的反-斯托克斯發光納米晶體,且其光學性質可通過改變粒子中鑭系元素的組成和比例進行調節。由于激發發射模式與大多數熒光物質相反,以UCNPs為檢測探針可克服基質中熒光物質的干擾,尤其適用于復雜生物樣品中的目標物分析。DAI等[27]和WU等[28]先后利用適配體和cDNA相互作用制備UCNPs-磁性納米粒子復合物作為檢測探針,分別用于檢測啤酒和玉米中的OTA。當OTA存在時,UCNPs從磁性復合物中競爭下來使其熒光減弱。因此,在磁回收去除游離UCNPs后,通過測定磁性復合物熒光強度變化,即可實現OTA定量檢測。研究結果表明,上述2種方法均有較寬的線性檢測范圍(0.01~100 ng/mL和0.000 1~1 ng/mL)。前者的實際樣品檢測限為5 pg/mL,后者的方法檢測限達0.1 pg/mL,且復合物探針在4 ℃保存30 d后檢測信號值僅損失1%。
與標記分析方法相比,無標記生物傳感器無需添加二級信號探針,更為簡便、快捷,且檢測成本較低。ZHANG等[29]在磁珠表面偶聯適配體并與cDNA形成雙鏈,利用單鏈DNA可顯著增強Tb3+熒光強度的原理,依據OTA將單鏈cDNA競爭下來前后溶液熒光強度的變化進行定量。該方法發光方式簡單,無需熒光標記過程,克服了標記材料的高標記成本和標記效應。此外,特定序列的DNA可結合金屬離子并反應形成具有不同性能的金屬納米材料,如熒光金屬納米簇等。由于競爭反應產物是DNA,DNA金屬化是一種十分適于無標記適配體傳感器的檢測信號產生方式[30]。如ZHANG等[31]利用Ag+可在還原劑的作用下,可以競爭反應產生的單鏈DNA為模板生長熒光銀納米簇(Ag nanoclusters,AgNCs)的原理設計了一種無標記OTA適配體傳感器。因金屬納米簇熒光穩定性良好、量子產率高,其LOD可達2 pg/mL。其后,該課題組[32]利用Zn2+可增強銀納米簇熒光強度的特性進一步提高了上述適配體傳感器的檢測靈敏度。將其應用于同時檢測OTA和AFB1,LOD分別為0.2和0.3 pg/mL。除銀納米簇外,DNA也可引發合成銅納米簇(Cu nanoclusters,CuNCs)作為熒光信號輸出單元。如HE等[33]在競爭反應產生的游離cDNA末端,利用末端轉移酶形成延伸的Poly(T)長鏈,并以其為模板引發生長多個銅納米簇產生熒光信號。
1.4 表面增強拉曼散射信號傳感器
目前利用表面增強拉曼散射(surface enhanced raman scattering,SERS)信號的磁性適配體OTA傳感器的檢測原理類似,均基于通過適配體和cDNA相互作用制備的磁珠-拉曼信號探針復合物[34-36]。當OTA存在時,信號探針從磁性復合物上脫落,通過測定磁回收后磁性復合物或上清的拉曼信號變化進行定量分析。由于拉曼散射很弱,拉曼分子應用于檢測時需要通過化學修飾或置于強電磁場中進行信號放大。貴金屬納米材料表面可形成高強局域電磁場(熱點),拉曼信號分子位于其中時,拉曼散射強度可提高106倍,是一種良好的拉曼信號放大方式[37]。ZHAO等[34]通過在表面配位連接有拉曼分子的銀納米粒子表面還原生長金殼層,制備得到拉曼分子位于銀核和金殼之間的核殼式拉曼探針(Ag@Au NPs)。由于拉曼信號同時被銀、金2種貴金屬放大,該探針具有很強的拉曼信號。將該探針應用于磁性適配體傳感器同時檢測OTA和AFB1,OTA的LOD為6 pg/mL。SHAO等[35]則采用類似方法制備了具有納米間隙的金核金銀殼型核殼式拉曼探針(Au@Au-Ag NPs),并將其與Fe3O4磁性納米材料聯合用于檢測OTA,其LOD為4 pg/mL。為進一步提高拉曼信號強度,SONG等[36]以金磁納米粒子作為磁性材料與Au@Ag型核殼式拉曼探針結合使用。當拉曼探針與金磁粒子形成復合物時,拉曼探針的信號可被金磁材料的金殼層進一步增強。通過測定競爭反應后磁性復合物的拉曼信號變化檢測OTA,其LOD降至0.48 pg/mL。
2 電化學傳感器
電化學傳感器主要通過測量因電極表面發生氧化還原反應引發的電勢或電流信號,實現對目標物的檢測。其具有操作簡便、體積小、信噪比高和檢測靈敏度高等優點。近年來基于磁性材料的OTA適配體電化學傳感器的相關研究見表2。

表2 基于磁性材料的電化學適配體傳感器在OTA檢測中的應用概況Table 2 Applications of electrochemical aptasensors basedon magnetic material in ochratoxin A detection
2.1 基于酶標抗原的適配體電化學傳感器
與傳統的以抗體為特異性識別元件的電化學傳感器原理類似,早期基于磁珠的OTA電化學適配體傳感器主要是利用酶標抗原和抗原競爭結合磁珠上的適配體,然后將磁珠磁吸至電極表面并依據酶促反應引起的電流信號實現對OTA的檢測。BARTHELMEBS等[38]和RHOUATI等[39]利用ALP酶標記的OTA;BONEL等[40]利用HRP酶標記的OTA與待測樣品中的OTA競爭結合磁珠表面的適配體,繼而通過微分脈沖伏安法檢測電信號進行OTA定量分析。上述傳感器中微納米磁珠的使用即可保證免疫競爭反應和酶促反應的高效進行,又可在磁場作用下,方便快速地實現磁性納米粒子與未結合的酶標抗原及樣品基質快速分離,并定位富集至電極表面,且在檢測后可通過撤除磁場將磁珠從電極表面移除,從而縮短分析時間、提高檢測靈敏度并實現電極的表面快速更新和重復使用。
2.2 基于納米粒子的電化學傳感器
近年來納米粒子被作為標記物廣泛應用于電化學傳感器的構建。例如量子點既可提供熒光信號也可產生電化學發光信號用于電化學檢測。WANG等[41]構建了一種以cDNA修飾的石墨烯量子點微球和適配體修飾的金磁納米粒子復合物為檢測探針,并基于電化學發光和熒光雙重檢測信號的OTA適配體傳感器。當競爭反應完成,磁分離后上清中游離的量子點微球可產生熒光信號,而磁回收的檢測探針經重懸后可磁吸至電極表面,產生電化學發光信號。其中,熒光檢測模式較快,其LOD為3 pg/mL;電化學發光模式則更為靈敏,其LOD為0.5 pg/mL。
此外,以納米粒子為金屬離子供體,利用納米粒子消解產生的離子引發電信號,已被多種基于磁珠的OTA電化學適配體傳感器作為信號產生方式。因納米粒子可消解產生大量金屬離子,此類傳感器具有很高的檢測靈敏度。WANG等[42]用表面荷載CdTe或PbS量子點的硅球分別標記OTA和伏馬菌素(fumonisin B1,FB1)適配體,然后將其與cDNA修飾的磁珠結合,制備2種毒素的檢測探針。當OTA或FB1存在時,競爭釋放的硅球經磁分離后殘留在上清中并被HNO3酸解產生Cd2+或Pb2+。然后利用鉍修飾的玻碳電極,以方波溶出伏安法(square-wave stripping voltammetry,SWSV)測定2種金屬離子產生的電信號,從而實現對OTA和FB1的同時檢測,其LOD分別為5和20 pg/mL。由于此類傳感器的靈敏度與檢測探針中納米粒子的含量相關,HAO等[43]利用表面荷載大量CdTe量子點的石墨烯/Au納米復合材料制備檢測探針,采用類似的模式和方法實現了對OTA的超靈敏檢測,其LOD為0.07 pg/mL。此外,RCA技術也可用于提高此類傳感器的檢測靈敏度。TONG等[44]設計的檢測探針由寡核苷酸鏈修飾的磁珠、適配體和輔助DNA片段組成。由于輔助DNA片段同時含有與磁珠表面寡核苷酸鏈以及適配體互補的DNA序列,三者可雜交形成復合物。當OTA存在時,輔助DNA因適配體脫落形成的單鏈區可與磁珠表面寡核苷酸鏈的單鏈部分進一步結合,形成環狀輔助DNA-磁珠復合物。在DNA聚合酶作用下,磁珠表面的寡核苷酸鏈可以環狀輔助DNA為RCA模板,擴增形成含大量重復片段的長鏈核酸。此時加入與重復片段互補配對的且標記有CdS量子點的DNA探針,可使磁珠表面攜帶大量量子點,從而提高Cd2+電信號強度和檢測靈敏度。
2.3 基于電活性分子的適配體電化學傳感器
電活性分子,如亞甲基藍,是一類常用的DNA電化學傳感器雜交指示劑。與光學適配體傳感器一樣,基于核酸酶的核酸反應也可用于DNA電化學傳感器的信號放大以提高檢測靈敏度。SHI等[45]構建了一種基于雙鏈核酸外切酶III(exonuclease III,Exo III)的OTA適配體電化學傳感器,該傳感器檢測探針由納米磁珠通過其表面適配體和mDNA雜交而成。當OTA存在時,mDNA被競爭下來并殘留在磁吸上清中。用表面修飾cDNA的金電極檢測磁吸上清時,與mDNA部分互補的cDNA與mDNA雜交形成雙鏈啟動Exo III切割cDNA并釋放mDNA。游離mDNA又可與電極表面其他cDNA雜交,并繼續引發Exo III切割cDNA。經多次循環后,磁吸上清中微量的競爭反應產物mDNA即可導致金電極上大量cDNA被切割,從而放大反應信號。最后,電極上未被切割的cDNA可與修飾大量報告DNA的金納米粒子雜交并吸附甲基藍產生電化學信號。利用該傳感器檢測OTA,其LOD為5 pg/mL。
3 核酸定量型適配體傳感器
由于痕量核酸的定量技術已非常成熟,而適配體傳感器的競爭產物是DNA,MODH等[46]開發了一種基于實時熒光定量PCR技術的OTA檢測方法。該方法利用cDNA將適配體結合至納米磁珠表面,競爭反應后通過qPCR技術對磁吸后上清中的游離適配體進行擴增和定量。該OTA傳感器具有極寬線性檢測范圍,可達0.039~1 000 ng/mL,其LOD為9 pg/mL。雖然此類基于核酸定量的檢測方法具有檢測范圍寬、靈敏度高等優點,但其需要昂貴的定量PCR儀、耗時長且檢測成本較高。
4 其他
與上述需要大型儀器的檢測方法不同,基于廉價的商業化便攜式血糖儀的生物傳感器價格低廉,可被廣泛用于非葡萄糖待測物的低成本現場快速檢測[47]。如GU等[48]將蔗糖酶標記的cDNA通過OTA適配體與磁珠結合制備檢測探針。當OTA存在時,競爭釋放的蔗糖酶-cDNA復合物可催化蔗糖轉化為葡萄糖。此時利用血糖儀測定體系中葡萄糖的濃度,即可實現非葡萄糖目標物的間接定量檢測。使用該方法檢測紅酒中的OTA,其LOD為3.66 ng/mL。QIU等[49]則在上述檢測探針中的適配體和cDNA末端分別修飾疊氮和炔基官能團,以利用點擊化學反應減少cDNA的非特異性釋放,從而降低背景信號、提高檢測靈敏度,其LOD降至72 pg/mL。該類檢測方法簡便、快捷且成本低,適用于食品的大規模監測篩查。
5 展望
綜上所述,基于磁性納米材料的OTA適配體傳感器多以通過適配體/cDNA結合的納米磁珠-信號分子復合物作為檢測探針。由于納米磁珠表面積大且可分散在檢測體系中,競爭反應可高效進行。同時,通過磁分離可快速分離/富集競爭反應產物或原始檢測探針用于信號檢測。此外,在電化學傳感器中納米磁珠可方便快速地富集至電極表面,提供并增強檢測信號,而通過移除磁珠又可快速更新電極表面,實現電極的重復使用。由于以適配體作為生物識別元件,已報道的穩定性分析表明,OTA適配體傳感器具有良好的穩定性和可重復利用性。在提高檢測靈敏度方面,隨著納米材料的快速發展,各類新型納米光學材料、納米模擬酶和納米組裝體被用于增強基于磁珠的適配體傳感器的光/電信號輸出。此外,基于適配體傳感器中競爭反應產物是DNA分子這一特點,成熟的DNA擴增技術,如RCA技術和PCR技術,以及基于各類核酸酶的新型核酸信號放大策略,均可引入適配體傳感器的信號生成或傳導體系中,以放大檢測信號,提高檢測靈敏度。
雖然已有的基于磁性納米材料的OTA適配體傳感器有較高的檢測靈敏度,但其仍有可改進之處。例如,現有方法大多需要大型、昂貴的光學、電化學或核酸擴增定量檢測設備且設備操作復雜,不適于基層企業或監測部門的大規模現場快速檢測。與大型檢測儀器相比,智能手機檢測平臺具有檢測設備體積小、便于攜帶、成本低且可實現實時遠程檢測等優點,已與多種光學或電化學檢測方法聯用,用于待測物的分析。而將檢測過程集成在微流芯片中進行的微流控檢測平臺也具有成本低、使用和攜帶方便及樣品用量小等優點。上述檢測平臺與免疫層析試紙條檢測一樣,均適于大規模現場即時檢測,應將其更多的應用于基于磁性納米材料的真菌毒素適配體傳感器。此外,磁性材料不僅可用于磁分離,亦可作為磁信號探針使用。由于穿透性強,且樣品基質一般無磁信號不會形成背景干擾,磁信號在復雜食品樣品分析中具有良好的應用前景,且十分適于作為基于磁性納米材料的真菌毒素適配體傳感器的檢測信號。

