腺苷酸基琥珀酸活化AMPK抑制肝細胞內脂質蓄積的作用機制
王洋,姜允嘉,成鐘,趙曉宏,郭鵬,蔡大勇,謝勇
·論著·
腺苷酸基琥珀酸活化AMPK抑制肝細胞內脂質蓄積的作用機制
王洋,姜允嘉,成鐘,趙曉宏,郭鵬,蔡大勇,謝勇
100193 北京,中國醫學科學院北京協和醫學院藥用植物研究所中草藥物質基礎與資源利用教育部重點實驗室
揭示腺苷酸基琥珀酸(鹽)(S-AMP)的生物學新功能。
以 AMP 活化蛋白激酶(AMPK)的天然底物 AMP 為參照,應用表面等離子共振研究 S-AMP 和 AMPK 的相互作用特征。分別構建脂質蓄積和糖蓄積的 HepG2 細胞模型,通過特定濃度的 S-AMP 和對照藥物作用后測定 HepG2 細胞內甘油三酯濃度和葡萄糖濃度,研究 S-AMP 和 AMP 降脂和降糖的作用規律。用 Western blot 研究 S-AMP 作用 HepG2 細胞后提高 AMPK 磷酸化水平及其下游糖、脂質代謝通路中關鍵蛋白質的表達量變化規律,提出 S-AMP 的作用機制。最后利用飲食誘導的糖尿病和高血脂癥金黃地鼠模型研究 S-AMP 促進糖脂代謝的藥效。
S-AMP 和 AMPK γ 亞基形成復合體后提高 AMPK 磷酸化水平,提高 AMPK 下游的甘油三酯脂肪酶和乙酰輔酶 A 羧化酶的表達量和磷酸化。促進葡萄糖分解的 PFKFB3(6-phosphofructo-2-kinase/fructose-2,6-biphosphatase 3 enzyme)蛋白和轉化為糖原的蛋白質糖原合成酶的表達量沒有明顯變化,S-AMP 顯示出的降脂活性高于同等濃度的洛伐他汀。
發現了 S-AMP 降低脂質蓄積的作用機制。
腺苷酸基琥珀酸(鹽); AMPK; 脂質蓄積; 作用機制
腺苷酸基琥珀酸(鹽)[adenylosuccinic acid (adenylosuccinate),S-AMP]是嘌呤從頭合成()通路中合成 AMP 的前體化合物[1]。S-AMP 具有促進胰島素分泌,使2 型糖尿病患者胰島 β 細胞恢復正常的功能[2],可能具有治療糖尿病、高血脂癥等代謝綜合征的應用前景。迄今為止對 S-AMP 的作用靶標和機制缺乏全面的了解。從分子結構來看,S-AMP 是 AMP 的結構類似物,可能具有活化 AMP 活化蛋白激酶(AMPK)實現提高糖代謝、脂代謝等功能[3]。前期研究中我們利用酶促動力學方法實現了 S-AMP 的小試合成[4],保證了開展 S-AMP 作用機制研究的原料需求。此論文報道 S-AMP 靶向 AMPK 結合改善糖脂代謝的活性和作用機制研究結果,為開展 S-AMP 的成藥性研究提供參考。
1 材料與方法
1.1 材料
1.1.1 細胞來源與實驗動物 HepG2 細胞來自國家實驗細胞資源共享服務平臺(中國醫學科學院基礎醫學研究所內),表達人源 AMPK γ1 亞基(NCBI Reference Sequence: NP_002724.1)的質粒 pET-21a-AMPK γ1 亞基[5]由本實驗室保存,大腸桿菌表達感受態細胞購自全式金生物技術公司。實驗動物金黃地鼠,6 周齡,雌性,空白組、模型組和給藥組各 6 只,來自北京維通利華實驗動物技術有限公司(合格證號:SCXK Jing 2012-0001),在中國醫學科學院藥用植物研究所 SPR 動物房內按照實驗動物飼養規程飼養和進行藥物灌胃。
1.1.2 主要試劑 DMEM 細胞培養基購自美國HyClone 公司;FBS 購自美國 Gibco Life Technologies 公司;用于 Western blot 分析蛋白質表達量的抗原:ATGL、AMPK 亞基、Thr172 磷酸化的AMPK 亞基、ACC(1,2)、Ser221 磷酸化的 ACC1、Ser79 磷酸化的 ACC2、GS、PFKFB3、β-actin 的 I 抗均購自美國 Cell-Signal Technology 公司;山羊 II 抗(抗鼠和抗兔)購自英國 Abcam公司上海分部;油酸、羅格列酮、洛伐他汀等試劑購自德國 Sigma-Aldrich 公司上海分部;S-AMP 按照本課題組已報道方法[3]制備,油紅 O 染色試劑盒和葡萄糖濃度測定試劑盒購自上海BioSino 生物技術科學有限公司。
1.1.3 主要儀器 Pioneer 型表面等離子共振儀為美國FortéBio 公司產品;Tecan M1000 多功能連續波長分光光度計為瑞士 Tecan 公司產品;Leica DM4000B 熒光顯微鏡為德國Leica 公司產品;AU480 型全自動生化儀為美國 Beckman Coulter 公司產品。
1.2 方法
1.2.1 表面等離子共振實驗 人源 AMPK γ1 亞基按照已經報道的蛋白質表達和純化方法制備[5]。室溫下利用表面等離子共振(SPR)儀實施 S-AMP 和 AMPK γ1 亞基相互作用分析。掛載蛋白質的 COOH5 芯片安裝在指定位置后泵入 NHS/EDC [N-hydroxysuccinimide/1-ethyl-3-(3-dimethylperpyl)-carboiimide]溶液以活化芯片,用 1 mol/L 的乙醇胺封閉芯片后再用 10 mmol/L 醋酸鈉緩沖溶液(pH 4.5)稀釋 AMPK γ1 亞基至50 μg/ml,溶液用進樣裝置輸送到芯片上,儀器顯示 Response Units(RU)數值大于 2000 表明芯片表面成功掛載蛋白質,可以用于分子相互作用分析。用 PBS-T 溶液(pH 7.4,含 10 mmol/L Na2HPO4,1.8 mmol/L KH2PO4,2.7 mmol/L KCl,140 mmol/L NaCl,0.05% Tween 20)平衡化芯片。配制含有 S-AMP 濃度分別為 2.5、5、10、20 μmol/L 的 PBS-T 溶液,每種溶液分別用加樣裝置輸送至芯片表面測定 RU 信號的經時變化量。S-AMP 和 AMPK γ1 亞基相互作用形成復合體的動力學常數a、d和D用表面等離子共振儀器自帶程序進行計算。AMP 是 AMPK 的天然底物,為了比較 S-AMP-AMPK γ1 亞基復合體和 AMP-AMPK γ1 亞基復合體的穩定性,AMP 和 AMPK 的相互作用也用同樣的方法進行分析。
1.2.2 S-AMP 降低脂質蓄積的體外實驗 HepG2 細胞用含有 1% 青霉素-鏈霉素和 10% FBS 的 DMEM 培養基培養。將細胞置于含有 5% CO2的 37 ℃細胞培養基中,當細胞融合度至約 80% 時,用 0.25% 的胰蛋白酶消化并傳代培養。取對數生長期內的健康細胞接種于 96 孔細胞培養皿中,密度約為 1 × 104個/孔,設定 DMEM 培養基培養的 HepG2 細胞作為對照組,含有 100 μmol/L 油酸的 DMEM 培養基培養的 HepG2 作為模型組,含有10 μmol/L 洛伐他汀和 100 μmol/L 油酸的 DMEM培養基培養的 HepG2 為陽性對照,含有 100 μmol/L油酸和 5、10、20 和 40 μmol/L 的 AMP 或 S-AMP 的 DMEM 培養基培養的細胞為給藥組,在相同的環境中培養各組細胞 24 h 后去除培養液,用 37 ℃預熱過的 PBS 清洗細胞后去除 PBS 溶液,每孔加入 100 μl 的 4% 的多聚甲醛,于 4 ℃固定細胞 30 min 后去除多聚甲醛,PBS 洗滌 3 次后,每孔加入 20 μl 油紅 O 溶液,室溫下細胞染色15 min 后去除油紅 O 溶液,用 PBS 洗滌染色的細胞 3 次;每孔加入 100 μl 的 DMSO,搖動 10 min,用多功能連續波長分光光度計測定358。每種培養條件都開展 3 組平行實驗。
為進一步觀察 S-AMP 等抑制 HepG2 細胞內脂質蓄積的活性,對10 μmol/L 洛伐他汀、S-AMP、AMP 處理 24 h 的 HepG2 細胞用多聚甲醛固定后,每組細胞添加 100 μl 的 Bodipy 493/50(2 μmol/L)溶液,在 37 ℃避光環境中恒溫 15 min 后去除溶液,用 PBS 沖洗每個孔 3 次,用倒置熒光顯微鏡觀察細胞并拍照。
1.2.3 S-AMP 降糖的體外實驗 HepG2 細胞按照密度約為1 × 104個/孔接種于 96 孔細胞培養皿中。設定無酚紅低糖 DMEM 培養基培養細胞為空白組,含有 5 mmol/L 葡萄糖無酚紅低糖 DMEM 培養基培養細胞為模型組,含有 10 μmol/L 羅格列酮和 5 mmol/L 葡萄糖的無酚紅低糖 DMEM 培養基培養的細胞作為陽性對照,分別含有 5 mmol/L 葡萄糖和 20、40、50 和 60 μmol/L 的 AMP 或 S-AMP 的無酚紅低糖 DMEM 培養基培養細胞為給藥組,同樣的條件下培養 24 h,將 96 孔板中的培養基移入 0.75 ml EP 管中。使用全自動生化儀,利用葡萄糖氧化酶法,測定其中的葡萄糖含量。每種培養條件都開展 3 組平行實驗。
1.2.4 Western blot 分析 根據測定 S-AMP 和 AMP 的藥效,用 6 孔培養皿培養 HepG2細胞,對照組、模型組和陽性對照組按照上述條件設定,降脂功能研究給藥組 S-AMP 和AMP 的濃度均為 10 μmol/L。降糖功能研究給藥組 S-AMP 和 AMP 的濃度均為 20 μmol/L。培養 24 h 后,去除培養基,加入 RIPA 細胞裂解液,冰上提取總蛋白。用 BCA 蛋白質濃度定量試劑盒測定蛋白質濃度后,用 SDS-PAGE 上樣緩沖液和各蛋白質樣品按比例混合后,于 100 ℃恒溫 10 min 讓蛋白質變性。Western blot 分析特定蛋白的表達量按照文獻[5]所述方法實施,各種抗體的稀釋比都為 1:1000。
1.2.5 S-AMP 降脂和降糖活性的體內實驗 金黃地鼠飼養按照文獻[5]所述流程開展,對高營養飲食誘導的高血糖和高血脂癥地鼠按 300 mg/kg 的劑量灌胃給藥,以 200 mg/kg 二甲雙胍為陽性對照。間隔 24 h 給藥 1 次,以正常飼養地鼠為對照組,高脂飼料喂養地鼠為模型組,灌胃給藥 18 d 后取地鼠血液用全自動生化儀測定血糖、總膽固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL-C)以及低密度脂蛋白(LDL-C)的含量。各組地鼠的肝組織用 4% 甲醛固定后,包埋到石蠟中,用組織切片機制成肝組織切片。各個組織切片用油紅 O 染色后再用蘇木素-伊紅復染,在顯微鏡下觀察并拍照。
1.3 統計學處理
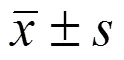
2 結果
2.1 SPR 分析結果
SPR 通過實時定量分析分子間相互作用以確定二者是否形成復合物。掛載于 COOH5 傳感器芯片上的蛋白質和其他分子形成復合體,測定復合體形成和解離過程中產生相應的 RU 變化,計算出分子間相互作用的動力學常數,RU 的變化量受溶液中小分子化合物濃度和結合強度影響[6]。S-AMP 和 AMP 的分子結構如圖 1A 所示,S-AMP 相當于 AMP 的次黃嘌呤環上的氨基上結合了一個丁二酸基團的衍生物。嘌呤從頭合成通路中 S-AMP 被腺苷酸基琥珀酸裂解酶分解成延胡索酸和 AMP[1]。用 SPR 法測定的 AMPK γ1 亞基分別與S-AMP 和 AMP 相互作用的 RU 實時變化如圖 1B 所示,由此計算的分子間相互作用的動力學常數如表 1 所示。這些結果證實 S-AMP 可以和AMPK γ1亞基相互作用形成復合體,這個復合體的穩定性低于 AMP-AMPK γ1 復合體。AMPK 分子是由被稱為 α、β 和 γ 亞基的 3 條肽鏈形成的復合體,人源 AMPK 的 γ 亞基存在 γ1、γ2 和 γ3 三種異構體,三種異構體和 AMP 結合部位的結構相同[7],因此 S-AMP 都可能和 AMPK 的 γ 亞基形成復合體。
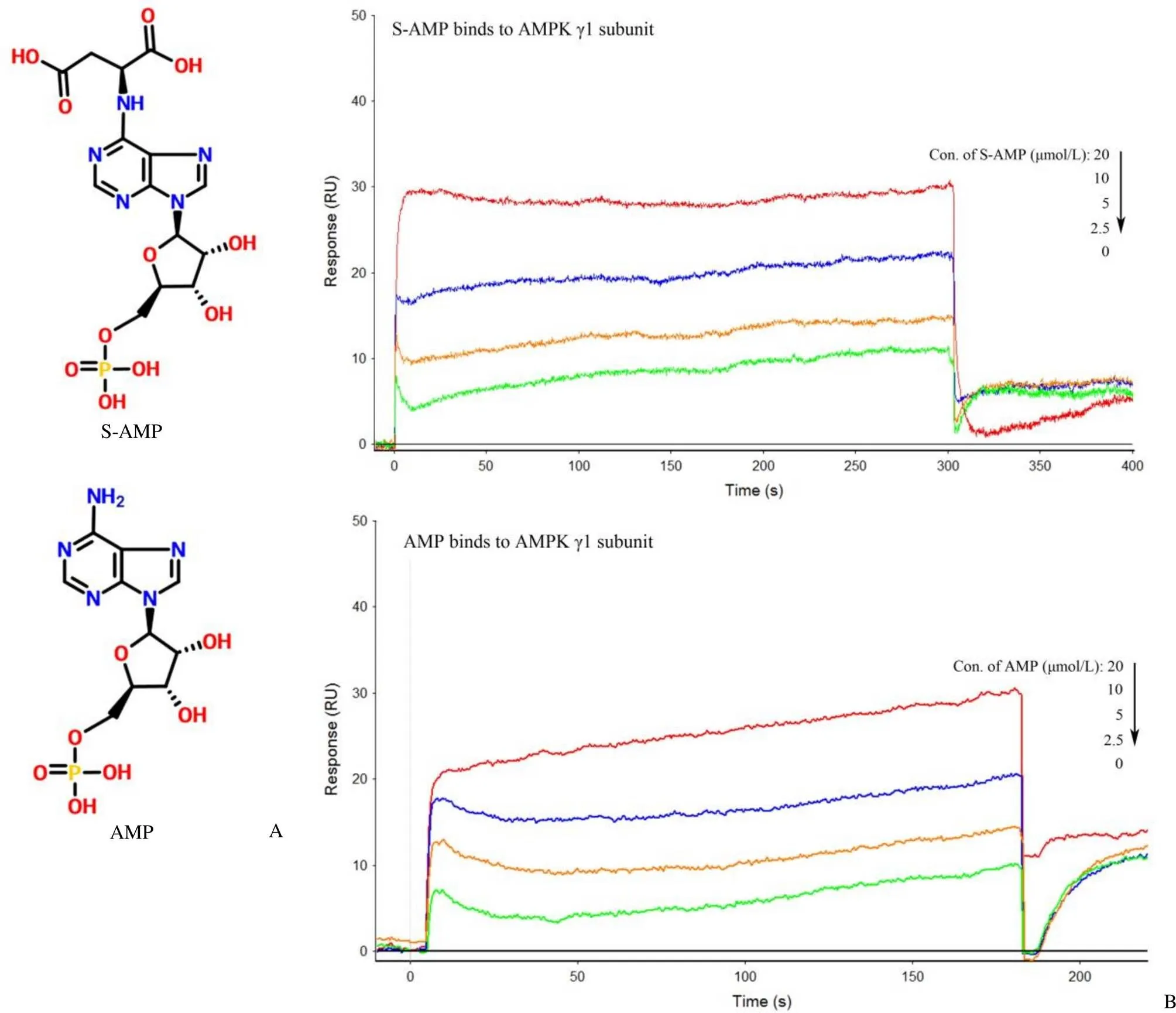
圖 1 S-AMP 和 AMP 分別和 AMPK γ1 亞基相互作用結果(A:S-AMP 和 AMP 的分子結構;B:S-AMP 和 AMP 分別和 AMPK γ1 亞基相互作用的表面等離子共振信號圖)
Figure 1 Results of S-AMP and AMP interact with AMPK γ1 subunit respectively (A: Structures of S-AMP and AMP; B: SPR signal of S-AMP and AMP interact with AMPK γ1 subunit respectively)
2.2 S-AMP 對油酸處理的 HepG2 細胞的降脂作用
油紅O 染色后的 HepG2 細胞用特定體積的 DMSO 萃取,得到的 DMSO 溶液的358大小和細胞內脂質濃度呈正比關系,可以表示細胞內脂質濃度的大小。從測定的結果來看,含有 100 μmol/L油酸的細胞培養基培養 24 h 后 HepG2 細胞存在脂質蓄積,10 μmol/L 的 S-AMP 和 AMP 都顯示出比同等濃度的洛伐他汀更強的降脂活性,AMP 的降脂活性在 20 μmol/L 達到最大,而 S-AMP 則顯示出較為緩慢的量效關系(圖 2A)。
為了探討 S-AMP 降脂作用的機制,我們用 Western blot 法分析了各個培養環境中HepG2 細胞內 AMPK 磷酸化和下游脂代謝信號通路中蛋白的磷酸化及表達量變化。人體AMPK 的 γ 亞基結合 AMP 或 AMP 的結構類似物后 α 亞基上 Thr172 被磷酸化,Thr172 的磷酸化水平可表征 AMPK 的活性[3, 5]。SPR 分析證明 S-AMP 可以通過靶向結合AMPK 實現活化 AMPK 下游的代謝通路。如圖 2B 所示,和模型組比較,洛伐他汀、S-AMP和 AMP 處理的細胞內 AMPKα 亞基上 Thr172 的磷酸化水平顯著增加,上調下游脂代謝通路中 ATGL 和 ACC 的表達量。ACC 包含 ACC1 和 ACC2 兩個亞型[8],它們的磷酸化水平,尤其是 ACC2 的磷酸化水平顯著提高。ACC1 定位于胞質中,催化長鏈脂肪酸的合成,ACC2 定位于線粒體膜上,催化脂肪酸的氧化。我們觀察到的 ACC 磷酸化主要是 ACC2 的磷酸化。ACC 的活性受磷酸化調控,當 ACC2 磷酸化后促進脂肪酸氧化[9-10],這個是促進細胞內脂質代謝的原因之一。此外,ATGL 的表達量顯著加速脂肪分解[11],也是促進細胞內脂質代謝的原因。
上述 S-AMP 降脂活性和 Western blot 研究結果以及 SPR 分析的結果顯示細胞內 S-AMP 可以直接和 AMPK 形成復合體后導致 α 亞基上 Thr172 磷酸化水平升高,通過上調 ATGL 的表達量促進細胞內的脂肪分解,上調 ACC2 表達和提高其磷酸化水平以促進脂肪酸氧化。細胞內的一部分AMP 是S-AMP 被 ADSL 分解的產物[1],AMP 是 AMPK的天然激動劑,兩者形成復合體后也能以 S-AMP相同的作用機制促進脂質代謝。熒光顯微鏡觀察結果顯示同樣濃度(10 μmol/L)的洛伐他汀、AMP 和 S-AMP 都明顯抑制 HepG2 細胞內脂質蓄積,三者之中,S-AMP 抑制 HepG2 細胞內脂質蓄積的活性最高,S-AMP 和 AMP 的活性明顯高于洛伐他汀(圖 2C)。

表 1 表面等離子共振分析測定的AMPK γ1 亞基和小分子化合物相互作用的動力學常數
2.3 S-AMP 的降糖活性及其作用機制
AMP 和 S-AMP 促進糖代謝的結果如圖 3A 所示,相對于陽性對照藥羅格列酮,AMP 和 S-AMP 的降糖活性顯著低下。培養基中 AMP 的濃度從 20、40、50、60 μmol/L 依次增加時沒有觀察到藥物量效關系,即使培養基中 AMP 的濃度為 60 μmol/L 都不能觀察到顯著的降糖效果,而 S-AMP 的濃度分別為 20、40、50、60 μmol/L 時,能夠觀察到藥物量效關系,S-AMP 濃度為60 μmol/L 時的降糖效果和 10 μmol/L 羅格列酮的降糖效果相當。
培養基內分別添加 10 μmol/L 羅格列酮、20 μmol/L 的 AMP 和 S-AMP 對 AMPK 磷酸化和 GS、PFKFB3 的表達量的 Western blot 分析結果如圖 3B 所示,相對于模型組,對照藥羅格列酮能顯著提高 AMPK 的磷酸化和 GS 的表達量,但是 PFKFB3 的表達量沒有顯著提高,因此羅格列酮主要通過促進細胞內糖元合成來降低葡萄糖的含量。在這種培養條件下 AMP 和 S-AMP 都不能提高 AMPKα 亞基上 Thr172 的磷酸化水平,因而下游的 PFKFB3 和 GS 的表達量無明顯的上調,證明 AMP 和 S-AMP 都不能通過誘導 GS 的表達量上調促進糖元合成促進葡萄糖代謝。這些結果表明 S-AMP 和 AMP 在現有的細胞培養體系中,不能活化 AMPK-PFKFB3 通路及其 AMPK-GS 通路。高濃度的 S-AMP 顯示出比同等濃度 AMP稍高的降糖活性的原因是它能促進胰島素分泌[2],AMP 沒有顯示出降糖活性的量效關系,因此可以認為 AMP 沒有促進胰島素分泌的功能。
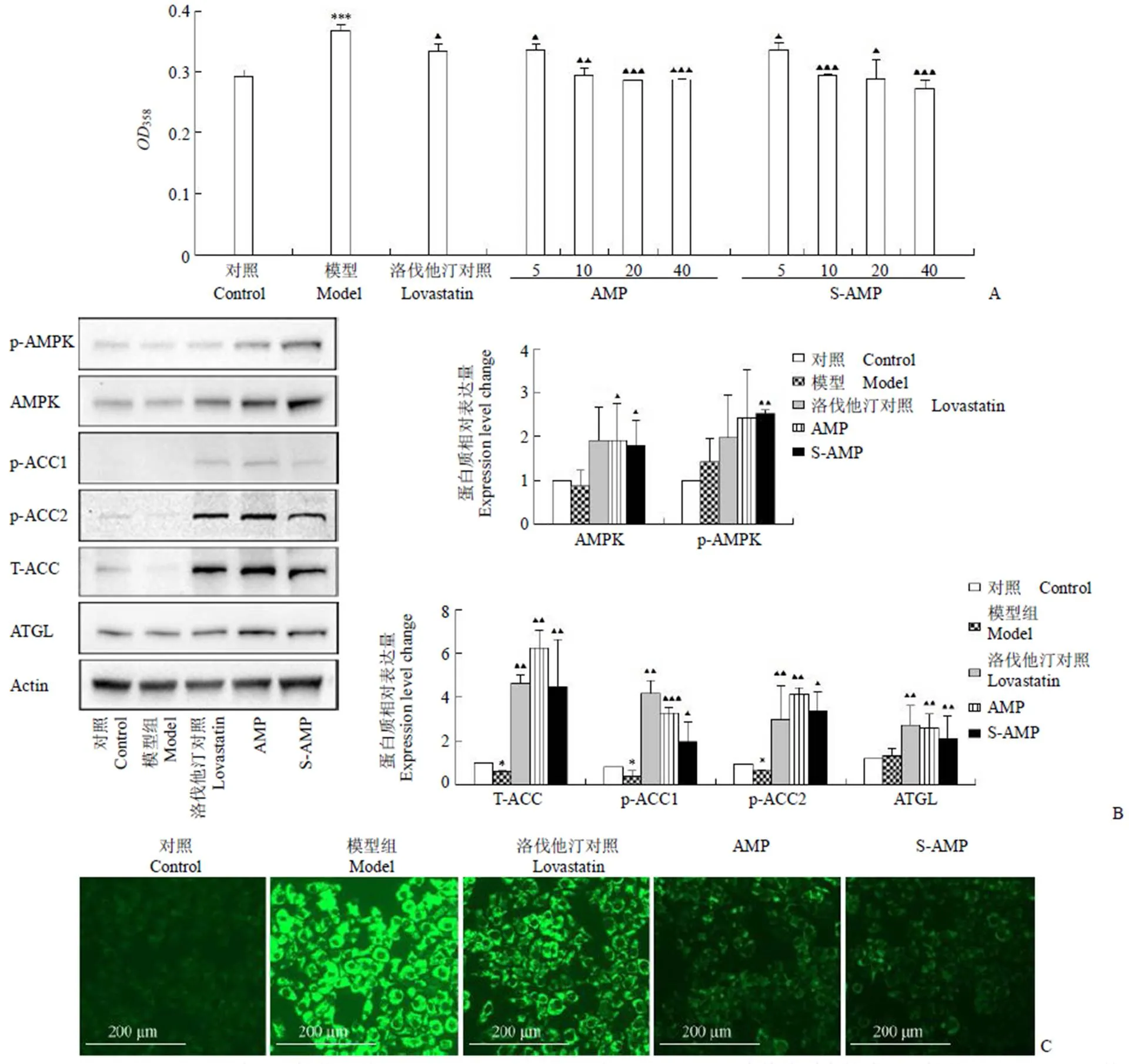
圖 2 S-AMP 和 AMP 降脂活性的比較(A:S-AMP 和 AMP 在 HepG2 細胞培養體系中的降脂活性統計,以OD358的數值大小表征脂質濃度;B:Western blot 檢測脂代謝途徑中部分蛋白的表達。條形圖描述了至少三組平行試驗數據的平均值;C:熒光顯微鏡顯示的分別用 10 μmol/L 洛伐他汀、S-AMP、AMP 處理 24 h 后細胞內脂質蓄積的結果;與正常組比較*P < 0.05,***P < 0.001;與模型組比較P < 0.05,P < 0.01,P < 0.001)

2.4 S-AMP 改善高營養誘導金黃地鼠的脂質代謝活性
在整個飼養期間,正常飼養的金黃地鼠(對照組)血糖濃度約為 4.8 mmol/L,高營養飼糧飼養的金黃地鼠(模型)血糖濃度為 16 ~ 18 mmol/L。這些結果表明,過量的營養攝入可以誘發金黃地鼠的2 型糖尿病。在使用二甲雙胍和 S-AMP 治療 18 d 后,金黃地鼠的血糖濃度分別變為 5 mmol/L 和11 mmol/L 左右。Tukey's 試驗或 Newman-Kueuls 試驗結果證明,S-AMP 對血糖無明顯降低作用。但二甲雙胍可使金黃地鼠血糖恢復到正常水平,說明本研究建立的動物療效評價模型是成功的(圖 4A)。模型組大鼠在高營養飲食 30 d 后血清 TG、TC 明顯升高,HDL-C 的濃度無明顯變化。300 mg/kg 劑量的 S-AMP 處理 18 d 后,金黃地鼠血液中 TG 濃度明顯降低脂質含量,TC、HDL-C 和 LDL-C 的濃度無明顯變化(圖 4B),肝組織中 S-AMP 能明顯減少脂質蓄積(圖 4C),這些結果證明 S-AMP 靶向 AMPK 產生可高效促進脂質分解。體內和體外實驗顯示 S-AMP 的降脂活性明顯高于降糖活性。

圖 3 S-AMP 和 AMP 降糖活性的比較(A:AMP 或 S-AMP 在 HepG2 細胞培養體系中的降糖活性統計;B:Western blot 檢測糖代謝途徑中部分蛋白的表達。條形圖描述了至少 3 組平行試驗數據的平均值。與正常組比較*P < 0.05,**P < 0.01,***P < 0.001;與模型組比較P < 0.05,P < 0.01,P < 0.001)

2.5 S-AMP 促進脂質代謝的作用機制
從觀測到 S-AMP 具有促進脂質代謝的量效關系以及 AMP 作為天然 AMPK 激動劑也具有同樣作用通路來看,它們都是 S-AMP 促進脂質分解信號通路的組成部分。因為 S-AMP 和 AMP 都是細胞內獨立存在的化合物[1-2],腺苷酸基琥珀酸裂解酶(ADSL)將 S-AMP 分解為 AMP 和延胡素酸是通路的一個反應,也是嘌呤代謝通路不可缺少的環節。酶促動力學研究顯示人體內 ADSL 的max為(11.9 ± 0.1)μmol/(L·min·mg)(25 ℃)[12],外源 S-AMP 進入到細胞內,ADSL 將 S-AMP 分解為 AMP 不可避免,此部分 AMP 發揮降脂功能。此外,1 mg 總蛋白的細胞提取液中,未用葡萄糖處理的腎臟細胞內 S-AMP 和 AMP 的含量分別為 0.17 和20 nmol/L,葡萄糖處理 2 h 后腎臟細胞內 S-AMP 和 AMP 的含量分別為 0.56 和18 nmol/L[2],細胞內 S-AMP 和 AMP 的濃度變化不僅和外源性補充有關,還受細胞代謝水平控制,目前還沒有合適的實驗方法能精準測定細胞內外源性 S-AMP 的濃度和被 ADSL 轉化為AMP 的比例。綜上所述,S-AMP 促進脂質分解的作用機制通路如圖 5 所示,外源性 S-AMP 一部分被代謝成 AMP,一部分依然為 S-AMP,兩者分別和 AMPK 的 γ 亞基形成復合體提高 α 亞基上 Thr172 磷酸化水平,導致 AMPK 下游的脂肪酸氧化和脂肪分解通路被活化,可以認為 SPR 觀測到的 S-AMP 靶向結合 AMPK 是細胞內脂質代謝通路中存在的客觀事實。
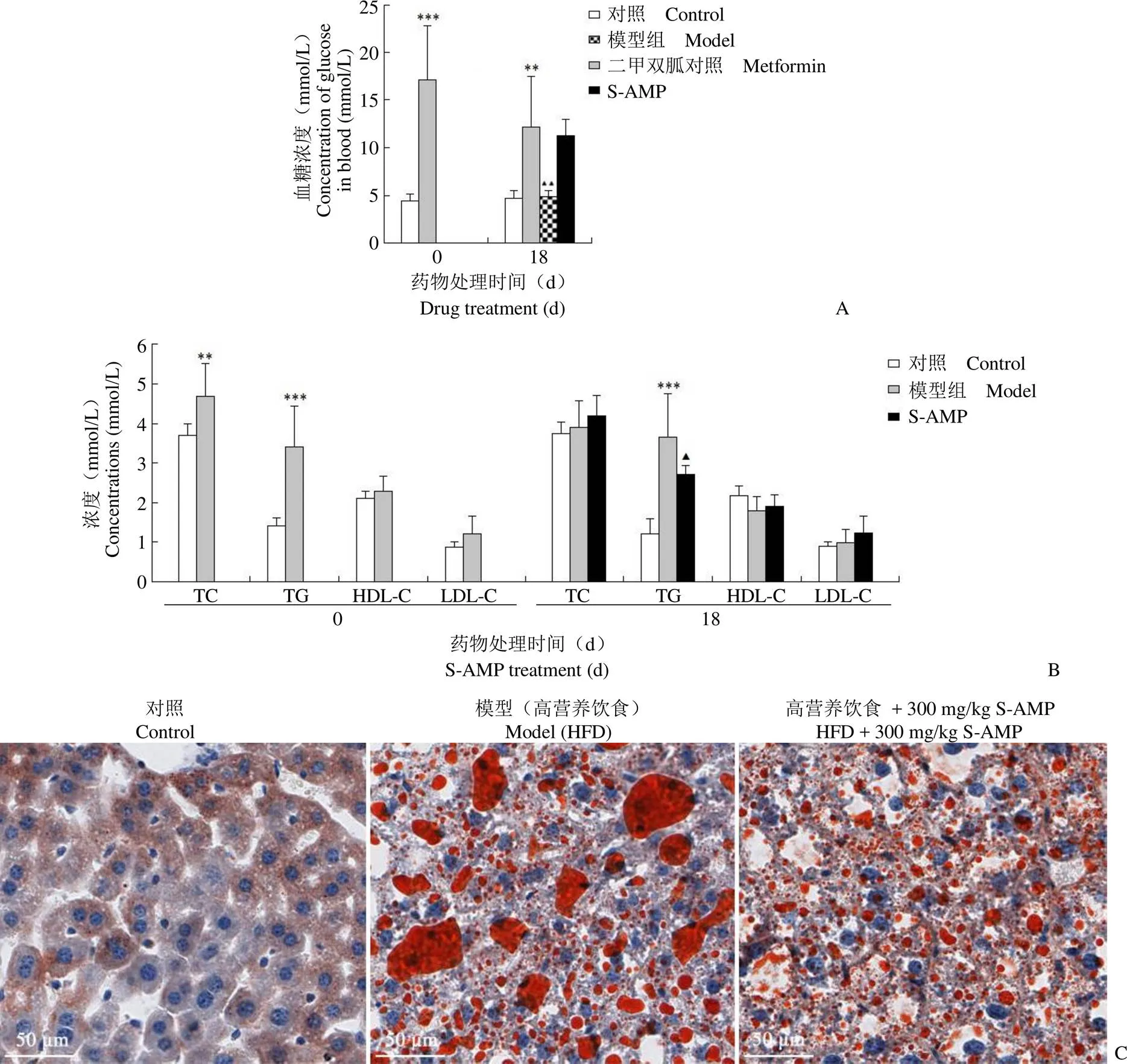
圖 4 S-AMP 改善降糖和降脂代謝活性的體內實驗結果[A:測定的各組金黃地鼠血糖濃度的統計結果(,mmol/L)。給藥前與對照組比較,模型組的空腹血糖明顯升高,差異有顯著性意義。分組給藥 18 d 后,200 mg/kg 的二甲雙胍能明顯降低地鼠血糖含量,而 300 mg/kg 的 S-AMP 對地鼠血糖無明顯作用(與對照組比較,**P < 0.05,***P < 0.001;與模型組比較,P < 0.01);B:給藥前和給藥 18 d 后各組金黃地鼠血液內 TC、TG、HDL-C 和 LDL-C 濃度的統計結果(,mmol/L),高營養飲食能顯著提升小鼠血清內 TC 和 TG 含量;300 mg/kg 劑量給藥 18 d 后,S-AMP 能明顯降低血清中 TG 含量(與對照組比較,**P < 0.05,***P < 0.001;與模型組比較, P < 0.05);C:各組金黃地鼠肝組織切片用油紅 O 染色,蘇木素-伊紅復染后具有代表性的組織顯微鏡圖像]
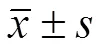

圖 5 S-AMP 促進脂質代謝的作用機制(黑色和灰色箭頭分別表示 S-AMP 和 AMP 的信號通路)
Figure 5 Lipid metabolism signal pathways induced by S-AMP and AMP are shown using the black and gray arrows respectively
3 討論
AMP 等嘌呤核苷酸是重要的細胞成分,調節細胞的重要功能,包括細胞代謝、細胞增殖和細胞死亡,以及 DNA 和 RNA 的合成[13]。人體內嘌呤合成的主要場所是肝臟,嘌呤的生物合成主要涉及兩個分離的途徑,即從頭合成途徑和回收途徑,通過嘌呤核苷酸的合成和降解來維持各個組分的平衡。嘌呤代謝功能障礙在免疫學、血液學和神經肌肉疾病方面與多種疾病相關[14-16],這些疾病與細胞中嘌呤核苷酸和體液中堿基的異常水平有關。嘌呤和嘧啶代謝的先天缺陷在十多種不同的疾病中都有表現。我們發現,補充 S-AMP 和 AMP 能降低高血脂癥金黃地鼠的血脂和抑制肝臟內脂肪蓄積,意味著肝細胞內 S-AMP 和 AMP 低下可能是導致脂肪代謝紊亂的原因,S-AMP 和 AMP 有望作為治療高血脂癥、非酒精性脂肪肝等脂質代謝紊亂疾病的藥物開展研究。
此外,盡管 S-AMP 對高糖培養基培養的 HepG2 細胞,不能活化 AMPK 以促進糖分解或糖原合成,依然有降糖活性,其原因應該是 S-AMP 提高了胰島素分泌[2]。體內實驗觀察到 S-AMP 無明顯的降糖活性,原因可能是 S-AMP 的劑量不足以使金黃地鼠的胰島素分泌量達到促進糖代謝的要求,也可能是高飲食誘導金黃地鼠產生的胰島素抵抗導致的,需要開展進一步研究才能闡明其科學本質。
[1] Bubi? A, Mrnjavac N, Stuparevi? I, et al. In the quest for new targets for pathogen eradication: the adenylosuccinate synthetase from the bacterium Helicobacter pylori. J Enzyme Inhib Med Chem, 2018, 33(1):1405-1414.
[2] Gooding JR, Jensen MV, Dai X, et al. Adenylosuccinate is an insulin secretagogue derived from glucose-induced purine metabolism. Cell Rep, 2015, 13(1):157-167.
[3] Garcia D, Shaw RJ. AMPK: mechanisms of cellular energy sensing and restoration of metabolic balance. Mol Cell, 2017, 66(6):789-800.
[4] Wang N, Jiang YJ, Wang Y, et al. Large-scale synthesis of adenylosuccinate using a high thermal stability adenylosuccinate synthetase as a bio-catalys. Chin Med Biotechnol, 2019, 14(2):108- 114. (in Chinese)
王楠, 姜允嘉, 王洋, 等. 以高熱穩定性的腺苷酸基琥珀酸合成酶為催化劑大量合成腺苷酸基琥珀酸(鹽). 中國醫藥生物技術, 2019, 14(2):108-114.
[5] Wu C, Guo Y, Su Y, et al. Cordycepin activates AMP-activated protein kinase (AMPK) via interaction with the γ1 subunit. J Cell Mol Med, 2014, 18(2):293-304.
[6] L?f?s S. Biacore systems: leading the revolution in label-free interaction analysis. Biointerphases, 2008, 3(3):FD2-FD3.
[7] Corton JM, Gillespie JG, Hawley SA, et al. 5-aminoimidazole-4- carboxamide ribonucleoside. A specific method for activating AMP-activated protein kinase in intact cells? Eur J Biochem, 1995, 229(2):558-565.
[8] Brownsey RW, Boone AN, Elliott JE, et al. Regulation of acetyl-CoA carboxylase. Biochem Soc Trans, 2006, 34(Pt 2):223-227.
[9] Karami KJ, Coppola J, Krishnamurthy K, et al. Effect of food deprivation and hormones of glucose homeostasis on the acetyl CoA carboxylase activity in mouse brain: a potential role of acc in the regulation of energy balance. Nutr Metab (Lond), 2006, 3:15.
[10] Bianco AC, Maia AL, da Silva WS, et al. Adaptive activation of thyroid hormone and energy expenditure. Biosci Rep, 2005, 25(3-4): 191-208.
[11] Cerk IK, Wechselberger L, Oberer M. Adipose triglyceride lipase regulation: an overview. Curr Protein Pept Sci, 2018, 19(2):221-233.
[12] Ariyananda Lde Z, Lee P, Antonopoulos C, et al. Biochemical and biophysical analysis of five disease-associated human adenylosuccinate lyase mutants. Biochemistry, 2009, 48(23):5291-5302.
[13] Pedley AM, Benkovic SJ. A new view into the regulation of purine metabolism: the purinosome. Trends Biochem Sci, 2017, 42(2):141-154.
[14] Yin J, Ren W, Huang X, et al. Potential mechanisms connecting purine metabolism and cancer therapy. Front Immunol, 2018, 9:1697.
[15] Nyhan WL. Disorders of purine and pyrimidine metabolism. Mol Genet Metab, 2005, 86(1-2):25-33.
[16] Edwards NL, Fox IH. Disorders associated with purine and pyrimidine metabolism. Spec Top Endocrinol Metab, 1984, 6:95-140.
Adenylosuccinate, a metabolite in purine salvage pathway, binds to AMP-activated protein kinase (AMPK) γ subunit and enhances the metabolic efficiency of lipid
WANG Yang, JIANG Yun-jia, CHENG Zhong, ZHAO Xiao-hong, GUO Peng, CAI Da-yong, XIE Yong
Department of Medicinal Plant Development, Chinese Academy of Medical Sciences & Peking Union Medical College, Key Laboratory of Bioactive Substances and Resources Utilization of Chinese Herbal Medicine, Ministry of Education, Beijing 100193, China
To discovery of novel biological functions of adenosylsuccinate (adenosylsuccinatic acid; referred to as S-AMP).
Surface plasmonic resonance (SPR) was used to explore the direct interaction between S-AMP and AMP activated protein kinase (AMPK) by using the natural substrate AMP of AMP-activated protein kinase (AMPK) as the reference. HepG2 cell models of lipid and glucose accumulation were constructed respectively to evaluate the concentration of triglyceride and glucose in HepG2 cells after the addition of S-AMP at different concentrations, the lipid-lowering and glucose-lowering effects of S-AMP were studied. Western blot was used to study the phosphorylation of AMPK and the expression of downstream signaling pathways of glucose and lipid metabolism by the addition of S-AMP to HepG2 cells, and the mechanism of S-AMP on the attenuation of lipid metabolism was proposed. Finally, the effect of S-AMP was verified in mice with diet-induced diabetes and hyperlipidemia.
It was confirmed for the first time that the formation of complex of S-AMP and AMPK increased the phosphorylation level of AMPK, enhanced the expression of ATGL and ACC2 in the fatty acid synthesis downstream of AMPK pathway, and simultaneously increased the phosphorylation of ACC2. It also increased the intracellular decomposition of triglyceride to generate fatty acids and decreased the lipid accumulation in cells. In addition, theandexperiments showed that S-AMP had no significant hypoglycemic activity.
The mechanism of S-AMP reducing lipid accumulation was confirmed.
Adenylosuccinic acid (Adenylosuccinate); AMPK; Lipid accumulation; Mechanism
XIE Yong, Email: yxie@implad.ac.cn
國家自然科學基金(81473114)
謝勇,Email:yxie@implad.ac.cn
10.3969/j.issn.1673-713X.2020.03.004
2020-04-03

