布魯氏菌抗原檢測試劑用國家參考品的研制
張園園,張平平,王春娥,趙愛華,楊瑞馥,魏東
·論著·
布魯氏菌抗原檢測試劑用國家參考品的研制
張園園*,張平平*,王春娥,趙愛華,楊瑞馥,魏東
102629 北京,中國食品藥品檢定研究院衛生部生物技術檢定方法及其標準化重點實驗室(張園園、王春娥、趙愛華、魏東);100071 北京,軍事科學院軍事醫學研究院微生物流行病研究所病原微生物生物安全國家重點實驗室(張平平、楊瑞馥)
研制布魯氏菌抗原檢測試劑評價用國家參考品。
將 3 株布魯氏菌標準株和 10 株陰性參考菌株在各自適宜的培養基和溫度下進行培養,收集新鮮培養物并滅活,采用比濁法制備陽性和陰性參考品菌液;分光光度法制備最低檢出量和重復性參考品菌液。對參考品進行均勻性檢測和穩定性試驗,組織 4 個實驗室對布魯氏菌抗原檢測試劑用參考品進行協作標定。
建立了由 3 株布魯氏菌為陽性參考品、10 株陰性菌為陰性參考品、最低檢出量參考品及重復性參考品組成的布魯氏菌抗原檢測試劑評價用國家參考品。該參考品具有較好的均勻性及穩定性。協作標定結果為陽性參考品符合率均為 100%,陰性參考品符合率均為 90%,最低檢出量參考品的檢出限為 1 × 107~ 1 × 106個/ml 之間,重復性參考品均符合規定。
研制的布魯氏菌抗原檢測試劑評價用國家參考品可用于布魯氏菌抗原檢測試劑的質量控制。
布魯氏菌;抗原; 國家參考品; 均勻性; 穩定性
布魯氏菌病(簡稱布病)是由布魯氏菌(簡稱布氏菌)引起的一類人畜共患疾病,是《中華人民共和國傳染病防治法》中規定報告的乙類傳染病。布病在世界范圍內廣泛流行,是全球特別是發展中國家面臨的主要公共衛生問題[1-2]。布病可通過口腔黏膜、鼻腔、眼結膜、生殖道,甚至未損傷的皮膚感染[3]。布病不僅影響畜牧業和相關產業的發展,造成社會經濟損失,還對人類的健康構成重大威脅[4],美國疾病預防控制中心將布氏菌列為潛在的生物恐怖戰劑[5-6]。我國是布病的歷史疫區,近年來布病流行較為嚴重,且發病率逐年遞增,2018 年發病率為 2.73/10 萬,已經連續十年年發病人數超過 3 萬。
布魯氏菌抗原檢測是疾病診斷中重要的實驗室檢查項目,而我國尚無布魯氏菌抗原檢測試劑評價用國家參考品。為此,我們研制了布魯氏菌抗原檢測試劑評價用參考品,其對于布魯氏菌抗原檢測試劑的注冊管理、指導我國該類試劑的健康有序發展,均具有重要意義。現將布魯氏菌抗原檢測試劑評價用參考品研制情況報道如下。
1 材料與方法
1.1 主要材料
1.1.1 菌種 牛種布氏菌 104M 株(CMCC55010)、豬種布氏菌 S2 株(CMCC55007)、羊種布氏菌 M5 株(CMCC55009)、大腸埃希菌(CMCC44113)、小腸結腸炎耶爾森菌 O:3 血清型(CMCC52203)、小腸結腸炎耶爾森菌 O:8 血清型(CMCC52211)、小腸結腸炎耶爾森菌 O:9 血清型(CMCC52212)、土拉熱弗朗西絲菌 LVS 株、鼠疫耶爾森菌(CMCC52006)、炭疽芽孢桿菌(CMCC63001)、霍亂弧菌(CMCC18001)、傷寒沙門菌(CMCC50071)、志賀氏菌(CMCC51105)均由中國醫學細菌保藏管理中心(CMCC)提供。
1.1.2 試劑 胰酪大豆胨瓊脂培養基(TSA)、腦心浸液瓊脂培養基均購自美國 BD 公司;中國細菌濁度標準國家標準品及皮上劃痕用鼠疫、布氏、炭疽活疫苗菌濃度測定通用參考品均由我院制備;布魯氏菌上轉發光免疫層析檢測試劑(批號:20190601)由北京熱景生物技術股份有限公司生產;布魯氏菌抗原檢測試劑(膠體金法)(批號:20190101801)由北京金豪制藥股份有限公司生產。
1.1.3 實驗儀器 生物安全柜購自美國 Nuaire 公司;MIR-153 型恒溫培養箱購自日本三洋公司;UV-2401 型紫外可見分光光度計購自日本島津公司。
1.2 方法
1.2.1 不同滅活方式及保存溫度對布氏菌抗原性影響 將新鮮制備的布氏菌液(CMCC55010)分別經 70 ℃滅活 1 h 和 1% 甲醛溶液滅活,每種滅活菌液分別稀釋成1.0 × 108個/ml,分別放置 4 ℃、–20 ℃及–80 ℃保存,1 個月后將菌液稀釋成 1.0 × 107個/ml 進行抗原性檢測。
1.2.2 菌液的制備
1.2.2.1 陽性參考品菌液制備 將布氏菌株接種 TSA 平皿,35 ~ 37 ℃培養 44 ~ 48 h 后收獲。將收獲菌液用中國細菌濁度標準國家標準品測定濃度后稀釋成 1.0 × 1010個/ml,70 ℃滅活1 h。經滅活驗證合格后分裝,–80 ℃保存。
1.2.2.2 陰性參考品菌液制備 將菌株接種于各自適宜生長的培養基上,并于最適溫度下進行培養后收獲。將收獲菌液用中國細菌濁度標準國家標準品測定濃度后稀釋成 1.0 × 1010個/ml,經適當方式滅活。經滅活驗證合格后分裝,–80 ℃保存。
1.2.2.3 最低檢出量和重復性參考品菌液的制備 將布氏菌株(CMCC55010)接種 TSA 平皿,35 ~ 37 ℃培養 44 ~ 48 h 后收獲。將收獲菌液經分光光度法測定濃度后稀釋成 1.0 × 1010個/ml,70 ℃滅活 1 h。經滅活驗證合格后分裝,–80 ℃保存。
1.2.3 參考品的制備
1.2.3.1 陽性參考品的制備 將 3 株布氏菌原始菌液以生理鹽水稀釋至 1.0 × 108個/ml 濃度,定量分裝,0.5 ml/管,–20 ℃以下保存,分別編號為 P1 ~ P3。
1.2.3.2 陰性參考品的制備 將 10 株陰性菌的原始菌液以生理鹽水稀釋至 1.0 × 108個/ml濃度,定量分裝,0.5 ml/管,–20 ℃以下保存,分別編號為 N1 ~ N10。
1.2.3.3 最低檢出量及重復性參考品的制備 將布氏菌原始菌液(CMCC55010)用凍干保護劑稀釋至 1.0 × 108個/ml,定量分裝,0.5 ml/支,凍干后封口,–20 ℃以下保存。分裝精確度不高于 1%,水分不高于 3.0%。
1.2.4 均勻性檢測 隨機抽取凍干的最低檢出量參考品 10 支,分別加入 0.5 ml 生理鹽水復溶,稀釋到 2.5 × 107個/ml。用布魯氏菌上轉發光免疫層析檢測試劑進行檢測,每支樣品重復測定 3 次,將測定值進行單因子方差分析。
1.2.5 參考品的穩定性研究
1.2.5.1 凍融穩定性試驗 從–20 ℃冰箱中取出最低檢出量參考品、陽性參考品及陰性參考品中小腸結腸炎耶爾森菌 O:9 血清型菌株,于室溫放置約 8 h,再放回 –20 ℃冰箱。按此步驟重復 1 次或 3 次。將所有樣品再次從–20 ℃冰箱中取出,平衡至室溫后,用檢測試劑進行檢測。
1.2.5.2 加速穩定性試驗 從–20 ℃冰箱中取出最低檢出量參考品、陽性參考品及陰性參考品中小腸結腸炎耶爾森菌 O:9 血清型菌株,分別于 4、25、37 ℃各放置 2 套,3 d 和5 d 后各取出 1 套,用檢測試劑進行檢測。
1.2.5.3 長期穩定性試驗 對最低檢出量參考品進行了長期穩定性研究,現已完成 1 個月、3 個月、6 個月檢測。
1.2.6 參考品協作標定 2 家生產單位使用各自生產的試劑進行檢測,中國食品藥品檢定研究院檢驗人員(未參與樣品編盲)使用布魯氏菌抗原檢測試劑(膠體金法)進行檢測,軍事科學院軍事醫學研究院微生物流行病研究所使用布魯氏菌上轉發光免疫層析檢測試劑進行檢測。4 個實驗室編號分別為 1、2、3、4。
1.3 統計學處理
采用 SPSS 統計軟件,將測定結果進行單因素方差統計分析,結果以< 0.05 表示差異有統計學意義。
2 結果
2.1 不同滅活方式及保存溫度對布氏菌抗原性影響
抗原性檢測結果見表 1。熱滅活方式對抗原性影響明顯小于甲醛滅活,4 ℃保存樣品抗原性不穩定,–20 ℃及–80 ℃保存抗原穩定性較好且未見明顯差異。最終確定布氏菌滅活方式為 70 ℃ 1 h,保存條件為–20 ℃。
2.2 均勻性檢測
結果見表 2。臨界值0.05(9,20)= 2.42,計算的值為 2.229,該值<臨界值,= 0.065 > 0.05,這表明在 0.05 顯著性水平時,樣品中的抗原量是均勻的。
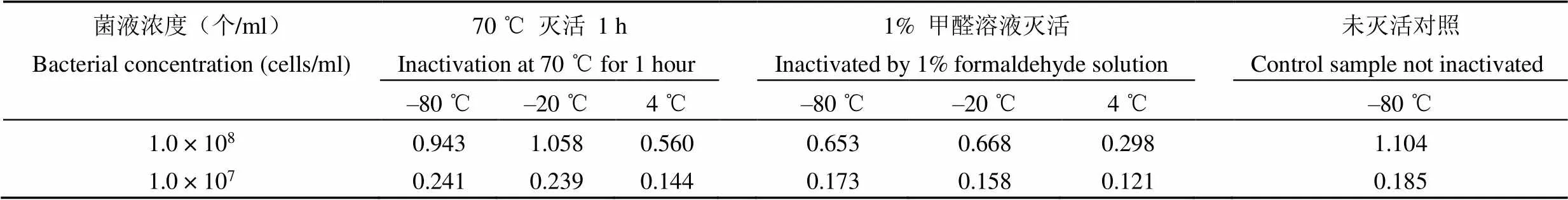
表 1 不同滅活方式及保存溫度對布氏菌體抗原性影響(T/C)
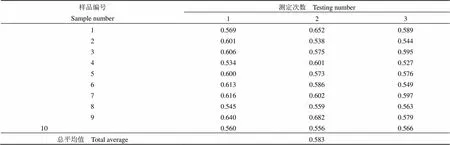
表 2 均勻性檢查結果(T/C)
2.3 穩定性試驗
2.3.1 凍融穩定性試驗 凍融 1 次及 3 次后最低檢出量參考品的檢出限度與未凍融對照無差別,結果見表 3。3 株陽性參考品及陰性參考品中小腸結腸炎耶爾森菌 O:9 血清型菌株凍融 1 次及 3 次后仍均為陽性。研究結果表明最低檢出量參考品、陽性參考品及陰性參考品中小腸結腸炎耶爾森菌 O:9 血清型菌株具有較好的凍融穩定性。
2.3.2 加速穩定性試驗 所有加速試驗后最低檢出量參考品的檢出限度與–20 ℃保存的對照樣品無差別,結果見表 4。3 株陽性參考品及陰性參考品中小腸結腸炎耶爾森菌 O:9血清型菌株加速試驗后仍均為陽性。研究結果表明最低檢出量參考品、陽性參考品及陰性參考品中小腸結腸炎耶爾森菌 O:9 血清型菌株具有較好的加速穩定性。
2.3.3 長期穩定性試驗 觀察期內最低檢出量參考品的最低檢出限度未見變化,結果見表 5,表明最低檢出量參考品具有較好的長期穩定性。
2.4 協作標定
4 個實驗室的陽性參考品符合率均為 100%。4 個實驗室的陰性參考品符合率均為 90%,小腸結腸炎耶爾森菌 O:9 血清型菌株均出現了假陽性。最低檢出量參考品方面,1 家企業試劑的最低檢出量為 1 × 106個/ml,另 1 家試劑的最低檢出量為 1 × 107個/ml。重復性參考品方面,兩家企業試劑均檢測為陽性,且平行檢測 10 次,顯色度均一或 CV 值小于 10%,結果見表 6。

表 3 最低檢出量參考品凍融試驗結果
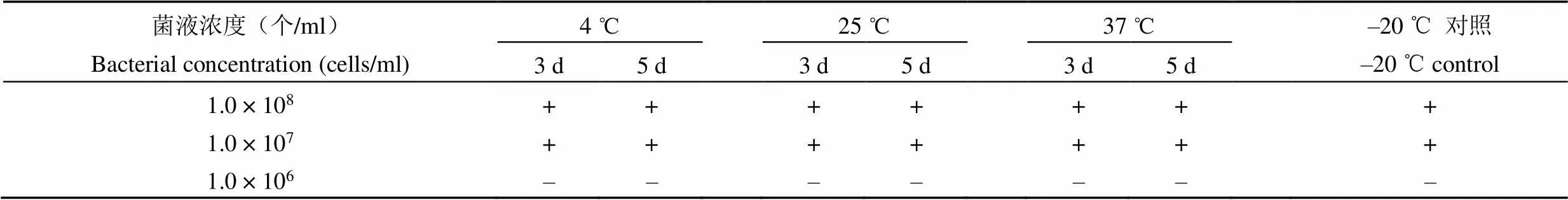
表 4 最低檢出量參考品加速試驗結果
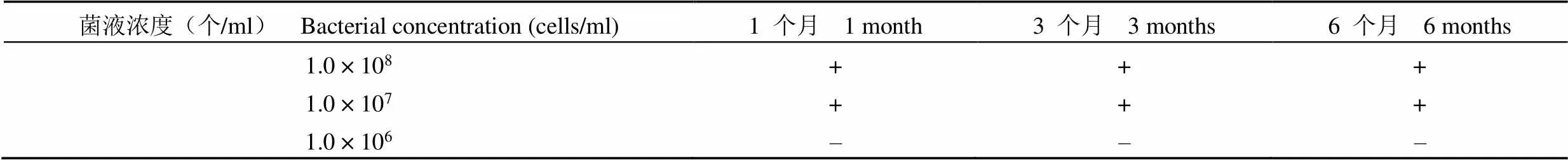
表 5 長期定性試驗結果
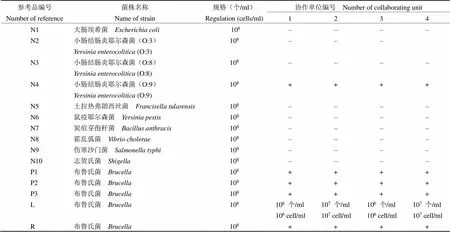
表 6 協作標定結果
3 討論
在世界范圍內,引起人類布病的主要是羊種、牛種和豬種布氏菌[7-8]。所以,本套參考品中的陽性參考品分別設置了羊種、牛種和豬種布氏菌。陰性參考品包括與布氏菌感染癥狀相近的菌株,也包括了文獻報道與布氏菌有交叉的菌株,如霍亂弧菌、土拉熱弗朗西絲菌、小腸結腸炎耶爾森菌 O:9 血清型菌株等[9-10]。
在陰性參考品的篩選過程中發現小腸結腸炎耶爾森菌 O:9 血清型菌株與布氏菌存在明顯的抗原交叉。為進一步驗證該結果的可靠性,我們將小腸結腸炎耶爾森菌 O:9 血清型菌株進行了單克隆化,隨機選取 3 個單克隆菌落,進行了抗原性檢測及 16S rDNA 測序,結果表明單克隆菌落為小腸結腸炎耶爾森菌,3 個單克隆菌落經布魯氏菌抗原檢測試劑檢測均為陽性。該結果表明現有檢測方法尚無法鑒別布氏菌與小腸結腸炎耶爾森菌 O:9 血清型菌株。
最低檢出量參考品是評價產品檢測能力的最重要工具[11]。對于診斷產品,最低檢出量參考品是評價產品檢測下限的依據,其穩定性對于檢測試劑的質量控制非常重要。為保證參考品的穩定性,我們對最低檢出量參考品進行了凍干處理,研究結果表明該參考品具有較好的穩定性。
本研究所建立的布魯氏菌抗原檢測試劑評價用參考品,可用于布魯氏菌抗原檢測試劑的質量評價,對于提高產品質量具有重要意義。
[1] Pappas G, Papadimitriou P, Akritidis N, et al. The new global map of human brucellosis. Lancet Infect Dis, 2006, 6(2):91-99.
[2] Qiu YH, Wang J, He SY. Research progress on the epidemic, detection and prevention of human brucellosis. Chin J Clin Pathologist, 2015, 7(3):187-188, 172. (in Chinese)
邱宇鶴, 王錦, 何淑云. 人布魯氏菌病的流行、檢測與防治研究進展. 實用檢驗醫師雜志, 2015, 7(3):187-188, 172.
[3] Franco MP, Mulder M, Gilman RH, et al. Human brucellosis. Lancet Infect Dis, 2007, 7(12):75-76.
[4] Olsen SC, Palmer MV. Advancement of knowledge of Brucellosis over the past 50 years. Vet Pathol, 2014, 51(6):1076-1089.
[5] Greenfield RA, Drevets DA, Machado LJ, et al. Bacterial pathogens as biological weapons and agents of bioterrorism. Am J Med Sci, 2002, 323(6):299-315.
[6] Doganay GD, Doganay M. Brucella as a potential agent of bioterrorism. Recent Pat Antiinfect Drug Discov, 2013, 8(1):27-33.
[7] Liu ZG, Wang M, Liu RH, et a1. Species identification and epidemiological characteristics analysis of Brucella in Ulanqab, Inner Mongolia, China. Chin J Zoonoses, 2016, 32(7):618-622, 631. (in Chinese)
劉志國, 王妙, 劉日宏, 等. 內蒙古烏蘭察布布氏菌分離株種型鑒定及流行病學特征分析. 中國人獸共患病學報, 2016, 32(7):618- 622, 631.
[8] Schurig GG, Sriranganathan N, Corbel MJ. Brucellosis vaccines: past, present and future. Vet Microbiol, 2002, 90(1-4):479-496.
[9] Sun YX, Zhang FL. Cross-response observation and differential diagnosis of suspected cases of Brucellosis and Yersinia enterocolitica Serotype 0:9. Chin J Endemiology, 2001, 20(6):477. (in Chinese)
孫養信, 張福利. 布魯氏桿菌與0:9型耶爾森氏菌血清學交叉反應觀察及其可疑病例的鑒別診斷. 中國地方病學雜志, 2001, 20(6):477.
[10] Xiao YC, Qiu HY, Wang B, et a1. Screen and its amplification of specific mAb of Yersinia enterocolitica serotype O:9. Chin J Vector Bio Control, 2005, 16(6):459-461. (in Chinese)
肖玉春, 邱海燕, 王冰, 等. 小腸結腸炎耶爾森菌O:9血清型特異性單克隆抗體篩選及其應用. 中國媒介生物學及控制雜志, 2005, 16(6):459-461.
[11] Dong JC. Establishment of internal reference products for in vitro diagnostic reagents for qualitative testing. J Radioimmunolgy, 2011, 24(1):50-51. (in Chinese)
董勁春. 定性檢測用體外診斷試劑的企業內部參考品的設置. 放射免疫學雜志, 2011, 24(1):50-51.
Preparation of national reference for detection reagentantigen
ZHANG Yuan-yuan, ZHANG Ping-ping, WANG Chun-e, ZHAO Ai-hua, YANG Rui-fu, WEI Dong
Key Laboratory of the Ministry of Health for Research on Quality and Standardization of Biotech Products, National Institute for Food and Drug Control, Beijing 102629, China (ZHANG Yuan-yuan, WANG Chun-e, ZHAO Ai-hua, WEI Dong); State Key Laboratory of Pathogens and Biosecurity, Institute of Microbiology and Epidemiology, Academy of Military Medical Sciences, Academy of Military Sciences, Beijing 100071, China (ZHANG Ping-ping, YANG Rui-fu)
To prepare national reference for detection reagent ofantigen.
Three standard strains ofand ten reference strains of non-were cultured in appropriate culture media at appropriate temperatures respectively. Fresh and uncontained cultures were collected, based on which positive and negative reference bacterial liquids were prepared by turbidimetry, and the reference bacterial liquids for minimum detection limit and repeatability were prepared by spectrophotometry. The prepared references were subjected to uniformity and stability test. Four laboratories were organized to coordinate the calibration of reference materials.
Positive reference consisted of three samples ofliquids, while negative reference consisted of ten samples of non-liquids. The reference for minimum detection and reproducibility consisted of frozen dried bacteria. The reference had good uniformity and stability. The collaborative calibration results of four laboratories showed that three positive references were 100% positive, ten negative references were 90% negative, and the lowest detection amount was between 107cells/ml and 106cells/ml. Repetitive reference test results were found to be consistent.
The reference can be used for quality control ofantigen detection reagent.
; Antigen; National reference; Uniformity; Stability
WEI Dong, Email: weidong1994@sina.com; YANG Rui-fu, Email: 13801034560@163.com
10.3969/j.issn.1673-713X.2020.03.006
國家科技重大專項(2018ZX10102-001);國家重點研發計劃(2018YFC200500)
魏東,Email:weidong1994@sina.com;楊瑞馥,Email:13801034560@163.com
2019-11-04
*同為第一作者

