干細胞臨床研究的現狀及展望
何萍,程濤,郝莎
·綜述·
干細胞臨床研究的現狀及展望
何萍,程濤,郝莎
300020 天津,中國醫學科學院血液病醫院(中國醫學科學院血液學研究所)實驗血液學國家重點實驗室/國家血液系統疾病臨床醫學研究中心(何萍、程濤、郝莎),科技管理處(何萍、郝莎);300020 天津,中國醫學科學院干細胞醫學中心/北京協和醫學院干細胞與再生醫學系(程濤)
干細胞是一類具有自我更新和多向分化潛能的細胞,在一定條件下可以分化為多種功能細胞。根據干細胞所處的發育階段可分為胚胎干細胞(embryonic stem cell,ESC)和成體干細胞(adult stem cell,ASC);根據干細胞發育潛能可分為全能干細胞(如 ESC)、多能干細胞(pluripotent stem cells,PSCs)和單能干細胞(如造血干細胞、神經干細胞等)。干細胞由于具有再生各種組織和人體器官的潛在功能,因此在醫學界常被稱為“種子細胞”或“萬用細胞”,為許多重大疾病的有效治療帶來了新的希望。
干細胞治療是利用干細胞的分化潛能,將健康的干細胞移植到患者體內,進而達到組織再生修復的作用。基于干細胞的修復與再生能力的再生醫學被譽為繼藥物治療和手術治療之后的第三次醫學革命[1]。干細胞治療對神經、血液、心腦血管、肝臟、腎臟等多個系統相關的重大疾病做了有益嘗試,正在成為各國政府、科技界和產業界高度關注和大力投入的戰略必爭領域。歐美及日本等發達國家和地區均將干細胞研究提升為國家科技發展的重要戰略進行科技部署并力推干細胞的臨床應用。與此同時,作為干細胞產業轉化研發主體的大型醫藥企業,也已針對干細胞及轉化醫學的發展趨勢做出投資和布局的調整,全球超過 700 家公司正在開展干細胞及轉化醫學相關的研究,競爭日趨白熱化。
本文將對干細胞臨床研究及應用的國內外發展現狀進行綜述,同時,回顧我國干細胞臨床研究相關的監管政策,提出我國干細胞行業發展存在的主要問題及對策建議。最后,對干細胞臨床應用的前景進行展望,以期對我國干細胞臨床研究及應用規范有序地開展提供有益借鑒。
1 干細胞臨床研究及應用的國際發展現狀和趨勢
1.1 干細胞臨床研究的國際發展現狀
在干細胞研究領域成為前沿熱點的背景下,目前全球登記的干細胞臨床試驗已超過 7000 項,其中有接近 3000 項已完成臨床試驗研究(數據來源于 Clinicaltrials.gov,截至 2019 年 12 月)。從疾病治療領域來看,神經系統疾病、癌癥和腫瘤類疾病、出生前疾病和異常、血液和淋巴疾病、心血管疾病是目前臨床研究數量較多的疾病領域。在干細胞治療的細胞種類選擇上,造血干細胞(hematopoietic stem cell,HSCs)的臨床試驗數量最多,占干細胞臨床試驗總數的 48.5%(3707/7637 項),體現出 HSCs 在干細胞臨床研究中受到的高度關注;其次為間充質干細胞(mesenchymal stem cells,MSC),總計有 1013 項,占比 13.3%,其數量尤其在近幾年持續增加,說明 MSC 的重要性日益增強;在其他類型細胞中,神經干細胞(neural stem cell,NSC)和多能干細胞的治療研究進入臨床試驗階段的項目數量也相對較多,其中神經干細胞被主要應用于中樞神經系統疾病的治療,而多能干細胞被主要應用于眼部疾病和遺傳性疾病的治療。
1.2 干細胞治療的國際發展趨勢
在造血干細胞移植(hematopoietic stem cell transplantation,HSCT)技術方面。HSCT 至今已經歷了 60 余年的發展歷程,可以治愈某些血液系統及非血液系統疾病,是最為經典和成熟的干細胞臨床應用方案,奠定了干細胞生物學和再生醫學的發展基石[2]。歐盟在 2016 年批準了第一個基于造血干細胞基因療法的產品 Strimvelis,用于治療由腺苷脫氨酶單基因引起的嚴重復合型免疫缺陷病。預計在 2020 年底,另外五個基于造血干細胞基因療法的產品在歐盟或者美國或將通過審批,進入臨床應用,并且還有 20 項針對不同基因遺傳疾病相關的臨床試驗也在進行中[3]。
在間充質干細胞治療方面。目前在全球上市的干細胞治療產品中,MSC 相關產品的數量占比最多,發展勢頭強勁。2010 年 7 月,澳大利亞批準 Mesoblast 公司生產和供應自體間質前體細胞,用于受損組織的修復和再生;2011 年7 月,韓國準許由 FCB-Pharmicell 公司開發的心臟病治療藥物 Hearticellgram-AMI 投放市場銷售;加拿大在 2012 年 5 月批準美國 Osiris 研發的干細胞藥物 Prochymal 上市,用于治療兒童急性移植抗宿主疾病(graft-versus-host disease,GvHD),之后新西蘭于同年 6 月15 日授予該公司干細胞藥物營銷許可,Prochymal 成為全球首個獲準用于治療全身性疾病的干細胞藥物。
在神經干細胞治療方面。2002 年 4 月美國首次報道了 1 例帕金森病患者接受 NSC 分化的多巴胺神經元自體移植治療的病例,臨床癥狀得到顯著改善;2011 年 3 月,美國 Stem Cells 公司在國際上首先利用 NSC 針對 12 名胸段脊髓損傷的患者開展 I/II 期臨床試驗,12 名患者中有8 名感覺功能獲得恢復[4];2014 年 8 月,美國NeuralStem公司經 FDA 批準從胎兒脊髓中獲取 NSC 用于 4 名患者治療陳舊性頸段及胸段脊髓損傷,結果顯示所有受試者耐受性良好,其中有 2 名患者有 1 ~ 2 個神經節段獲得改變[5];在中樞神經系統腫瘤的治療中,2007 年開展了一項 III 期臨床研究,主要是探討關于腦轉移瘤患者神經干細胞保護式放療與普通放療的優勢。
在多能干細胞治療方面。目前一些利用胚胎干細胞以及誘導多能干細胞分化的細胞也已進入了臨床試驗階段。2009 年 1 月,美國 FDA 批準了 Geron 公司全球首例人胚胎干細胞人體試驗,針對亞急性胸段脊髓損傷患者移植干細胞產品 GRNOPC1——一種由人胚干細胞分化的少突膠質前體。隨后,美國先進細胞公司獲準用人胚干細胞分化的視網膜色素上皮細胞進行治療視網膜黃斑變性病人的試驗。一年后,該臨床試驗也獲準在英國開展,成為歐洲首例胚胎干細胞臨床試驗。2014 年 9 月,日本批準了利用誘導多能干細胞制成視網膜細胞進行眼疾治療的臨床研究。此外,多能干細胞還被應用于藥物研發,例如用于研究心臟疾病的發病機制以及篩選相關藥物[6]。
1.3 國際干細胞產業的發展現狀
隨著干細胞臨床試驗研究的不斷增加,全球干細胞產業也邁入了高速發展期。目前全球已有 14 款干細胞藥物上市(表 1),適應證包括膝關節軟骨缺損、移植物抗宿主病、克羅恩病、急性心肌梗死、遺傳性或獲得性造血系統疾病、退行性關節炎、赫爾勒綜合征、中度至重度角膜緣干細胞缺乏癥、血栓閉塞性動脈炎等疾病。而正在全球范圍內積極開展的干細胞臨床試驗預示著未來還將有更多的適應證患者受益。
在獲批上市的干細胞藥物中,超過一半以上是間充質干細胞治療產品。根據 Polaris Market Research 發布的最新研究報告,全球間充質干細胞市場前景明朗,在多種綜合因素的影響下,整個市場將保持增長趨勢;2018 – 2026 年,全球間充質干細胞市場預計以 7.3% 的復合年增長率增長。同樣,全球市場調研機構 ARC(Analytical Research Cognizance)發布的報告也顯示,全球間充質干細胞市場發展迅速,預計至 2024 年底其市場值將達到 2.2 億美元。
2 我國干細胞臨床研究及應用的發展現狀
干細胞治療一直是生命科學前沿最受重視的領域之一,受到新的研究領域和方法的推動及各國政府政策的支持。目前全球干細胞臨床研究主要分布于美國、歐洲等國家或地區。近年來,在國家政策的扶持下,我國干細胞臨床研究也與日俱增,在數量上追趕而上,邁入世界領先行列。這預示著中國已進入全球干細胞治療領域的梯隊,與其他國家間的差距在逐步縮小。
2.1 我國干細胞臨床研究及應用的監管政策
我國干細胞治療領域發展至今,其監管經歷了數十年變革。為避免對干細胞治療技術臨床轉化產生負面影響的不規范現象,促進干細胞治療技術科學、有序發展,國家陸續出臺了一系列規范干細胞治療臨床研究和應用行為的政策和法規(圖 1)。
第一階段:1993 – 2003 年。
1993 年 5 月,原衛生部頒布《人的體細胞治療及基因治療臨床研究質控要點》,首次將人的體細胞治療納入藥品的法制化管理;國家藥監局(CFDA)成立后,分別于1999 年和 2003 年先后頒布《新生物制品審批辦法(局令第 3 號,1999)》和《人體細胞治療研究和制劑質量控制技術指導原則》,加強對新生物制品研制和審批的管理,明確人的體細胞治療按新藥注冊,并進一步完善人體細胞治療的質量控制技術原則。這是我國人的體細胞治療領域科學化、規范化、與國際同步的良好發展開端。
第二階段:2009 – 2015 年。
2009 年 3 月,原衛生部發布《醫療技術臨床應用管理辦法》,將細胞治療劃分為第三類醫療技術,對其實施準入管理。由此,我國的體細胞治療全面放開。但由于監管體制相對寬松,部分醫療機構科室在沒有經過衛生計生委批準的情況下紛紛開展體細胞治療項目,各種形式的臨床試驗和臨床應用項目迅速增加。2015 年 7 月,國家衛生計生委按照國務院行政審批制度改革要求,下發《國家衛生計生委關于取消第三類醫療技術臨床應用準入審批有關工作的通知》,正式取消第三類醫療技術臨床應用準入審批。與此同時,為規范并促進我國干細胞臨床研究,國家衛生計生委與食品藥品監管總局共同組織制定了《干細胞臨床研究管理辦法(試行)》和《干細胞制劑質量控制及臨床前研究指導原則(試行)》,我國從此開始施行干細胞臨床研究備案管理制度,標志著干細胞市場迎來風口。在臨床研究方面,干細胞治療得以從人的體細胞治療中分類出來,得到明確的專門管理辦法,并適用至今。

表 1 全球已上市干細胞藥物
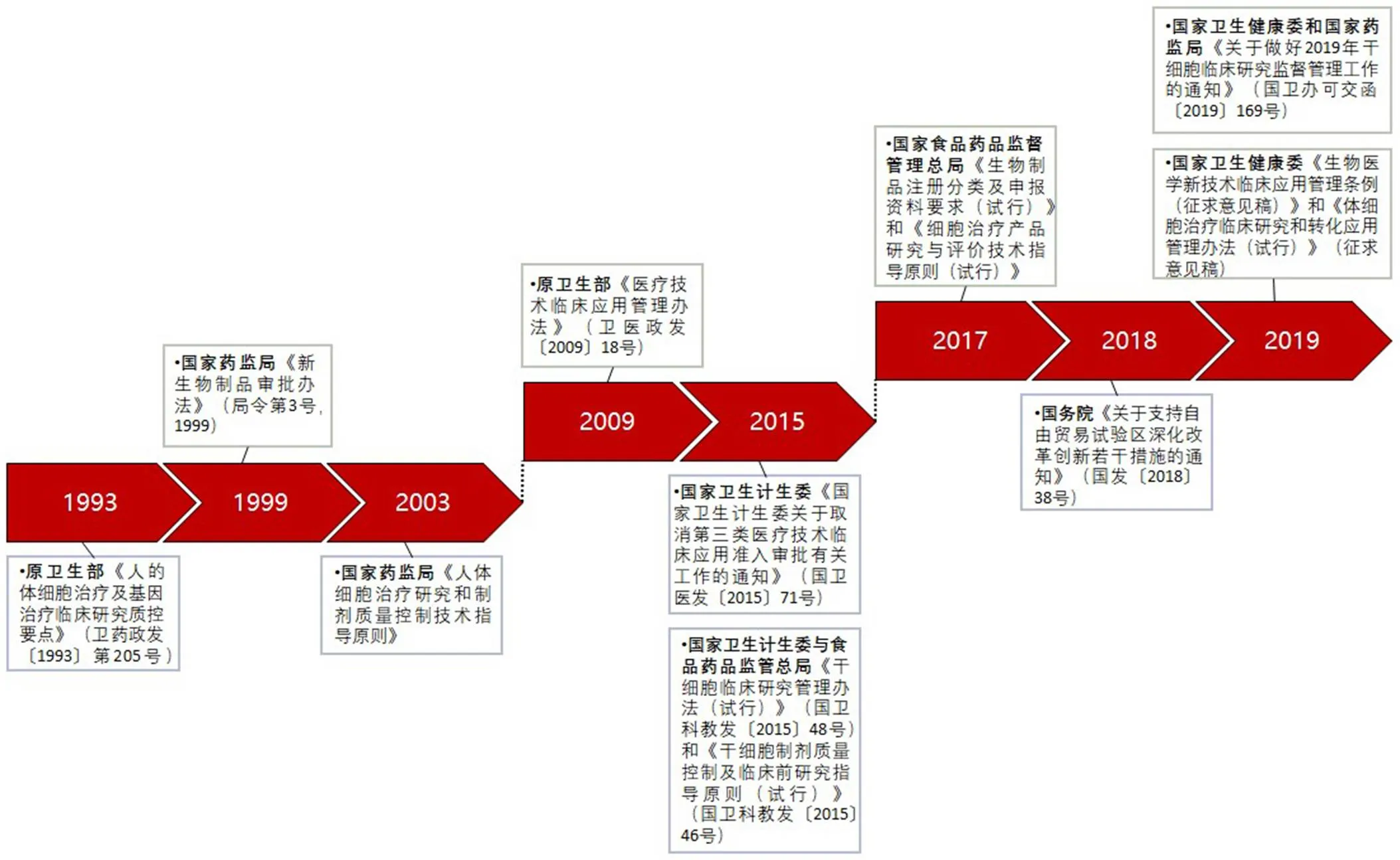
圖 1 干細胞臨床研究及應用的監管政策變革
第三階段:2017 – 2019 年。
2017 年 3 月,國家衛生計生委和國家食藥監總局在其醫學研究備案登記信息系統中公布了首批通過備案的 8 個干細胞臨床研究項目。同年 10 月,CFDA 發布《生物制品注冊分類及申報資料要求(試行)》,要求將細胞治療技術按照治療性生物制品進行申報。同年 12 月,《細胞治療產品研究與評價技術指導原則(試行)》正式落地,這也意味著國內細胞治療行業經歷整頓和規范后重入正軌。2018 年 11 月,國務院發布《關于支持自由貿易試驗區深化改革創新若干措施的通知》,明確提出了自貿試驗區的醫療機構可以根據自身的實際情況來開展干細胞臨床研究。此通知的頒布,表明我國對于干細胞治療技術的重視,也極大推動了我國干細胞行業的發展。2019 年 2 月,國家衛生健康委發布《生物醫學新技術臨床應用管理條例(征求意見稿)》,意見稿中明確:生物醫學新技術臨床研究實行分級管理。其中,干細胞產品被劃分為高風險生物醫學新技術,其臨床研究和轉化應用交由國務院衛生主管部門和國務院藥品監管部門管理。緊接著,國家衛生健康委和國家藥監局(后文簡稱“兩委局”)聯合印發《關于做好 2019 年干細胞臨床研究監督管理工作的通知》,明確今后需要同時進行干細胞臨床研究機構和項目的雙備案,并且干細胞臨床研究機構與項目備案自 2019 年起實行動態管理。2019 年 3 月,國家衛生健康委發布《體細胞治療臨床研究和轉化應用管理辦法(試行)》(征求意見稿),明確指出允許經臨床證明安全有效的細胞治療項目經過備案后在相關醫療機構進入轉化應用。
目前,醫療機構開展的干細胞臨床研究是由兩委局協同共管,以《中華人民共和國藥品管理法》為法律依據,遵照《干細胞臨床研究管理辦法(試行)》和《干細胞制劑質量控制及臨床前研究指導原則(試行)》開展專項監督檢查。如后續申請藥品注冊臨床試驗,可將已獲得的臨床研究結果作為技術性申報資料提交并用于藥品評價,但不能直接進行臨床應用。
此外,各地方省市也做出積極響應,相繼發布多項利好政策,鼓勵干細胞治療行業規范化蓬勃發展。經過近幾年的探索和試點放開,逐漸打造了以珠三角地區、環渤海地區、長三角地區和西南地區為中心向四周輻射的干細胞行業發展格局。
2.2 我國干細胞臨床研究及應用的發展現狀
我國干細胞行業在國家鼓勵性政策的引導下正在蓬勃發展。在干細胞臨床研究方面,根據中國醫藥生物技術協會的公示信息,截至 2019 年 12 月,我國干細胞臨床研究備案機構已增至 119 家,其中國家批準干細胞臨床治療研究醫院 107 家,軍隊系統醫院 12 家。從地區分布上看(圖 2),北京、廣東、上海已通過備案研究機構的數量處于領先地位;浙江、山東、云南、江蘇和湖北緊隨其后。同時,由備案機構提交的干細胞臨床研究備案項目已增69 個,部分項目已宣布啟動。其中,從涉及的疾病治療領域來看(圖 3),神經系統疾病(占比 19%)和婦產科疾病(占比 16%)是目前最受關注的兩個領域,未來有望獲得快速突破。
在干細胞臨床應用方面,根據國家藥品監督管理局藥品審評中心(CDE)公示信息顯示,2018 年 6 月以來,共有 12 款干細胞新藥注冊申報獲受理,結束了我國干細胞領域在此前長達四年之久的申報受理空白期。2019 年我國干細胞臨床轉化也獲得了實質性進展。在國家藥監局收審的干細胞 I 類新藥中,有 7 款干細胞新藥已獲得臨床試驗默示許可,分別是胎盤、臍帶、異體/自體脂肪來源的間充質干細胞,適應證包括了膝骨關節炎、類風濕關節炎、糖尿病足潰瘍和GvHD。
目前,我國干細胞的臨床應用尚屬起步階段,盡管上述干細胞臨床試驗已初見成效,但仍有許多問題有待解決,在大規模臨床應用前,為確保其療效和安全性,必須進行嚴格的質量控制,進行堅實的基礎研究和動物模型實驗,開展大樣本、多中心、隨機對照干細胞治療臨床試驗等,相信隨著干細胞研究的不斷深入,在未來的生物科學領域將發揮巨大的作用。
3 干細胞研究和臨床應用存在的主要問題及對策建議
干細胞在某些疑難性疾病的治療效果對其的臨床轉化起到了巨大的推動作用,但是干細胞治療真正邁向臨床廣泛應用仍任重道遠。在這個進程中,有兩個主要的限制因素。
一是缺乏國家乃至國際統一認證的質控標準。美國為保證干細胞臨床試驗能夠安全有序的開展,其藥品監管部門制定了完善的審批和臨床試驗體系,其中就包括制定細胞供體選擇、細胞鑒定等規范[7]。而在我國,國家藥品監管部門對干細胞的安全及有效性的評價標準和干細胞技術的標準操作規程是相對缺乏的,對干細胞臨床研究的規范也尚未明確[8],這不利于我國干細胞產業化以及干細胞治療市場的發展。在此背景下,一些國內學/協會開始關注到該問題,啟動了組織行業專家制定相關團體標準的工作。
2016 年 10 月,中國醫藥生物技術協會為規范我國干細胞制劑制備、加強質量管理、促進行業自律,發布《干細胞制劑制備質量管理自律規范》[9],結束了我國多年來在干細胞制劑制備領域中沒有質量要求和標準的歷史。2017 年 11 月,中國細胞生物學學會干細胞生物學分會發布《干細胞通用要求》[10],該標準圍繞干細胞制劑的安全性、有效性及穩定性等關鍵問題,建立了干細胞的供者篩查、組織采集、細胞分離、培養、凍存、復蘇、運輸及檢測等的通用要求,有力地推動干細胞領域的規范化和標準化。2019 年2 月,中國細胞生物學學會再次發布《人胚胎干細胞》團體標準[11],這是中國乃至國際首個針對胚胎干細胞的產品標準。中國科學院動物研究所周琪院士表示,“這些標準將在干細胞領域標準化建設、保障受試者權益、規范干細胞行業發展、促進干細胞轉化應用等方面發揮重要作用”。今后,為進一步應對該發展瓶頸,期待我國建設國家級干細胞質量控制體系,進而開展統一的干細胞制劑的質量及治療標準化研究,發布國家級質控規范,引領行業質控標準。
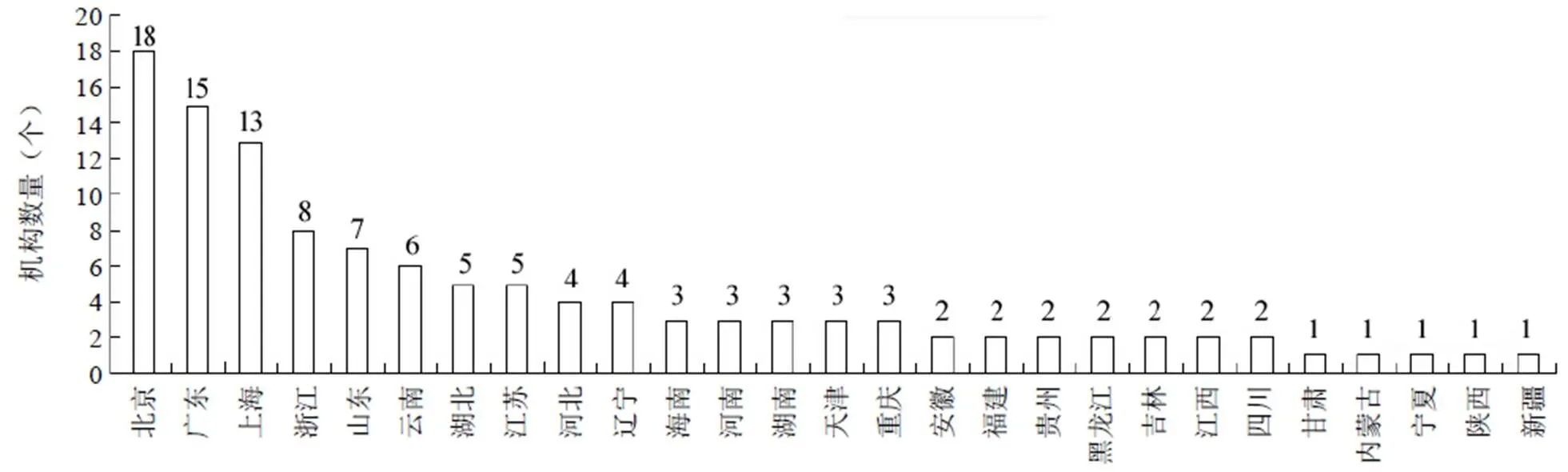
圖 2 干細胞臨床研究備案機構的全國分布情況
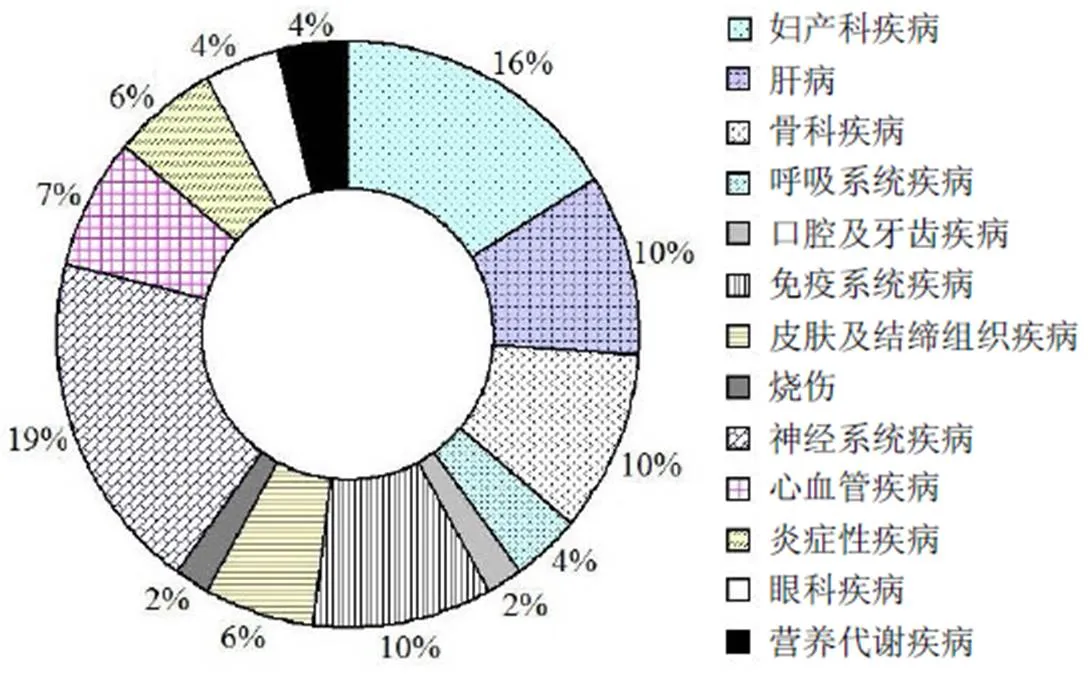
圖 3 干細胞臨床研究備案項目的疾病領域分布情況
二是缺乏干細胞臨床研究及應用的基于風險的分級管理機制。國內干細胞臨床藥物和治療應用市場目前受到政策法規的嚴格管理,中下游產業因技術壁壘高、審批嚴格,導致轉化進程遲緩。美國、歐盟等地的藥品監管部門對細胞治療實行基于風險的分級管理:對“最小化干預”、“同源使用”的自體細胞作為醫療技術使用,不在藥品管理法范圍,不需要走新藥申報程序;對超出“最小化干預”或“非同源使用”的細胞產品作為藥品進行臨床研究與申報,并制定豁免條款,符合條件的醫療技術允許在授權醫院使用。在此分級管理機制下,通過美國 FDA 或歐盟EMA 首次審批,已成功上市了共 8 款干細胞新藥,占據全球上市干細胞新藥的半壁江山。
基于國際上的監管政策情況,我國已開始在生物醫學新技術的臨床研究中初步探索建立基于風險的分級管理機制。2019 年 2 月 26 日,國家衛生健康委發布《生物醫學新技術臨床應用管理條例(征求意見稿)》,將干細胞的臨床研究歸入高風險生物醫學新技術實行監管,未經臨床研究證明安全性、有效性的,不得進入臨床應用。但針對不同類型的干細胞治療技術,并未進一步分級。因此,我國是否能進一步探索建立針對干細胞臨床轉化的創新政策監管體制,加強安全管控,同時鼓勵技術創新,推動干細胞產業安全、規范、高質量發展,這也許會是解決轉化進程遲緩問題的突破口。
4 展望
干細胞科技的力量正在逐漸為人所知的案例中得以展現[12]。目前已經有上百種疾病的臨床研究采用了干細胞,并且從啟動的干細胞臨床研究項目進展中,我們可以看出干細胞在多種疾病中擁有著巨大的治療潛力[6]。雖然全球正在進行的干細胞研究大多處于臨床早期,但隨著臨床試驗數量的迅速且持續地增加,相信未來有望迎來成果產出的爆發期,為更多難治性疾病的患者帶去希望。我國的干細胞行業在國家政策的科學監管下也逐步進入良性發展軌道。根據 IMS 數據預測,到 2020 年,全球干細胞市場將達到 4000 億美元,中國干細胞市場規模將高達 1200 億元人民幣。但是,考慮到我國干細胞生物技術產業目前主要是上游產業,以干細胞存儲為主,干細胞臨床轉化研究的步伐還有待進一步加快,尤其是在臨床級別的干細胞的建立與培養方法、質控體系建立、多能干細胞定向分化/轉分化、干細胞體外 3D 培養、遺傳和表觀遺傳的操控等方面加強研究和突破,將對干細胞的應用推廣具有重大的臨床價值。
總之,干細胞作為一項高新科技,它將給醫學、保健事業帶來跨時代的顛覆性變革,為人類的健康和高質量生活帶來福音。期待在不久的將來,我國首個擁有自主知識產權的干細胞上市新藥誕生,為全球干細胞產業發展貢獻更多力量。
[1] Zhou Q. Stem cells -- The heart of the new medical revolution// Branch of Tissue Engineering and Regenerative Medicine, Chinese Society of Biomedical Engineering. Proceedings of the sixth national congress of tissue engineering and regenerative medicine. 2013:37. (in Chinese)
周琪. 干細胞--新醫學革命的核心//中國生物醫學工程學會組織工程與再生醫學分會. 第六屆全國組織工程與再生醫學大會論文集. 2013:37.
[2] Hao S, Dong F, Hu LP, et al. Biology and clinical application research of hematopoietic stem cells. Chin J Cell Biol, 2018, 40(13):2237-2248. (in Chinese)
郝莎, 董芳, 胡林萍, 等. 造血干細胞生物學及臨床應用研究概況. 中國細胞生物學學報, 2018, 40(13):2237-2248.
[3] De Luca M, Aiuti A, Cossu G, et al. Advances in stem cell research and therapeutic development. Nat Cell Biol, 2019, 21(7):801-811.
[4] Li JY, Han SF, Xiao ZF, et al. Clinical studies on neural regeneration in traumatic spinal cord injury. Sci China (Ser C), 2019, 49(6):673- 682. (in Chinese)
李佳音, 韓素芳, 肖志峰, 等. 脊髓損傷再生修復的臨床研究進展. 中國科學(生命科學), 2019, 49(6):673-682.
[5] Curtis E, Martin JR, Gabel B, et al. A first-in-human, phase I study of neural stem cell transplantation for chronic spinal cord injury. Cell Stem Cell, 2018, 22(6):941-950.
[6] Blau HM, Daley GQ. Stem cells in the treatment of disease. N Engl J Med, 2019, 380(18):1748-1760.
[7] Gao SP, Qu CH, Zhou R, et al. Advances in stem cell research and translational medicine. Acta Laboratorium Anim Scientia Sinica, 2016, 24(4):439-442. (in Chinese)
高舒平, 曲春輝, 周瑞, 等. 干細胞與轉化醫學研究進展淺析. 中國實驗動物學報, 2016, 24(4):439-442.
[8] Chen H. Translational research on stem cells in China. Chin Med Biotechnol, 2011, 6(5):321-322. (in Chinese)
陳虎. 我國干細胞轉化醫學進程探究. 中國醫藥生物技術, 2011, 6(5):321-322.
[9] China Medicinal Biotechnology Association. Code of manufacturing quality management for stem cell based-medicinal product. Chin Med Biotechnol, 2016, 11(6):481-490. (in Chinese)
中國醫藥生物技術協會. 干細胞制劑制備質量管理自律規范. 中國醫藥生物技術, 2016, 11(6):481-490.
[10] Chinese Society for Stem Cell Research. T11/CSSCR 001-2017 General requirements for etem cells. Beijing: China Standard Press, 2017. (in Chinese)
中國細胞生物學學會干細胞生物學分會. T11/CSSCR 001-2017 干細胞通用要求. 北京: 中國標準出版社, 2017.
[11] Chinese Society for Cell Biology. T/CSSCR 002-2019 Human embryonic stem cell. Beijing: China Standard Press, 2019. (in Chinese)
中國細胞生物學學會. T/CSSCR 002-2019 人胚胎干細胞. 北京: 中國標準出版社, 2019.
[12] Xu L, Wang J, Liu Y, et al. CRISPR-edited stem cells in a patient with HIV and acute lymphocytic leukemia. N Engl J Med, 2019, 381(13): 1240-1247.
中國醫學科學院醫學與健康科技創新工程基金(2016-I2M- 1-017、2019-I2M-1-006)
郝莎,Email:haosha@ihcams.ac.cn
2019-12-30
10.3969/j.issn.1673-713X.2020.03.011

