淺析茶多酚關于物質的量的計算
辛廣勤,楊惠良,武永巨,何天香,楊素青,栗秀娥,徐 濤
(德州學院,山東德州 253023)
茶多酚(Tea Polyphenols)是茶葉中多酚類物質的總稱,包括黃烷醇類、花色苷類、黃酮類、黃酮醇類和酚酸類等。主要為黃烷醇(兒茶素)類,兒茶素占60~80%。類物質茶多酚又稱茶鞣或茶單寧,是形成茶葉色香味的主要成份之一,也是茶葉中有保健功能的主要成份之一。研究表明,茶多酚等活性物質具解毒和抗輻射作用,能有效地阻止放射性物質侵入骨髓,并可使鍶90和鈷60迅速排出體外,被健康及醫學界譽為“輻射克星”。茶多酚成分如此復雜有關其物質的量的計算怎樣處理呢?
“物質的量”是我國30年代初引進的一個化學物理量。在這之前“物質的量”一直以“克分子”,“克原子”來代替。實際上“克分子"、“克原子”只是“物質的量”的單位,它們可以代替現在廣泛使用的“摩爾”,而不能代替“物質的量”這一概念。
自從1811年,意大利物理學家阿伏加德羅提出了著名的分子假設以后,阿伏加德羅常數在化學上逐漸得到應用。化學科學研究也從單純的實驗手段,進入到實驗、數學和工程技術相結合的階段,使微觀物質有了宏觀計量方式。化學分析手段也從定性進入到定量。化學研究水平跨上了一個新臺階。
實際上,公元前3世紀阿基米德把工程技術、數學和實驗方法相結合創立了科學的研究方法以后,科學研究即進入了一個飛速發展的時期。從1811年到1932年,才一百多年的時間,科學新發現進入到最高峰,當今所應用的各項成果幾乎全部是那一時期的科學發現。阿伏加德羅對分子的假設也產生于這一時期,雖然這一假設直到50年后才被化學界廣泛應用。但現代意義的物質的量正是基于此而產生的。如今,物質的量已經成為一根紅線,把整個化學內容像珍珠一樣穿在了一起,物質的量的概念在整個化學科學研究中起著不可替代的作用。相反,在當今的化學概念中,物質的量已經取代“克當量”的位置。這一切都說明,物質的量在化學學科中占有非常重要的地位。
從實踐看,物質的量主要涉及以下四個方面的內容:(1)物質的量的單位-摩爾的定義;
(2)物質的量與質量的換算--摩爾質量;
(3)物質的量與氣體體積的換算-氣體摩爾體積
(4)物質的量與溶液濃度的換算-物質的量濃度。
1.物質的量的單位—摩爾
摩爾是物質的量的單位,也是國際標準單位之一,除摩爾外,物質的量的單位還有千摩、毫摩等。
1千摩=1000摩爾=106毫摩
摩爾的導出像力的單位牛頓的導出一樣,有一前提條件。作為摩爾的前提條件就是“阿伏加德羅常數”。
阿伏加德羅常數是一個假定值,是現代化學科學發展的結晶。該常數的假定是科學性假定,它的科學性就是以12C原子作為阿伏加德羅常數的基礎,而1個12C的1/12又是相對原子質量的基本單位。這樣就使阿伏加德羅常數與相對原子質量有了科學的聯系,大大方便了數學手段在化學中的應用。
阿伏加德羅常數是指0.012千克12C所含的12C原子個數。該數值是非常寵大而精確的數字,沒人能夠精確計算出阿伏加德羅常數。所以,阿伏加德羅常數常以符號NA代表。不過,在我們學習中可以以6.02x1023作為阿伏加德羅常數的近似值使用。摩爾的定義是以阿伏加德羅常數為基礎的,定義為:“凡物質的微粒數達到阿伏加德羅常數個時,該物質的物質的量就是一摩爾。”
這一定義將物質的量與微觀粒子個數以阿伏加德羅常數為單位聯系在了一起,可用下列關系式表示:

實際上,這一關系在實驗操作中并無實際意義。我們不可能取出幾個分子或原子去參加化學反應,只能以分子或原子的寵大集團,以宏觀能操作的方法讓它們參與實驗。這一關系一般只用于數學計算之中。
2.物質的量與質量—摩爾質量
自從17世紀中葉,英國物理學家和化學家玻義爾“把化學確立為科學”以后,化學家們對相對原子質量、相對分子質量的研究和計算經過了漫長的兩個多世紀。這期間科學家們付出了艱辛的勞動和汗水,目的是為了能從定量方面來研究化學元素和化學反應。隨著科技水平的不斷發展,人們對分子、原子的研究從起初的宏觀到微觀,對分子、原子的認識越來越深刻。到本世紀60年代,相對原子質量的標準得到了統一,物理界和化學界統一采用12C=12.000作為原子質量的相對標準,使相對原子質量在數值上獲得了統一。阿伏加德羅常數也是集化學家們的共同研究成果而得出的重要物理常數之一。該常數的假定同樣以12C作為基礎,這就使相對原子質量和相對分子質量等這些微觀計量方法與宏觀計量方法—質量有了密切聯系。使物質的量與質量有了聯系點。
物質的量與質量的關系,是通過摩爾質量相聯系的。摩爾質量是指“一摩爾物質的質量”。因為,一摩爾物質所含的微粒數是12.0000克(0.012千克)12C所含的碳原子個數(阿伏加德羅常數)。所以,從這里看12C的摩爾質量就是12.0000克/摩爾(0.012千克/摩爾),在數值上與12C的相對原子質量12.0000相等(以克為單位)。又因為其它原子的相對原子質量均以12C的相對原子質量12.0000為相對標準,所以,其它原子的摩爾質量以克為單位時,數值上也與該原子的相對原子質量相等。
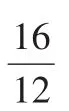
在國際單位制中,質量的基本單位是千克。所以,摩爾質量的量綱應是千克·摩-1或Kg·mol-1。
對于分子來說,由于分子是由原子組成的,所以,分子的摩爾質量可以由組成分子的各原子的摩爾質量相加得出。
例如,HCI的摩爾質量(MHCl)=H的摩爾質量(MH)+CI的摩爾質量(MCl)
即:MHCl=0.001+0.0355=0.0356千克·摩-1
從摩爾質量(M)可以導出物質的量(n)與質量(m)之間的換算關系。

這可以看作是微觀物體的宏觀計量方式的第二個關系式。
3.物質的量與氣體體積—氣體摩爾體積
阿伏加德羅提出的分子假說,是當今化學科學的最重要理論之一。對氣體分子來說,從阿伏加德羅理論可以直接計算出它們的相對分子質量。在當今利用阿伏加德羅常數和物質的量又可直接計算出氣體分子的個數和質量。
在原著中,阿伏加德羅提出:“一切氣體在相同體積中含有相等數目的分子。”而作為相同體積相同分子數目的前提是溫度、壓強不變。所以,我們可得出阿伏加德羅定律如下:
“相同溫度、相同壓強下,不同氣體在體積相同時,具有相同的分子數。”
現代化學理論又對阿伏加德羅定律從分子運動論的角度進行了圓滿的解釋,并且又把標準狀況下氣體分子的宏觀計量方法以“氣體摩爾體積”為常量與物質的量進行換算。
在化學著作中,“氣體摩爾體積”是一個常量。實際上是阿伏加德羅定律的一個特定情況,即,在標準狀況下(0℃,1標準大氣壓),1摩爾的任何氣體體積都約為22.4升。”
這是一個特殊情況下的常數,只有在標準狀況下才能使用,可以用V0表示。
V0=22.4升/摩
當已知某氣體在標準狀況下的體積為V升,則可通過V0求出該氣體的物質的量n

這一式子可以作為特定情況下,氣體分子的宏觀計量關系式,對于非標準狀況下氣體分子的宏觀計量,需借助于理想氣體狀態方程(又叫克拉珀龍方程)來計算。

上式中P是氣體壓強,V是氣體體積,m是氣體質量,M是氣體分子的摩爾質量,R是摩爾氣體常數(值為8.31焦·摩-1·開-1)T是絕對溫度(單位:開)。
阿伏加德羅定律用于氣體分子的計量,實際上是現代科技的發展和完善。作為偉大的科學家阿伏加德羅來說,也不曾想到自己的理論會對當今科學有這么大的貢獻。
4.物質的量與濃度—物質的量濃度
物質的量與物質的量濃度是兩個不同的物理量,它們的量綱不同,但可以相互換算。它們的換算關系是研究學習物質的量的重要關系之一,是溶液理論的延伸和發展。
科學家們對原子量的研究在19世紀初就已經開始。但,所計算出的原子量和分子量多限于氣體分子或揮發性物質。對難揮發性物質相對分子質量的研究則一直到了19世紀末才開始,這種研究正是借助溶液理論而進行的。用物質的量濃度來表示的溶液雖不能直接用來測定溶質的相對分子質量。但在現代溶液理論中,仍是重要的研究內容之一。
物質的量濃度通常用符號c表示:“1升溶液中所含溶質的物質的量,稱為該溶液的物質的量濃度。”可用下式表示。

式中c是物質的量濃度,n是物質的量,單位是摩爾,V是溶液體積,單位是升。
這一式子是物質的量與溶液濃度之間的轉換關系式。
茶多酚盡管是多種物質的混合物,但從元素組成的角度看并不復雜,只有碳、氫、氧和氮四種元素,化學式為C17H19N3O。如此其摩爾質量為281克/摩爾,若計算一定質量m克的茶多酚的物質的量n。
則:n(C17H19N3O)=m(C17H19N3O)克/281克/摩爾。
若計算一定體積V升的溶液中含有一定質量m克的茶多酚的物質的量濃度c.
則:c(C17H19N3O)=n(C17H19N3O)/V=m(C17H19N3O)/281克/摩爾·V。

