2-氯乙醇促進果糖非催化脫水制備5-羥甲基糠醛*
陳利利,鄺棟鈴,黃正宇,馬浩,滕俊江,李凝
(1.廣東石油化工學院 化學學院; 2.廣東石油化工學院 化學工程學院,廣東 茂名 525000)
HMF是非常重要的生物質基平臺化學品,通過酸催化可再生的糖類化合物脫水制備[1]。由于其分子中含有醛基(—CHO)、羥甲基(—CH2OH)和呋喃環結構,可以經過氧化、還原、偶聯等反應衍生出眾多高附加值平臺化學品[2],故HMF被認為是連接可再生生物質資源和傳統石化資源的橋梁,同時也被美國能源部列為十大最重要的生物質基平臺化學品[3-5]。因此,HMF生產技術的開發和利用對于緩解我國乃至世界石化資源危機具有極其重要的意義[6]。
課題組前期系統研究了果糖在非功能化離子液體[C4mim]Cl以及含有烯丙基(1-烯丙基-3-甲基咪唑氯鹽[Amim]Cl)、羥乙基(1-羥乙基-3-甲基咪唑氯鹽[C2OHmim]Cl)和氯乙基(1-氯乙基-3-甲基咪唑氯鹽[C2Clmim]Cl)三種功能化離子液體中非催化脫水生成HMF的性能[7, 8]。發現離子液體中陽離子上的官能團對果糖脫水轉化性能有非常明顯的影響,且陽離子含有氯基功能團(—Cl)時,果糖非催化脫水制備HMF的性能最強,在90 ℃的條件下,反應40 min,即可實現果糖完全轉化,且HMF的產率達97.7%[8]。基于此,為了進一步研究氯基功能團對果糖在離子液體中脫水轉化生成HMF性能的影響規律,本文以非功能化離子液體[C4mim]Cl為溶劑,以2-氯乙醇為功能化添加劑,深入研究果糖的非催化脫水轉化規律,并對過程影響因素、反應動力學、非催化脫水機理進行探索。
1 實驗部分
1.1 儀器和試劑
儀器:高效液相色譜儀(HPLC,Agilent 1200,安捷倫科技有限公司),配有示差和紫外檢測器。
試劑:2-氯乙醇、甲醇(色譜純)購自百靈威科技有限公司;離子液體[C4mim]Cl由青島奧立科新材料科技有限公司提供;果糖等其他試劑購自廣東光華科技股份有限公司,且所有試劑均未進一步純化。
1.2 果糖脫水反應及產物分析方法
向10 mL的圓底燒瓶中加入2.0 g [C4mim]Cl和0.20 g(2.5 mmol)氯乙醇,磁力攪拌,混合均勻后,加入0.45 g(2.5 mmol)果糖,在設定溫度下油浴鍋加熱進行脫水反應。為了追蹤反應規律,在反應過程中,使用移液槍取樣0.1 mL,加水稀釋定容至10 mL,通過HPLC對果糖和HMF進行定性和定量分析(外標法)。詳細分析方法見課題組發表論文[8]。
果糖轉化率(C, mol%)、HMF產率(Y, mol%)以及HMF選擇性(S, mol%)計算公式如下:
(1)
(2)
(3)
式中:n0,n1分別為反應前、后果糖的物質的量,mol;n(HMF)為HMF的生成量,mol。
1.3 果糖脫水反應動力學
果糖脫水過程屬于一級動力學反應,本文利用阿倫尼烏斯公式(4)對果糖脫水反應的活化能和指前因子進行求解[9-12]。
(4)
式中:Ea為表觀活化能,kJ·mol-1;A為指前因子,min-1;T為絕對溫度,K;R為氣體常數8.314 J·(mol·K)-1。
2 結果與討論
2.1 2-氯乙醇促進果糖非催化脫水制備HMF
為了研究2-氯乙醇對果糖在離子液體[C4mim]Cl中脫水反應的促進作用,本文首先對比了不同2-氯乙醇添加量的情況下,果糖脫水轉化制備HMF的規律,結果如圖1所示。
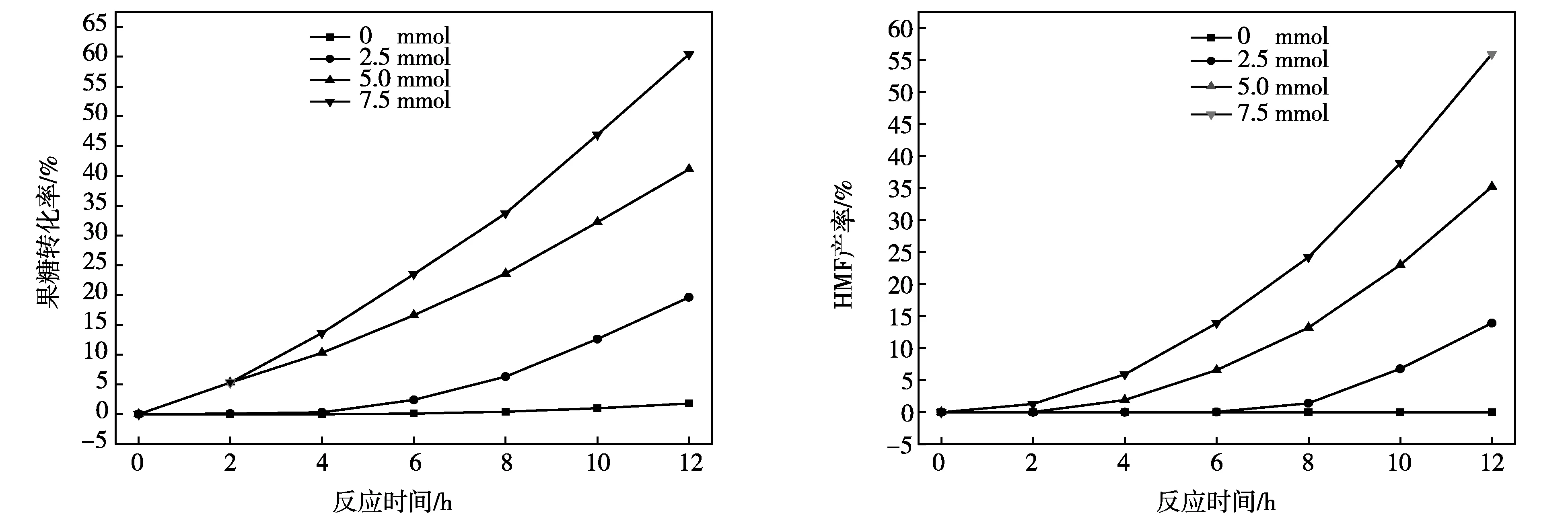
a 2-氯乙醇用量對果糖轉化率影響 b 2-氯乙醇用量對HMF產率影響
(反應條件:2.0 g [C4mim]Cl,0.45 g果糖,室溫)
圖1 2-氯乙醇用量對果糖轉化率和HMF產率影響
從圖1a可以看出,在無2-氯乙醇存在的室溫條件下,果糖可以在[C4mim]Cl中穩定存在,反應12 h后,果糖幾乎沒發生轉化。然而,當一定量的2-氯乙醇添加到反應體系中,隨著反應時間的延長,果糖在室溫下的轉化率明顯提高,且2-氯乙醇的用量越大,果糖的轉化速度越快,說明2-氯乙醇可以有效促進果糖在[C4mim]Cl中的轉化[7,8]。通過分析反應體系中HMF的產率發現(圖1b),2-氯乙醇的用量同樣對HMF的產率有明顯的影響,2-氯乙醇的用量越大,在相同的反應條件下,HMF的產率越高,且HMF的產率隨著反應的進行增加速度越來越明顯。上述結果表明,2-氯乙醇可以促進果糖在[C4mim]Cl中非酸催化脫水轉化形成HMF[7,8]。
通過對比果糖在不同2-氯乙醇用量時的轉化率(圖1a)和HMF產率(圖1b)可以發現,果糖的轉化率均略高于對應的HMF產率,說明果糖在脫水轉化形成HMF過程中有部分未知物生成。本文隨后對果糖脫水轉化形成HMF的選擇性進行分析,結果如圖2所示。
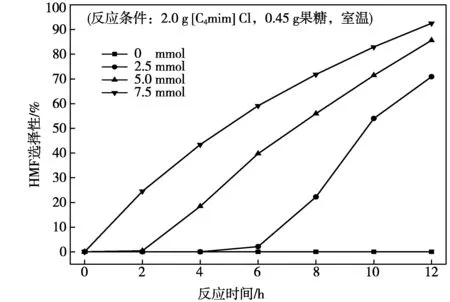
圖2 2-氯乙醇用量對果糖脫水生成HMF選擇性影響
從圖2中可以看出,在2-氯乙醇存在的條件下,隨著反應的進行,果糖生成HMF的選擇性逐漸增加,且2-氯乙醇的用量越大,HMF的選擇性越高。當2-氯乙醇用量為7.5 mmol時,室溫條件下反應12 h后,果糖生成HMF的選擇性達到90%以上。通過對比果糖的轉化率(圖1a)、HMF的產率(圖1b)和選擇性(圖2)可以發現,果糖在轉化過程中形成的未知物隨著反應的進行可以轉化為HMF,這一結果說明上述未知物可能是果糖脫水形成了HMF的中間體[13]。
2.2 反應溫度的影響
為了深入研究2-氯乙醇對果糖在[C4mim]Cl中非酸催化脫水轉化形成HMF的影響規律,本文繼續研究了在5.0 mmol的2-氯乙醇作用下,反應溫度對果糖脫水制備HMF的影響,結果如圖3所示。
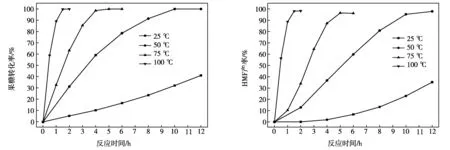
a 反應溫度對果糖轉化率的影響 b 反應溫度對HMF產率的影響
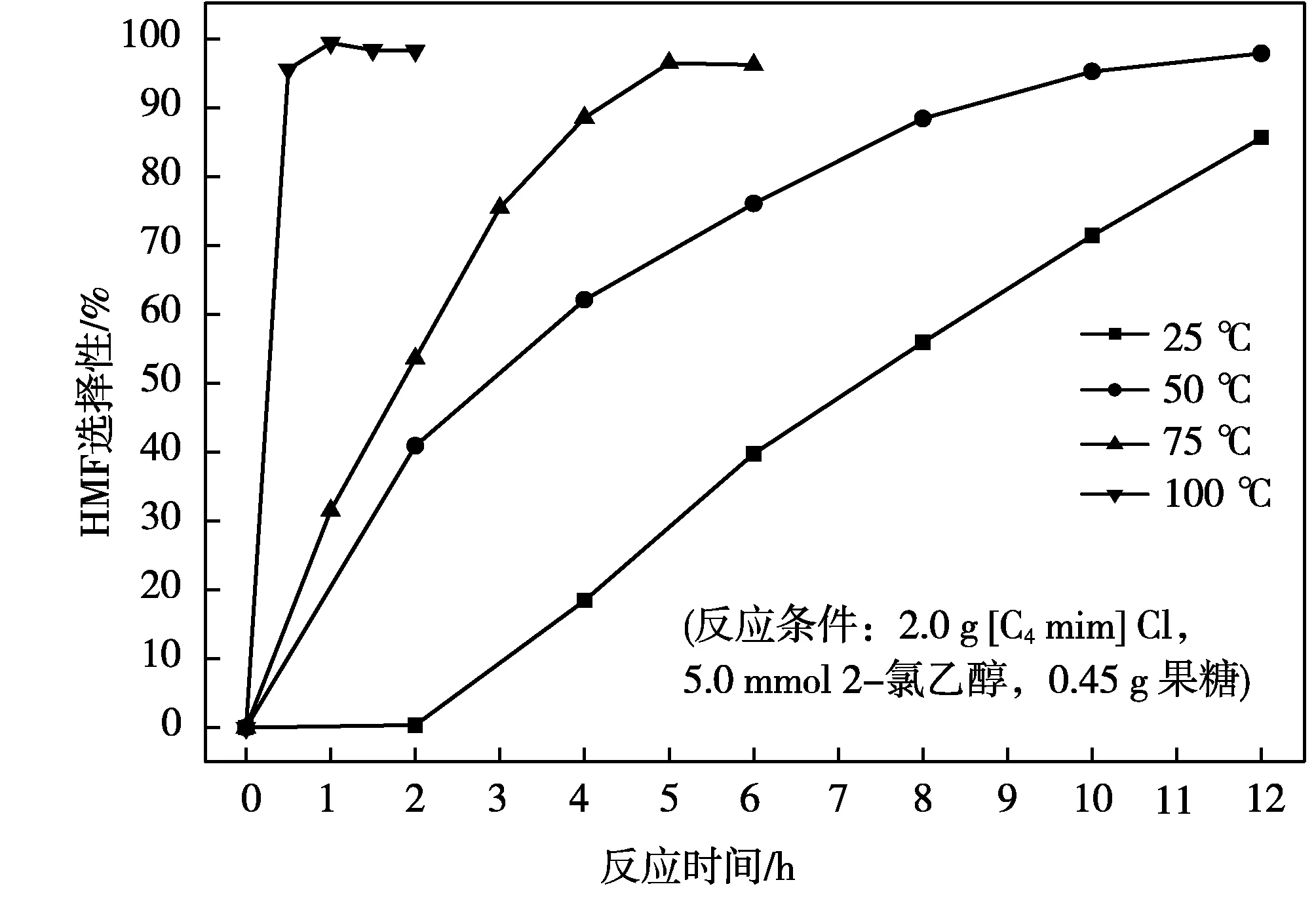
圖4 反應溫度對果糖脫水生成HMF選擇性影響
從圖3a中可以看出,反應溫度的提高有利于果糖在[C4mim]Cl中的脫水反應,反應溫度越高,果糖完全轉化的時間越短。在100 ℃條件下,反應1.5 h,果糖即可實現完全轉化。反應溫度對HMF產率的影響規律與果糖轉化率的相似(圖3b),在適當的反應溫度和反應時間下均可以達到最大值。然而當HMF產率達到最大值后,繼續延長反應時間,HMF的產率呈現稍微下降趨勢。這主要是由于生成的HMF在反應體系中會發生部分副反應,形成胡敏素等副產物,且反應時間越長,發生的副反應影響越大[14-16]。通過對果糖脫水轉化生成HMF選擇性分析發現(圖4),較高的反應溫度同樣有利于HMF副反應的發生,從而降低HMF的生成效率[16, 17]。
2.3 動力學及反應機理
上述結果表明2-氯乙醇可以高效地促進果糖在[C4mim]Cl中非酸催化脫水形成HMF,為了深入了解2-氯乙醇的促進機制,本文繼續研究了在2-氯乙醇存在的條件下,果糖脫水轉化的動力學。果糖的
脫水轉化是一級反應,符合一級動力學方程。本文以上述不同反應溫度對果糖轉化率的影響規律為數據基礎(圖3a),通過分析不同反應溫度下的速率常數k,并與反應溫度T進行作圖(圖5),同時利用阿倫尼烏斯公式(4)對反應的活化能和指前因子進行求解[9-12],結果如表1所示。
由表1可知,在2-氯乙醇存在條件下,果糖在[C4mim]Cl中脫水轉化的活化能為48.3 kJ/mol,遠低于傳統酸催化體系的活化能,表明在[C4mim]Cl中2-氯乙醇可以有效與果糖相互作用,從而降低其脫水轉化的活化能。基于此,并結合圖1和圖2研究結果,本文對果糖在2-氯乙醇促進劑存在的情況下,在[C4mim]Cl中非催化脫水轉化形成HMF的機理進行假設,結果如圖6所示。

表1 活化能(Ea)與指前因子(A)參數反應級數活化能/ (kJ·mol-1)指前因子/ min-1R2數值1.048.32.6×1050.9921 圖5 速度常數與反應溫度關聯規律曲線
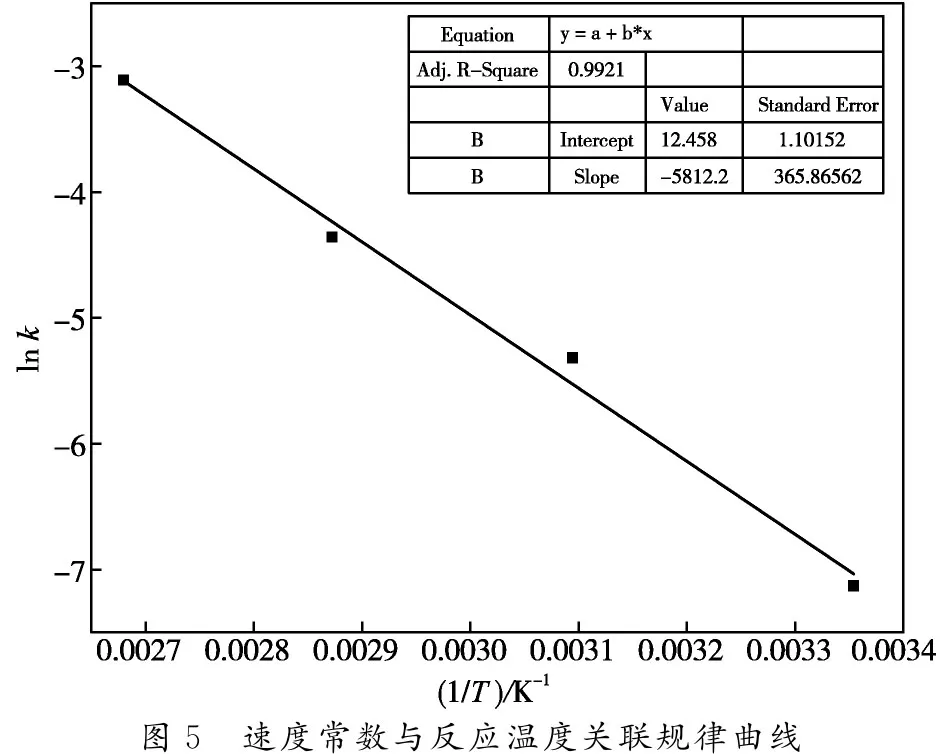
表1 活化能(Ea)與指前因子(A)參數反應級數活化能/ (kJ·mol-1)指前因子/ min-1R2數值1.048.32.6×1050.9921 圖5 速度常數與反應溫度關聯規律曲線
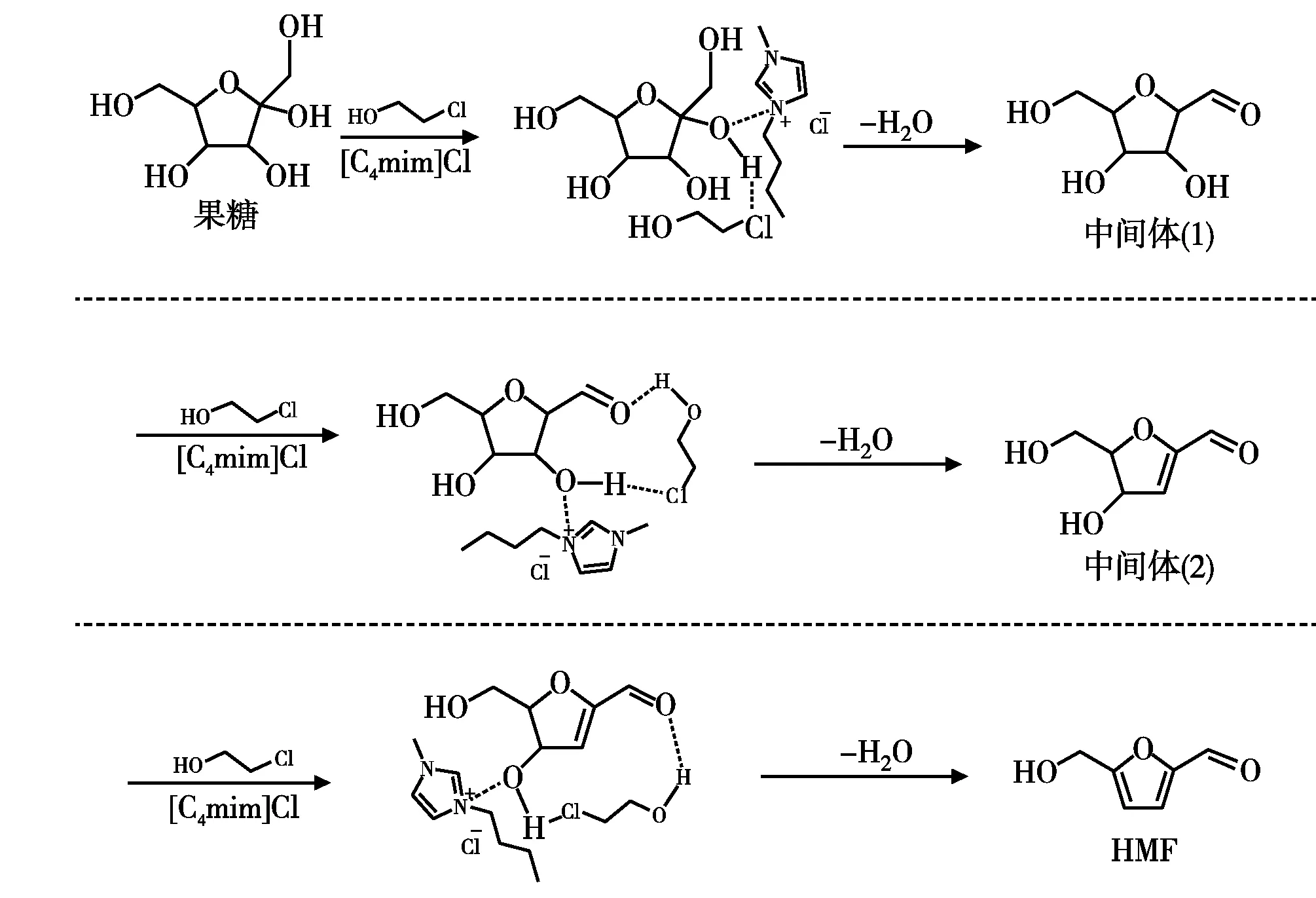
圖6 果糖脫水轉化假設機理
果糖在2-氯乙醇促進的離子液體反應體系中,與2-氯乙醇的氯基功能團和[C4mim]Cl中的咪唑陽離子通過氫鍵等分子間作用力相互作用,從而降低脫水反應的活化能[18]。在2-氯乙醇和[C4mim]Cl的共同(協同)作用下,首先脫除一分子
水形成中間體(1),隨后進一步脫除一分子水形成中間體(2),最后再經過脫水過程即形成目標產物HMF[19]。此外,[C4mim]Cl具有較強的捕水能力,在該反應體系中可以及時捕捉果糖脫除的水分子,穩定了HMF[7]。2-氯乙醇促進果糖脫水活化能的降低與[C4mim]Cl捕水能力的相互協同,共同促進果糖快速脫水生成HMF反應的進行。
3 結論
2-氯乙醇可有效促進果糖在[C4mim]Cl中非催化脫水反應形成HMF。較大的2-氯乙醇用量、較高的反應溫度、較長的反應時間均有利于果糖脫水反應的進行,且在溫和條件下果糖即可實現完全轉化,并有95%以上的HMF選擇性。在2-氯乙醇的促進作用下,果糖脫水轉化的活化能為48.3 kJ·mol-1,是果糖在[C4mim]Cl中溫和條件下脫水轉化形成HMF反應發生的前提。2-氯乙醇促進的果糖非催化脫水制備HMF反應體系的開發,對HMF的工業化生產具有極大的促進作用。

