犬心房肌細胞分離方法的改良及影響因素探討
王紅麗 李志強 范 平 張格格 郭玉君
心房疾病是一個日益嚴重的全球性問題。心房顫動(atrial fibrillation,AF)是最常見的心律失常之一,影響全球3300萬患者,在未來的30年預計其發生率將增加3倍[1]。目前藥物治療的效果不理想并且還有一定的不良反應,包括藥物引起的心律失常和心臟毒性[2]。目前藥物的有效性是有局限的,可能是由人們對心律失常復雜的病理生理學認識不完全所致[3]。隨著心臟電生理技術的發展尤其是膜片鉗技術在基礎領域中的廣泛應用,越來越多證據表明,心房顫動的發生與離子通道的功能和結構改變密切相關[4,5]。電生理檢測過程中由于完整心臟體積較大,導致電壓鉗實驗中不能充分控制膜電位。這種限制是分離單個心肌細胞技術發展的主要動力。闡明離子電流和細胞微結構的病理變化需要分離的單個心房肌細胞。目前關于分離成年犬單個心房肌細胞的方法比較的報道較少[6,7]。急性分離的細胞在結構和功能上都與活的生物體生理性特征相似,非常適合觀察細胞結構和細胞內分子精確定位的實驗,也經常用于細胞內Ca2+穩態、細胞力學和蛋白質生物化學的研究。心肌細胞急性分離技術方法至關重要,能夠保持心肌細胞在體內的功能和完整性。
因此,為了獲得穩定的心房肌細胞,本研究運用兩種不同的方法分離犬心房肌細胞,并從心房肌細胞成活率、細胞自主收縮、酶的使用量、酶消化時間和記錄起搏電流(If)等方面進行比較。筆者對整體心臟的結扎部位、灌流液成分、酶的選擇等方面進行改進,摸索出簡單、快捷的犬心房肌細胞分離方法,為研究心房肌細胞生理和病理特性提供了實驗材料。
材料與方法
1.實驗動物:普通級比格犬8條,雌雄不拘,體質量12~14kg,2歲,均購于新疆醫科大學實驗動物中心 [SCXK(新)2016-0001),課題實驗設計、實驗方案及具體實施步驟已經新疆醫科大學第一附屬醫院動物倫理學委員會批準、審核,審批號為IACUC-20170210-03。實驗實施推進過程嚴格按照美國國立研究機構設立的實驗動物使用和護理指南進行。犬植入起搏器,持續左心耳起搏8周,構建慢性心房顫動模型。
2.主要試劑與儀器:Ⅱ型膠原酶(Worthington),蛋白酶(Protease,美國Sigma公司),牛血清白蛋白(bovine serum albumin,BSA,美國Sigma公司),多導電生理儀(LEAD-7000),多功能監護儀(BeneviewT5),動物實驗用的埋藏式起搏器(上海復旦大學電子生物工程有限公司)光學倒置顯微鏡(日本Olympus公司)。
3.實驗前準備:無鈣臺式液(NaCl 140mmol/L,KCl 5mmol/L,MgCl2·6H2O 1mmol/L,HEPES 10mmol/L,Glucose 10mmol/L)。含鈣臺式液(NaCl 140mmol/L,KCl 5mmol/L,MgCl2·6H2O 1mmol/L,HEPES 10mmol/L,Glucose 10mmol/L,CaCl21.8mmol/L)。高鉀臺式液(NaC1 140mmol/L,KC1 15mmol/L,MgCl2·6H2O 1mmol/L,HEPES 10mmol/L,Glucose 10mmol/L,CaCl21.8mmol/L)。KB液(細胞保存液K-Glutamate 120mmol/L,KCl 10mmol/L,KH2PO410mmol/L,MgSO41.8mmol/L,K-EGTA 0.5mmol/L,Taurine 10mmol/L,HEPES 10mmol/L,Glucose 20mmol/L,BSA 0.2%),以上溶液用NaOH調pH值至7.3~7.4。酶液(改良方法):取150ml無鈣液,加入濃度為0.5%的Ⅱ型膠原酶、0.01%Protease和0.1%BSA。酶液(傳統方法):取250ml無鈣液加入Ⅱ型膠原酶(125U)和0.1%BSA。細胞外液(NaCl 140mmol/L,KCl 5mmol/L,CaCl21.8mmol/L,MgCl21mmol/L,BaCl21mmol/L, HEPES 10mmol/L,Glucose 10mmol/L;用NaOH調pH值至7.4)。細胞內液(K+-ATP 5mmol/L,KCl 50mmol/L,MgCl21mmol/L,HEPES 10mmol/L,EGTA 2mmol/L;用KOH調pH值至7.2)。
4.心肌細胞分離方法:改良方法:成年雄性犬稱重后,用3%戊巴比妥鈉麻醉,靜脈給肝素(1000U/kg),開胸取心臟,放入4℃氧飽和的高鉀液。在主動脈冠狀動脈竇口用高鉀液反復沖洗去除心腔及血管內的殘血,隨后從左前旋支插入自制導管,剪去右心房和左右心室以及室間隔等其他組織,只保留左右心房和心耳(目的是分離心房肌),手術線縫合固定。心臟懸掛于Langendorff灌流,給予30ml/min的含鈣液灌流。在各個滲水點用手術線結扎,直到肉眼看不見滲水點為止,此時可見左心耳,左心房充盈。無鈣臺式液繼續灌流,灌流量根據所保留的心臟組織大小而定。酶液充盈于整個心臟時,流出的酶液循環灌流約35~50min,剪取小部分組織在KB液中輕輕搖動,組織消失,顯微鏡觀察是否有細胞,有大量的細胞時終止消化。收集上清液,800r/min離心5min,去酶液。加入新的KB液保存細胞。傳統方法:取心臟同上,迅速放入4℃肝素鹽水反復沖去除心腔內殘血,心臟懸掛于Langendorff 灌流[8,9]。一個通道灌注高鉀液,使心臟停止機械搏動,沿主動脈將主動脈切開。自制的導管通過主動脈左冠狀動脈竇插入左冠狀動脈回旋支內,竇口處縫合固定心臟。沿房室溝分別結扎心外膜冠狀動脈右室支、左前分支及回旋支的心室各分支,根據結扎點剪去左、右心室組織,剪完后仍有多處部位漏液體,需要逐一結扎,直至肉眼看不到漏液點。另一個通道灌流無鈣臺式液5min,去除殘留的殘血及高鉀液。酶液循環灌流45~60min左右至心肌組織松弛呈溶膠狀。顯微鏡觀察灌流液內可見數個心肌細胞時終止消化,無鈣臺式液灌流5min,沖洗殘余的酶液。疏松的心房肌放入無鈣臺式液中切碎,用寬口吸管勻速吹打多次。細胞的懸濁液用200目金屬濾網過濾至細胞保存液中(圖1)。

圖1 兩種不同方法分離心房肌細胞的步驟A.傳統方法;B.改良方法
5.細胞存活率的檢測:取心肌細胞懸液90μl加入0.4%臺盼藍染液10μl均勻混合,已混勻的細胞懸液沿著蓋玻片邊緣滴入,將計數板放置于倒置相差顯微鏡下觀察計數,未著上色折光性強的圓形細胞為活的心肌細胞,染成藍色的為死細胞。隨機取4個視野進行細胞計數,計數心肌細胞的存活率(%)=活細胞數/(活細胞數+死細胞數)×100%,重復計數計算5次。
6.膜片鉗全細胞記錄:選取紋理清晰、桿狀、立體感和折光性強的細胞在室溫下進行實驗,將細胞加入細胞池中,貼壁后開始進行實驗。膜片鉗記錄兩種方法分離細胞的起搏電流,采用EPC10放大器和Pulse軟件進行記錄和數據分析。細胞外液持續恒溫灌流細胞池。充滿電極內液后電極阻抗為 2~4MΩ,使電極與細胞表面形成高阻封接后破膜,形成全細胞記錄模式,記錄全細胞If電流,觀察左心房細胞的電生理特性。

結 果
1.犬心房肌細胞形態學:心房肌細胞在顯微鏡下觀察,改良方法獲得單個細胞呈細桿狀,狹長,細胞膜表面光滑,橫紋清晰,立體感和折光性強,在靜息狀態下,細胞不發生自發性收縮;傳統方法分離的單個細胞呈桿狀或矩形,橫紋清晰,立體感不強多呈扁平狀,在靜息狀態下,細胞易發生自發性收縮,導致細胞死亡。細胞發生自發收縮,呈團狀或橢圓形,成為死細胞。于細胞灌流槽底部的貼壁細胞,呈靜息狀態,結構及橫紋均清晰,不發生自發性收縮,適用于膜片鉗實驗(圖2)。
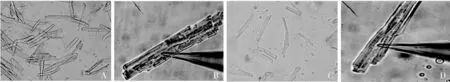
圖2 兩種方法分離犬心房肌細胞A.改良方法分離細胞(×200);B.改良方法分離單個細胞(×400);C.傳統方法分離細胞(×200);D.傳統方法分離單個細胞(×400)
2.細胞的存活情況:改良方法分離的細胞存活率為83.33%±2.87%,室溫靜置1h后加入含1.8mmol/L鈣的細胞外液靜置1h后,細胞自發收縮率為20.17%±1.42%;傳統方法分離的細胞形態與上述相似,但細胞成活率約70.67%±2.88%,加鈣靜置1h后,27.83%±1.01%的細胞發生持續的自發收縮,死亡細胞過多,與改良后的方法比較貼壁細胞較少,膜片鉗實驗操作基本可行。兩種方法比較,改良方法的細胞存活率顯著高于傳統方法 (P<0.05),改良方法的細胞自發收縮率顯著低于傳統方法 (P<0.05,圖3)。

圖3 兩種方法分離犬心房肌細胞細胞存活與改良方法比較,*P<0.05
3.酶的使用量和酶消化時間:單個細胞分離過程中都需要使用Ⅱ型膠原酶。兩種分離方法使用酶的量和酶消化時間是不同的,改良方法酶使用量為55.55±1.33mg,酶消化時間為38.50±2.02min;傳統方法酶使用量為72.50±0.99mg,酶消化時間為51.67±1.52min;改良方法使用膠原酶Ⅱ和酶消化時間均顯著少于傳統方法(P<0.05,圖4)。

圖4 分離犬心房肌細胞細胞酶使用情況與改良方法比較,*P<0.05
4.全細胞模式下記錄心肌細胞起搏電流:鉗制電位-40mV,給予指令測試電位逐漸降至-140mV,階躍10mV,鉗制時間2000ms。兩種方法每次分離的細胞中記錄同樣多細胞數,成功記錄電流的細胞數不同。并經χ2檢驗得出χ2值為23.69,P=0.000,改良方法中58.33%的細胞記錄到起搏電流,傳統方法中有32.78%的細胞記錄到電流,詳見表1。改良方法分離的細胞記錄的電流大并穩定,而傳統方法分離細胞記錄電流相對較小且不穩定(圖5)。

表1 兩種方法分離細胞和記錄電流的比較
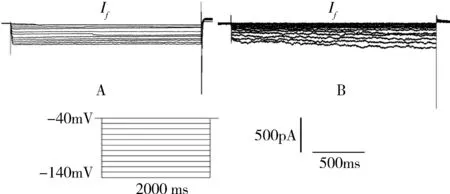
圖5 兩種方法記錄到細胞起搏電流A.改良方法記錄電流;B.傳統方法記錄電流
討 論
離子通道的異常可誘發心房顫動。心臟信號電傳導主要利用鉀、鈉和鈣離子通道使得心肌細胞膜兩邊的電壓保持動態平衡,如果失去這種平衡就易發生心律失常疾病。單個心肌細胞在離子通道疾病相關的研究中日益重要[10]。早期報道采用心臟剪切成小組織塊后進行消化分離單個心肌細胞,但現在普遍采用Langendorff灌流急性分離大型動物單個心肌細胞的方法[11~15]。為了能夠獲得高質量的心肌細胞,其分離技術方法非常關鍵。本研究分離心房肌細胞的方法是在本實驗室原有的方法上做了部分改進[8,9]。
兩種方法的不同,主要是灌流溶液前心臟的處理方式,灌流溶液順序、消化酶的選擇,詳見表2。整個實驗過程Langendorff 灌流系統穩定,兩種方法在相同的水質、 pH值、溫度條件下進行。

表2 兩種方法的比較
取心臟時間到膠原酶灌流之間時間越短,細胞狀態越好[8,9]。改良方法先進行組織的修剪,不用自制的托盤器,因組織小而減少試劑(灌流液)的使用、節約灌流的時間及結扎時間,可以縮短前期處理的時間保證細胞處于良好的狀態。鈣離子可以使心臟跳動,所以用含鈣臺式液進行灌流有效地去除心腔及血管內積血。而細胞內鈣超載,細胞持續收縮,細胞的能量大量消耗而死亡,所以含鈣臺式液灌流后快速用無鈣臺式液灌流去除鈣離子[16]。溫度對于酶消化過程非常重要,尤其心臟表面的溫度是心臟灌流是否良好的重要指標。酶消化法分離細胞過程中最佳溫度在37℃左右,絕大多數實驗室都是在35~37℃條件下進行酶解的[17]。Langendorff 裝置的核心是多根多夫線圈,外護套由設置與水浴鍋相連從而進行加熱。Langendorff裝置做了輕微的改變,本實驗原有方法需要兩個灌流通道,一個灌流高鉀溶液,一個灌流酶液,改成一個灌流通道,流通時間變短,可以更好地保持通道內的溫度,保證心臟表面的溫度。膠原酶消化組織的能力是眾所周知的,有研究發現,蛋白酶有助于心肌細胞的分離。分離細胞過程中常加入牛血清白蛋白,主要是維持細胞的滲透壓和防止水腫。本實驗參考 Pacioretty等[18]應用的方法,酶液使用膠原酶Ⅱ、蛋白酶和牛血清白蛋白。蛋白酶和牛血清白蛋白兩種試劑可以保護細胞膜,減輕膠原酶對細胞膜的損傷。剪碎組織獲得的細胞中有大量的細胞碎片,影響細胞成活率以及離子電流的記錄,經過改進后有效減少細胞碎片,從而獲得質量較好的單個心房肌細胞。
綜上所述,兩種方法分離犬心房肌細胞比較,改良方法對實驗過程進行優化和改良,獲得高質量、高數量的單個心房肌細胞。該方法操作簡便有效,重復性強,總體時間縮短,節約試劑,細胞成活率高,細胞形態完整,進行電流的記錄比較完整,更適合于膜片鉗實驗對離子通道疾病的研究,同時也適合其他大型動物分離心肌細胞。

