營養性維生素D缺乏
武繼宏 毛桂龍
(北京清華長庚醫院,北京 102218)
1 概述
營養性維生素D缺乏是引起佝僂病的最主要原因,在我國維生素D缺乏性佝僂病仍在嬰幼兒中較常見。維生素D缺乏在20世紀已被列為國際公共衛生問題而受到醫學界的重視,并制定和積極推進對嬰幼兒補充維生素D的干預措施。目前,營養性維生素D缺乏性佝僂病的發病率已明顯降低,但在發展中國家仍然是一個重要的問題。其發病特點是,在不同年齡段患病率不同,嬰幼兒特別是小嬰兒、學齡兒童是維生素D缺乏的高危人群;在不同地區兒童患病率也不同,北方佝僂病患病率高于南方。近年,隨著嬰幼兒兒童保健工作的積極開展,我國營養性維生素D缺乏性佝僂病發病率已呈現逐年降低趨勢,發病程度也趨向輕度。
2 定義
維生素D是一組類固醇衍生物,屬于脂溶性維生素,主要包括維生素D2(麥角骨化醇)和維生素D3(膽骨化醇)。維生素D缺乏會引起體內鈣、磷代謝失常,導致長骨干骺端和骨組織礦化不全,以致骨骼發生病變。佝僂病是維生素D缺乏導致骨骼病變的全身慢性營養性疾病,也是維生素D缺乏的最嚴重階段。
3 維生素D的來源
維生素D2主要存在于植物中,維生素D3是由人體或動物皮膚中的7-脫氫膽固醇經與日光中紫外線光化學作用轉變而來,也是人體內維生素D的主要來源。嬰幼兒體內維生素D來源主要有以下三種途徑。
3.1 母體-胎兒的轉運 胎兒主要在孕后期通過胎盤從母體獲得少量維生素D。
3.2 腸道吸收 天然食物中、母乳中維生素D含量均較少,一般配方奶中均含有適量的維生素D,故以配方奶喂養為主的嬰兒一般無需額外補充維生素D。
3.3 皮膚光照合成 是人體維生素D的主要來源。
4 維生素D的代謝及生理功能
4.1 代謝途徑 維生素D2與維生素D3在人體內都是沒有生物學活性的,維生素D2通過小腸淋巴管吸收,維生素D3可直接吸收入血,它們入血后與血漿中的維生素D結合蛋白(DBP)結合后轉運到肝臟,然后在肝臟經第一次羥化,生成25-(OH)D。25-(OH)D是維生素D在人體血液中的主要形式,其后再與α-球蛋白結合轉運到腎臟,完成第二次羥化,生成1,25-(OH)2D,1,25-(OH)2D是維生素D的主要活性形式。
4.2 生理功能 1,25-(OH)2D主要與DBP結合發揮其生物學效應,它被認為是一種類固醇激素,通過其核受體發揮調節基因表達的作用。維生素D已被證明是體內鈣內穩態的重要生物調節因子之一,是維持體內鈣、磷代謝平衡的主要激素之一,主要通過作用于其靶器官(腸、腎、骨)而發揮其抗佝僂病的主要生理功能。另外,隨著近年來對維生素D研究的深入,發現維生素D具有廣泛的生理作用,維生素D參與全身多種細胞的增殖、分化和凋亡,同時維生素D缺乏與人體免疫功能異常、心血管疾病、代謝性疾病、自身免疫性疾病、腫瘤等均密切相關。
5 維生素D代謝的調節
5.1 自身反饋作用 維生素D的合成與分泌受機體血液25-(OH)D濃度的反饋調節,當生成的1,25-(OH)2D的量達到一定水平,也可抑制25-(OH)D在肝內的羥化及1,25-(OH)2D在腎臟的羥化過程。
5.2 血鈣、磷濃度與甲狀旁腺、降鈣素調節 腎臟生成1,25-(OH)2D間接受血鈣濃度調節。當血鈣過低時,甲狀旁腺激素(PTH)分泌增加,PTH刺激腎臟1,25-(OH)2D合成增多,從而激活破骨細胞活性,提升血鈣升高。反之血鈣過高時,降鈣素(CT)分泌,抑制腎小管羥化合成1,25-(OH)2D。另外,血磷降低可直接促進1,25-(OH)2D的增加。
6 維生素D缺乏的診斷
6.1 高危因素
6.1.1 胎兒期儲存不足 母親妊娠期,特別是妊娠后期維生素D貯存不足、母親慢性疾病、胎兒早產、雙胎等均是導致新生兒體內維生素D貯存不足的原因。
6.1.2 日照不足 是造成兒童維生素D缺乏的最主要高危因素。現今兒童普遍存在戶外活動不足,加上建筑物遮擋、大氣污染等導致能接觸到的紫外線減少,以及衣服遮擋等都限制了由陽光照射產生足量的維生素D。
6.1.3 飲食攝入不足 母乳中維生素D含量較低,單純母乳喂養的患兒容易出現維生素D缺乏。另外,牛乳、羊乳、禽蛋黃、肉類等維生素D含量均較低,谷類、蔬菜、水果中幾乎不含維生素D。天然食物中只有深海魚的肝臟中維生素D含量較豐富,故多數兒童攝入維生素D均存在不足。
6.1.4 生長速度過快,需要增加 早產、雙胎兒生長發育快,需要更多的維生素D,而體內貯存不足,如得不到及時補充,則維生素D缺乏越發加重。嬰兒早期生長速度較快,同樣易出現維生素D缺乏。
6.1.5 疾病及藥物影響 胃腸道疾病影響消化吸收功能,導致維生素D吸收不良,慢性肝臟疾病可阻礙維生素D羥化。另外,一些抗結核藥及抗癲癇藥物可加速1,25-(OH)2D的分解,糖皮質激素也有對抗維生素D對鈣的轉運功能。
6.2 臨床表現
6.2.1 輕度維生素D缺乏 佝僂病早期,可無特異性表現,但可出現低鈣性抽搐、生長損害、哭鬧、易激惹等,少數也可出現骨折風險增加、肌肉疼痛等。另外可以出現免疫功能異常、急性感染易感性增加,自身免疫病、神經肌肉疾病、腎臟疾病、皮膚疾病、腫瘤、心血管疾病等易感性增加。
6.2.2 維生素D缺乏性佝僂病 是維生素D缺乏的最嚴重階段,發病高峰在3~18月齡之間。本病的發生發展是一個連續過程,依病變程度可分為早期、活動期、恢復期和后遺癥期。
6.2.2.1 早期(初期) 多見于<6個月,特別是<3個月的小嬰兒。主要表現為夜驚、易激惹、多汗、搖頭、枕禿等非特異性神經興奮性增高癥狀。此期多無骨骼病變,實驗室檢查可發現血25-(OH)D降低,PTH升高,血鈣、血磷降低,堿性磷酸酶正常或稍高。骨X線長骨干骺端無異常或見臨時鈣化帶模糊變薄、干骺端稍增寬。
6.2.2.2 活動期(激期) 早期維生素D缺乏未得到及時糾正發展所致,常見于3個月至2歲嬰幼兒,骨骼體征:<6月齡嬰兒,可見顱骨軟化(乒乓球感);>6月齡嬰兒,可見方顱、手(足)鐲、肋串珠、肋軟骨溝、雞胸、O型腿、X型腿等。實驗室檢查:血鈣、血磷多降低,堿性磷酸酶增高,血25-(OH)D、1,25-(OH)2D均明顯降低。骨X線長骨干骺端臨時鈣化帶模糊消失,干骺端變寬,呈毛刷狀或杯口狀,骨骺軟骨盤加寬>2 mm。
6.2.2.3 恢復期 早期或活動期經日光照射或維生素D治療后癥狀消失,體征逐漸減輕或恢復。血鈣、血磷堿性磷酸酶、25-(OH)D逐漸恢復正常。骨X線可見臨時鈣化帶重現、增寬、密度增加,骨骺軟骨盤<2 mm。
6.2.2.4 后遺癥期 經治療或自然恢復,癥狀消失,但因前期骨骼改變較嚴重,不能完全恢復,留有不同程度的骨骼畸形,多見于>3歲的兒童,骨X線及血生化檢查均正常。另外,佝僂病還可根據病情輕重可分為輕度、中度、重度。
6.3 輔助檢查
6.3.1 血清25-(OH)D水平 是反應維生素D營養狀況的最佳指標。目前建議兒童血25-(OH)D的適宜濃度為>75 nmol/L(30 ng/mL),在維生素D的補充治療的過程中,監測血中25-(OH)D濃度也應達到此值為宜。血中維生素D濃度對應營養狀況見表1。
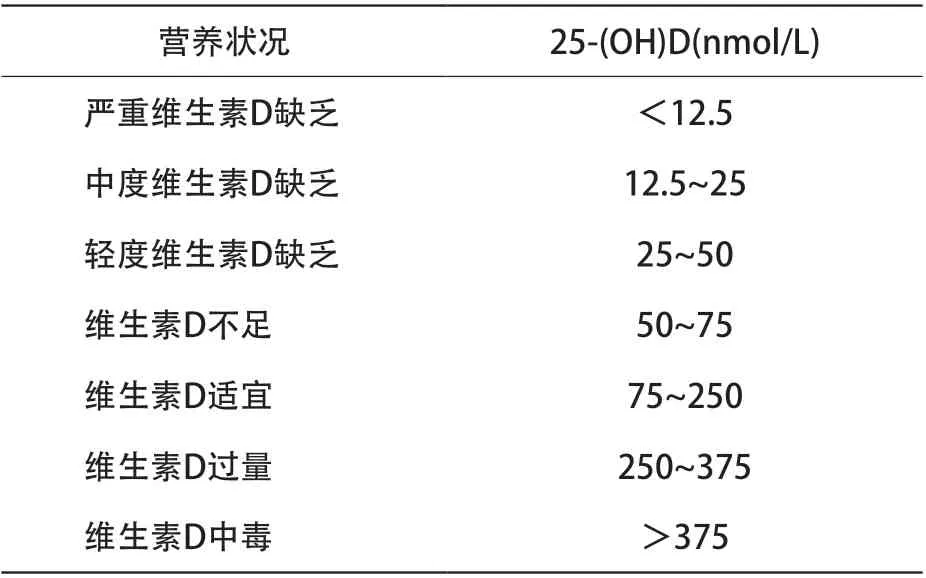
表1 維生素D缺乏判定標準
6.3.2 影像學檢查 長骨骨骺端佝僂病的X線改變對于佝僂病的診斷始終具有決定意義,但是骨骼鈣丟失>30%才能在X線上有所表現。對于處于佝僂病早期的患兒,骨X線片多不能有明顯改變。其他各期表現見佝僂病各期癥狀描述。
6.4 其他 維生素D缺乏及佝僂病的診斷,需結合高危因素、臨床表現、實驗室檢查證據綜合分析才能作出。
需要強調的是:①佝僂病的一般癥狀,如多汗、易激惹、夜驚、枕禿等均非本病特異性癥狀,不可單憑這些癥狀進行診斷;②佝僂病的骨骼改變尚無統一的診斷說明,癥狀+體征的診斷也有擴大患病率的可能;③兒童血生化中血清鈣、磷、堿性磷酸酶指標,可受兒童生長發育不同階段生理性改變影響,也可受一些疾病的影響,其結果作為診斷依據還需結合這些情況綜合分析;④骨堿性磷酸酶(BALP)是對骨鈣化障礙敏感性較高的指標,從理論上可反映骨生成速率,但BALP的影響因素也較多,目前暫不作為維生素D缺乏及佝僂病的診斷指標;⑤因佝僂病早期長骨干骺端X線改變常不明顯,但骨礦物質含量(骨密度、骨成分分析)改變敏感性較高,可作為臨床診斷的一項輔助參考;⑥X線拍照技術、投射角度、X線的質量、患者活動干擾、閱片經驗等也是影響診斷結果的重要因素。
7 鑒別診斷
佝僂病的一般癥狀,如多汗、易激惹、夜驚、枕禿等多不具備特異性,需注意與可發生此類情況的其他疾病相鑒別,也應注意與兒童生長發育不同階段的正常生理過程相鑒別。另外,維生素D缺乏性佝僂病需與非維生素D缺乏性佝僂病、內分泌性疾病、骨代謝性疾病相鑒別,多需結合臨床表現及實驗室檢查數據。
8 維生素D缺乏的治療
治療的目的在于提高血清維生素D的水平,控制活動期,防治骨骼畸形。
8.1 一般療法 加強護理、合理飲食(增加富含維生素D飲食),堅持經常曬太陽(<6個月嬰兒避免直曬),保持一定的戶外活動時間。還需積極預防感染。
8.2 藥物療法 很多人將維生素D缺乏與鈣缺乏混為一談,認為維生素D缺乏性佝僂病是“缺鈣”引起,其實不然。人體內鈣磷平衡及代謝主要依靠維生素D的調節作用,當機體缺乏維生素D,即使體內有充足的鈣,也不能完成鈣磷的吸收及沉積,骨骼無法獲取生長所需的鈣磷而出現骨骼病變,故此時補充維生素D才是關鍵所在。
8.2.1 維生素D補充 維生素D缺乏及佝僂病的治療主要為維生素D補充治療,強調個體化治療,以口服為主。除糾正癥狀體征之外,還應根據不同年齡的維生素D需求,補足維生素D后,應繼續維持補充,以預防后期繼續缺乏。
根據2015年全國佝僂病防治協作組制定的《維生素D缺乏及維生素D缺乏性佝僂病防治建議》,對于0~18歲兒童維生素D缺乏者,維生素D補充方案:應采用口服維生素D2或D3,2 000~4 000 U/d,連服1個月后,改為400~800 U/d維持補充。建議治療過程中監測血清鈣、磷、堿性磷酸酶及25-(OH)D水平。對肥胖吸收不良綜合征和服用影響維生素D代謝藥物者,應采用大劑量維生素D(2~3倍劑量)治療。
對于口服困難或存在腹瀉等消化道問題影響吸收者,可采用大劑量突擊療法,維生素D 15~30萬U/次,肌內注射,1個月后再采用400~800 U/d維持補充。此法不宜應用于新生兒和小嬰兒。治療期間應注意監測患者的癥狀、體征、血液生化指標,如無改善應考慮其他疾病,還應警惕高鈣血癥、高鈣尿癥及維生素D過量。
8.2.2 其他治療
8.2.2.1 鈣劑補充 對于膳食鈣攝入相對不足時,在補充維生素D的同時,給予適量的鈣劑,對改善癥狀及促進骨骼發育是有益的。對于嬰兒,乳類即可作為優質的鈣營養來源。
8.2.2.2 微量營養素補充 維生素D缺乏性佝僂病多伴有鋅、鐵降低,也應適量的補充,有利于骨骼發育。
8.2.2.3 外科手術 對于嚴重的骨骼畸形者可采取外科手術矯正。
9 維生素D缺乏的預防
維生素D缺乏及佝僂病的發生與不良的生活方式和營養不均衡有密切關系。由于絕大多數嬰幼兒均存在維生素D輸入及光照不足的高危因素,故維生素D缺乏的預防就十分重要。做好維生素D的預防,可有效減少佝僂病的發生,減少骨骼畸形以及嚴重后遺癥的發生。這需要從母親懷孕開始一直到兒童嬰幼兒全期,對母親和嬰兒進行全程的干預及指導。要做到“抓早、抓小、抓徹底”。應對維生素D缺乏的預防保健知識進行充分宣傳。
9.1 胎兒期預防 孕婦應經常到戶外活動,多曬太陽;應保證一定量的攝入富含維生素D、鈣、磷和蛋白質等營養物質的食物;防治妊娠并發癥,對患有低鈣血癥或骨軟化癥的孕婦應積極治療;妊娠后3個月應補充維生素D,劑量800~1 000 U/d,同時服用鈣劑。如有條件,孕婦應監測血25-(OH)D水平,如提示缺乏,應及時給予維生素D制劑治療。
9.2 0~18歲兒童的預防
9.2.1 保障戶外活動 多曬太陽是預防維生素D缺乏及佝僂病最簡單有效的措施,應積極宣傳、廣泛推廣,但應“因時、因地、因人而異”。紫外線不能穿過玻璃,應保證兒童在戶外直接接觸陽關的時間。另外,接受陽光照射應逐漸增加皮膚暴露面積,暴露時間逐漸增多,逐漸達1~2 h/d。<6個月嬰兒應避免陽光直射。
9.2.2 維生素D補充 嬰兒出生后應該盡早開始補充維生素D。0~1歲的嬰幼兒應至少補充維生素D 400 U/d,≥1歲兒童攝入600 U/d。母乳或配方奶為主的嬰兒,一般不需加服鈣劑,但如有低鈣癥狀者,應適量補充鈣劑。
9.3 高危人群預防 早產兒、低出生體重兒、雙胎兒生后即應補充維生素D 800~1 000 U/d。連用3個月后改為400~800 U/d維持補充。對于肥胖兒童或服用影響維生素D代謝及吸收的藥物者,至少需補充2~3倍劑量的維生素D。此類患兒應根據醫生的指導進行預防。
10 維生素D過量及中毒
維生素D亦為脂溶性維生素,長期過量補充也可導致其在體內蓄積,導致過量或中毒。目前認為:血清1,25-(OH)2D>100 ng/mL(250 nmol/L)為維生素D過量,血清1,25-(OH)2D>150 ng/mL(375 nmol/L)為維生素D中毒。但此標準仍存在爭議。
維生素D過量主要造成高鈣血癥、高鈣尿癥、抑制中樞神經系統和異位鈣化。一般認為嬰兒 ≥2 000 IU/d長期服用,連續6個月,或2萬~5萬IU/d連續應用數周,或大劑量突擊療法,連續注射30~60萬IU,都可發生中毒。個別患兒對維生素D的敏感性特別高,較低的劑量也可發生中毒。
當過量或中毒發生時應立即停止服用維生素D,高鈣血癥應限制鈣攝入,避免含鈣飲食,低磷飲食。可采用口服氫氧化鋁等加速鈣的排泄,可給予激素、雙磷酸鹽等抑制鈣吸收,嚴重者可血液透析治療等。
故在維生素D缺乏的預防及治療過程中,應嚴格遵照科學地指導劑量進行,并在嬰幼兒的定期隨訪中進行評估,加強對家長的教育與指導,避免過量服用等情況發生。通常維生素D劑量建議不應超過以下劑量:6月齡以下≤1 000 U/d,6月齡~1歲者≤1 500 U/d,1~3歲者≤2 500 U/d,4~8歲者≤3 000 U/d,8歲以上者≤4 000 U/d。在使用大劑量或長期高劑量維生素D補充時,應監測血清1,25-(OH)2D和血鈣水平。當血鈣>3 mmol/L時,如大劑量使用維生素D,應高度懷疑維生素D中毒。

