繅絲蠶蛹與黃豆的納豆菌發酵上清液功能活性的比較
盧美杉,朱蓓薇,付云,劉小玲*
1(廣西大學 輕工與食品工程學院,廣西 南寧,530004) 2(國家海洋食品工程技術研究中心,遼寧 大連,116034)
我國繅絲蠶蛹資源豐富,年產量已達50萬t以上,具有較高的營養價值。蠶蛹干燥后蛋白質含量在40%左右,并且還富含多種維生素以及Fe、Zn、Se等微量元素[1-2]。作為優質蛋白質替代來源,蠶蛹也是最符合人體需要的氨基酸來源代表之一[3]。2004年,蠶蛹被衛生部批準為“普通食品管理的食品新資源”,也是其中僅有的昆蟲類原料。研究證實,蠶蛹具有抗腫瘤、抗氧化、降血壓、抗疲勞、預防肝損傷、延緩衰老等作用[4-5]。已有研究表明,蠶蛹的納豆菌發酵產物具有抗菌活性[6],但并沒有對其抗凝血和降血脂活性進行研究。
納豆菌是枯草芽孢桿菌的一個亞種,屬于益生菌[7]。本實驗發酵用納豆菌菌株為北京川秀科技生產的納豆菌凍干粉經活化后涂板得到,在其發酵過程中會生成納豆激酶等酶。因此,本研究采用納豆菌發酵蠶蛹粉,對發酵產物的纖維蛋白溶解率、ABTS自由基清除率、膽酸鹽結合率、以及抗凝血活性的4項指標進行分析,并同黃豆發酵液進行比較。本研究探討了蠶蛹替代黃豆進行納豆菌發酵的可行性,并期望提高繅絲副產物-蠶蛹的附加值和利用度。
1 材料與方法
1.1 材料與試劑
繅絲蠶蛹,廣西河池桑蠶基地;東北黃豆,南寧百貨;新鮮牛血漿采于西大動科學院健康成年牛。
種子培養基(g/L):蛋白胨10、牛肉粉30、葡萄糖10,調節pH至7.0。
黃豆培養基(g/L):黃豆凍干粉30、蔗糖10、KH2PO41、K2HPO42.5、 MgSO40.5。
蠶蛹培養基(g/L):蠶蛹凍干粉30、蔗糖10、KH2PO41、K2HPO42.5、MgSO40.5。
納豆菌,北京川秀科技;氨基酸標準品(優級純),上海哈靈生物科技;N,N,N′N′-四甲基乙二胺(生化級);納豆激酶標品(Nattokinase),和光純藥工業株式會社;纖維蛋白、凝血酶、水溶性VE、胃蛋白酶、胰蛋白酶、牛黃膽酸鈉、甘氨膽酸鈉、膽酸鈉,上海麥克林生物化學有限公司;枸櫞酸鈉,國藥集團化學試劑;其他試劑均為國產分析純。
1.2 儀器與設備
真空冷凍干燥機,北京博醫康實驗儀器有限公司;RCT basic磁力攪拌器,德國IKA公司;RE-52旋轉蒸發器,上海亞榮生化儀器廠;L-8900氨基酸分析儀,日本日立公司;Bio-Rad ChemiDoc XRS凝膠成像儀,美國伯樂公司;CR21N高速冷凍離心機,日立公司;K9840自動凱氏定氮儀,山東海能科學儀器有限公司;UV6100紫外可見分光光度計,上海美譜達公司;SUNRISE酶標儀,帝肯(上海)貿易有限公司;T25高速分散均質機,德國IKA公司;CS-5100全自動凝血分析儀,日本Sysmex。
1.3 蠶蛹基礎組成成分分析
分別將新鮮的繅絲蠶蛹與浸泡過夜的黃豆去皮勻漿,-50 ℃下采用真空冷凍干燥機處理48 h將其凍干成粉。
冷凍干燥后的蠶蛹粉分別參照GB5009.3—2016、GB5009.4—2016、GB5009.6—2016、GB5009.5—2016 對水分、灰分、脂肪、蛋白含量進行檢測。
蛋白含量的計算參考國標中的計算公式,其中蛋白質折算系數定為6.25(其他食品)。
1.4 氨基酸組成與總氨基酸含量的測定
參考GB/T5009.124—2016氨基酸的檢測方法進行測定。
1.5 蠶蛹蛋白聚丙烯酰胺凝膠電泳
前處理參考李健等與穆利霞等[8-10]的方法提取蛋白。得到的蛋白用蒸餾水清洗后,4 000 r/min離心5 min,至上清液澄清無味,經真空冷凍干燥獲得淡褐色蠶蛹蛋白粉。對該蛋白進行SDS-PAGE分析(濃縮膠質量濃度50 g/L、分離膠質量濃度12 g/L,電壓90 V),1.5 h后經考馬斯亮藍染色,置于凝膠成像系統中進行分析[11]。
1.6 納豆菌的活化及生長曲線測定
將購得的納豆菌粉活化后稀釋涂板,挑單菌落37 ℃下在LB液體培養基中培養24 h,將菌液以體積比1∶1與40%的丙三醇混合,置于-80 ℃保存。
以1%的接種量將納豆菌接種到種子培養基培養,37 ℃、160 r/min條件下培養24 h進行一次活化。分別取1 mL活化后的菌液,加入7瓶100 mL種子培養基中37 ℃、160 r/min條件下培養24 h(此過程即為二次活化),每隔4 h從培養箱中取出1瓶培養液,測定菌液的吸光度OD600, 并繪制納豆菌在種子培養基中的生長曲線。
取二次活化后的菌液以1%的接種量接種到發酵培養基中,37 ℃、160 r/min條件下培養32 h,每隔8 h取出1瓶黃豆發酵液,1瓶蠶蛹發酵液,測定菌液的吸光度OD600,并繪制納豆菌在不同發酵培養基中的生長曲線。
1.7 納豆菌不同發酵液的活性分析
1.7.1 發酵液的制備
取二次活化生長穩定期的納豆菌液以體積比1∶100 加入新鮮蠶蛹培養基、煮熟蠶蛹培養基、黃豆培養基中(新鮮蠶蛹培養基中蠶蛹粉進行紫外滅菌,剩余成分與其他2種培養基一同121 ℃、20 min滅菌),恒溫搖床37 ℃、160 r/min發酵。發酵時間分別為8、16、24、32 h。將發酵液在4 ℃,9 000 r/min的條件下離心,得到上清液取部分直接測定納豆激酶酶活,其余置于-20 ℃存放,用于其他指標測定。本文后面出現的CSC(cooked silkworm chrysalis)、FSC(fresh silkworm chrysalis)、CSB(cooked soybean)分別指煮熟蠶蛹納豆菌發酵液、新鮮蠶蛹納豆菌發酵液、黃豆納豆菌發酵液。
1.7.2 納豆激酶酶活的測定
采用纖維蛋白降解法測定納豆激酶活[12-14]。將0.4 mL的纖維蛋白原溶液(7.2 g/L)和1.5 mL的Tris-HCl(0.050 mol/L,pH 7.8)混合并在37 ℃下溫育5 min;再向其中加入0.2 mL凝血酶(10 U/mL),37 ℃下溫育10 min,得到纖維底物溶液。加入0.1 mL發酵液在37 ℃下孵育60 min。每20 min搖動混合溶液。孵育后加入2 mL三氯乙酸(trichloroacetic acid,TCA)溶液(0.2 mol/L)終止反應。作為陰性對照,將纖維底物溶液37 ℃溫育60 min后,將0.1 mL發酵液和2 mL TCA溶液(0.2 mol/L)加入其中。將樣品以6 700 r/min離心15 min,并測量275 nm處的吸光度。1個單位的納豆激酶活性(FU)定義為1 min吸光度增加0.01的量。陽性對照為用生理鹽水溶解的不同濃度梯度的納豆激酶標品(0.02、0.01、0.005、0.002 5 g/mL)。
1.7.3 ABTS自由基清除活性的測定
參考DAI等與王立博等的方法測定ABTS自由基的清除率[15-17]。將7.4 mmol/L ABTS 0.2 mL 與2.6 mmol/L K2S2O80.2 mL混合后置于室溫黑暗處12 h,用pH 7.4的磷酸鹽緩沖液稀釋40~50倍,直至OD734達到0.7±0.02,得到ABTS工作液。取3 mL ABTS工作液加200 μL 10倍稀釋后的發酵液充分搖勻,靜置6 min,測定734 nm處的吸光值。空白對照為PBS緩沖液,陽性對照為20 mg/mL Trolox。ABTS自由基清除率的計算如公式(1)所示:
(1)
式中:A0為空白對照在734 nm處的OD值;A為發酵液在734 nm處的OD值。
1.7.4 降血脂活性的測定
1.7.4.1 三種膽酸鹽標準曲線的繪制
用0.1 mol/L,pH 6.3的磷酸緩沖溶液配制0.3 mmol/L牛磺膽酸鈉、甘氨膽酸鈉、膽酸鈉溶液定容至100 mL,參考劉山等、王靜輝等的方法[18-19]繪制出3種膽酸鹽的標準曲線,經處理得到牛黃膽酸鈉、甘膽酸鈉、膽酸鈉的線性回歸方程分別為:y=0.161 7x+0.074 2,R2=0.998 4;y=0.186x+0.074 6,R2=0.999 4;y=0.202 6x+0.077 6,R2=0.999。
1.7.4.2 發酵液體外膽酸鹽結合率的測定
參考于美匯等的方法[20-21],用磷酸緩沖溶液配制10 mg/mL胃蛋白酶、胰蛋白酶。取2 mL發酵液,再向其中加入1 mL 0.01 mol/L的鹽酸溶液和3 mL 10 mg/mL的胃蛋白酶,模擬胃環境,在37 ℃下恒溫振蕩1 h;取出后加入4 mL胰蛋白酶,并用0.1 mol/L的NaOH溶液調節pH至6.8~7.0,模擬腸道環境,在37 ℃下恒溫振蕩1 h;處理后的溶液分別加入4 mL 0.3 mmol/L牛磺膽酸鈉、甘氨膽酸鈉、膽酸鈉溶液中,在37 ℃下恒溫振蕩1 h后轉移至離心管,在4 000 r/min下離心15 min,收集上清液進行下一步比色實驗,陽性對照為10 mg/mL考來烯胺。
向2.5 mL上清液中加入7.5 mL質量分數60%H2SO4溶液,將具塞試管置于70 ℃條件下水浴20 min,然后取出冰浴至冷卻,在374 nm測吸光度OD值并通過標準曲線計算出樣品溶液中各膽酸鹽的濃度,從而計算出發酵液對3種膽酸鹽的結合率。膽酸鹽結合率的計算如公式(2)所示:
(2)
式中:b為3種膽酸鹽標準曲線的截距;k為3種膽酸鹽標準曲線的斜率;OD374為樣品在374 nm處的吸光度。
1.7.5 抗凝血活性的測定
參考李巖等[22]、王城的方法[23],取健康牛新鮮血液與100 mmol/L枸櫞酸鈉按體積比9∶1混勻,3 000 r/min離心10 min,收集離心上層液體。將其分裝于1 mL離心管中,冷凍保藏。實驗時37 ℃預熱,取發酵液分別與待測血漿按體積比1∶4混合,用全自動血凝儀進行抗凝血4項指標的檢測,以肝素鈉作為陽性對照。
1.8 數據統計與分析
所有實驗均重復3次,實驗所得數據運用SPSS進行差異顯著性分析。
2 結果與分析
2.1 蠶蛹粉基礎成分含量
蠶蛹凍干粉的基礎成分如表1所示。蠶蛹主要成分為蛋白質和脂肪,質量分數分別為46.68%、35.74%。其蛋白質含量與黃豆中的蛋白質含量較為接近,脂肪含量明顯高于黃豆[24]。這表明,蠶蛹作為一種蛋白和脂肪含量較高的低值副產物,具有潛在的替代納豆加工制品原料的利用價值。

表1 蠶蛹凍干粉的主要成分Table 1 Basic ingredients of silkworm powder
注:*其他可能包含糖類和色素類等雜物質,其質量分數通過減量法計算
2.2 蠶蛹氨基酸組成與總氨基酸含量
蠶蛹凍干粉氨基酸組成如表2所示。由表2可知,其主要含有17種游離氨基酸,其中谷氨酸的質量分數最高4.98%、其次是天冬氨酸4.03%,質量分數最少的半胱氨酸,僅占0.28%。總氨基酸質量分數為36.23%,與含有43%蛋白的豆粕中的氨基酸分布幾乎一致[25]。

表2 蠶蛹凍干粉的氨基酸組成Table 2 Amino acid composition of silkworm powder
2.3 蠶蛹蛋白組分分子質量
蠶蛹凍干粉脫脂后,采用堿溶酸沉法進行蛋白質的提取。提取的蛋白質的聚丙烯酰胺凝膠電泳圖如圖1所示。根據Marker分子量Mr的lg值與遷移距離d可以得到線性回歸方程為lgMr=-0.124 9d+2.071,根據此方程對分子質量進行計算。電泳顯示,蠶蛹蛋白中,分子質量30~34 kDa的蛋白組分相對占比最多,此外,還含有74、66、52 kDa的組分,以及極少量14 kDa的蛋白組分。整體與黃豆的蛋白組分分子質量相比較小[26],更易被分解成小肽,在發酵過程中更容易產生具有功能活性的多肽。

1~4分別表示蠶蛹總蛋白的上樣質量濃度為10、5、2.5和1.25 mg/mL
圖1 蠶蛹蛋白相對分子質量分布
Fig.1 Molecular weight of silkworm pupa protein
2.4 納豆菌的發酵生長曲線
納豆菌在種子培養基中生長曲線如圖2所示,在黃豆和蠶蛹培養基中生長曲線如圖3所示。由圖2可知,納豆菌在種子培養基中0~8 h為快速生長期,8~20 h趨于平穩即菌體活力穩定,24 h后開始下降,所以取20 h的菌液作為發酵用菌液。由圖3可知,在2種發酵培養基中,0~8 h為納豆菌生長旺盛期,8~32 h活菌數繼續緩慢遞增,趨于平穩。根據圖3結果,后續實驗將采用蠶蛹及大豆32 h的發酵液進一步比較他們的功能活性差異。
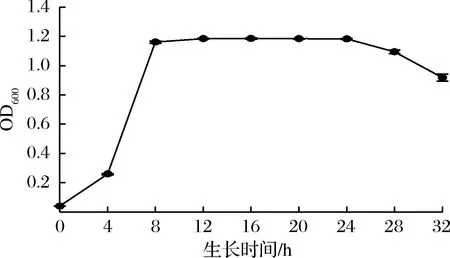
圖2 納豆菌在種子培養基中的生長曲線
Fig.2 Growth curve of natto bacteria in basic culture medium

圖3 納豆菌在2種不同發酵培養基中的生長曲線
Fig.3 Growth curve of natto bacteria in two different fermentation mediums
2.5 不同發酵液納豆激酶酶活的比較
不同發酵液的納豆激酶酶活如圖4所示。由圖4可知,隨發酵時間延長,3種發酵液的納豆激酶活力均呈現提升,其中8~16 h時,納豆激酶酶活變化不顯著,處于平臺期。發酵16 h后,發酵液納豆激酶酶活進一步提高。3種發酵液中,FSC的納豆激酶酶活始終最大,CSB納豆激酶在發酵過程中呈現線性遞增,而CSC增長緩慢。32 h時,3種發酵液中的納豆激酶酶活均達到最大,FSC為4 140 FU/mL、CSB為3 720 FU/mL、CSC~3 060 FU/mL。

圖4 不同發酵時間下3種發酵液的納豆激酶酶活
Fig.4 Nattokinase enzyme activity of three kinds of fermentation broth at different fermentation time
2.6 不同發酵液ABTS自由基清除活性的比較
3種發酵液的ABTS自由基清除活性如圖5所示。隨發酵時間延長,不同發酵液的ABTS自由基清除能力均不斷提高。其中,CSC始終高于其他2種,并在發酵32 h時清除率達到96.8%。8 h時,FSC與CSC基本一致,但16 h后則低于CSC。相比而言,CSB的ABTS自由基清除率最低。和陽性對照Trolox相比,2種蠶蛹發酵液始終顯著高于陽性對照,而黃豆發酵液則在16 h后才超過陽性對照。由此可見,蠶蛹的納豆菌發酵液的抗氧化活性顯著高于黃豆,且蠶蛹發酵液抗氧化活性很大程度來自于納豆菌對其的利用。

圖5 不同發酵時間下3種發酵液的ABTS自由基清除率
Fig.5 ABTS free radical scavenging rate of three kinds of fermentation broth at different fermentation time
2.7 不同發酵液降血脂活性的比較
以3種不同膽酸鹽的結合率為指標考察發酵液的降血脂活性,如圖6所示。由圖6可知,隨著發酵時間的延長,3種發酵液對3種膽酸鹽的結合率均有提高。與陽性對照(10 mg/mL考來烯胺)相比,3種發酵液的牛膽酸鈉結合率低于陽性對照,而甘氨膽酸鈉、膽酸鈉3種膽酸鹽結合率高于陽性對照。3種發酵液中,2種蠶蛹發酵液的3種膽酸鹽結合率始終高于黃豆發酵液,且發酵32 h時,3種膽酸鹽結合率都在75%以上,其中FSC的牛膽酸鈉結合率和甘膽酸鈉結合率略高于CSC,而膽酸鈉結合率略低于CSC。由此可見,蠶蛹發酵液的降血脂活性優于黃豆發酵液,且其活性強度受發酵時間影響。當活性達到最大時蠶蛹熟化變性對其降血脂活性無顯著影響。

a-牛黃膽酸鈉結合率;b-甘膽酸鈉結合率;c-膽酸鈉結合率
圖6 三種發酵液對3種不同膽酸鹽的結合率
Fig.6 The binding rate of three kinds of fermentation broth to three different cholate salts
2.8 不同發酵液抗凝血活性的比較
以80 mg/mL肝素鈉作為陽性對照,使用全自動血凝儀對不同發酵液的抗凝血指標[活化部分凝血酶時間(active part thrombin time,APTT)、凝血酶原時間(protothrombin time,PT)、凝血酶時間(thrombin time,TT)、纖維蛋白原(fibrinogen,FIB)]進行檢測。隨著發酵時間的增長FSC的APTT值呈上升趨勢,在32 h時達到最大,且在8 h以后APTT值一直高于CSC、CSB(圖7-a)。隨著發酵時間的增長FSC的PT值呈上升趨勢,CSC、CSB的PT值呈下降趨勢,在發酵時間為32 h時,FSC的PT值達到最大為38.3(圖7-b)。隨著發酵時間的增長,FSC與CSC的TT值略有波動,都在32 h時達到最大17.2 s,CSB的TT值呈下降趨勢,在發酵時間為32 h時,CSC、FSC、CSB的TT值分別為17.2、17.2、22.4 s(圖7-c)。隨著發酵時間的增長FSC、CSC、CSB的FIB值整體均呈下降趨勢,在發酵時間為32 h時3種發酵液的FIB值均達到最小,CSC、FSC、CSB分別為1.17、1.22、1.26 g/L(圖7-d)。APTT、PT、TT 3個指標值越大說明該機理下的抗凝血活性越高,FIB則相反[27]。由數據分析可知,APTT、PT指標下的抗凝血活性新鮮蠶蛹發酵液遠高于其他2種發酵液,TT指標下的抗凝血活性黃豆發酵液略高于2種蠶蛹發酵液,FIB指標下的抗凝血活性為煮熟蠶蛹發酵液高于新鮮蠶蛹發酵液高于黃豆發酵液。綜合4項指標在抗凝血方面的作用程度重要性,得出結論新鮮蠶蛹發酵液的抗凝血活性大于煮熟蠶蛹發酵液大于黃豆發酵液。

a-APTT值;b-PT值;c-TT值;d-FIB值
圖7 三種發酵液在不同發酵時間的4項抗凝血指標
Fig.7 Four anticoagulation indicators of three fermentation broth at different fermentation time
3 結論
本文以煮熟蠶蛹粉、新鮮蠶蛹粉和黃豆粉3種不同的氮源進行納豆菌的發酵,并對發酵液的納豆激酶酶活、抗氧化活性、降血脂和抗凝血活性進行比較。研究表明,與常規以黃豆為基礎的納豆發酵制品相比,蠶蛹具有與黃豆相似的蛋白含量,但在相同發酵條件下,蠶蛹的納豆激酶酶活、抗氧化活性、降血脂及抗凝血活性優于黃豆的納豆菌發酵產物。而蠶蛹以鮮蛹狀態發酵得到的活性略優于熟蛹狀態發酵,可見蠶蛹發酵液的活性更大來源于發酵過程納豆菌對蠶蛹的利用。綜上,利用納豆菌發酵繅絲蠶蛹是繅絲蠶蛹高值化利用的有效途徑。

