KMnO4 氧化-單掃描示波極譜法間接測定食品中甜蜜素
王 瑩,陳 文,張 浩
(成都理工大學 材料與化學化工學院,成都 610059)
甜味劑是對食物有重要影響的食品添加劑,是禁糖人士的福音。甜蜜素(CYC)屬于甜味劑的一種,其對光、熱穩定,甜度為蔗糖的30~80倍[1],應用范圍很廣。CYC 化學名稱是環己基氨基磺酸鈉(C6H11NHSO3Na),為白色結晶或結晶性粉末,無臭,水溶性好。CYC 可溶于水和丙二醇,在兩者中的溶解度為1 g/5 mL[2],0.1 kg·m-3CYC溶液的pH 約為6.5。自2009年廣東省“真果粒奶味飲料”中CYC 超標事件發生以來,CYC 的安全使用問題受到了公眾的廣泛關注。人體每天代謝的CYC 的量有限,CYC的最大攝入量為每公斤體重11 mg。攝入過量的CYC不僅會加重肝臟負擔,還對腎臟有一定的毒副作用[3];有研究表明,甜蜜素還對成骨細胞的增殖和分化有明顯的的抑制作用[4]。因此,建立一個簡單、快速、有效地測定食品中CYC 含量的方法,對于食品安全的保障具有十分重要的意義。
目前,CYC的測定方法有氣相色譜法[5-6]、高效液相色譜法[7-8]、液相色譜-串聯質譜法[9-10]、分光光度法[11]、薄層層析法[12]和離子色譜法[13-14]等。這些方法各有其應用領域和特點,但氣相色譜法和液相色譜法存在設備昂貴、無法在基層檢測機構使用的問題;液相色譜-串聯質譜法和薄層層析法存在分析過程繁瑣、樣品前處理要求較高、操作過程不夠簡便等問題。
目前,關于采用電化學方法檢測CYC的報道不多。文獻[15]使用三電極系統,在氨性底液[含有0.8%(質量分數)對氨基苯磺酸、0.2%(質量分數)鹽酸奈乙二胺、5%(質量分數)氨水的混合溶液]中,建立了在-0.38 V(相對于飽和甘汞電極)下測量CYC的二次衍生極譜波的方法,但該方法需將CYC酯化,分析過程繁瑣,分析時間較長。根據文獻[16]報道,在強堿性溶液中,KMn O4會與CYC發生氧化還原反應,Mn O4-被還原為綠色的Mn O42-。當把極譜三電極置于上述反應體系中進行線性掃描時,Mn O4-在電極上會產生一個還原峰,且還原峰的峰電流與CYC的含量在一定范圍內呈顯著負相關,即CYC濃度越大,峰電流越小。
本工作先采用正己烷對樣品中的CYC 進行提取,以將其與樣品中的色素及其他具有還原性的物質進行有效的分離,然后采用單掃描示波極譜法測定CYC含量,該方法分析體系簡單,無需對CYC進行轉化,具有靈敏度較高、操作簡便、分析成本低等特點,有較好的應用價值。
1 試驗部分
1.1 儀器與試劑
JP-303型示波極譜儀;三電極體系:滴汞電極為工作電極,飽和甘汞電極為參比電極(222型),鉑微電極為輔助電極;BS-2245型電子分析天平;H-S6型恒溫水浴箱;HC-2066 型高速離心機;優普系列ULUP-IV-10T 型超純水機。
CYC 標準儲備溶液:10.00 g·L-1,稱取1.000 0 g CYC 于燒杯中,用水溶解并定容至100.0 mL。
CYC標準溶液:1.000 g·L-1,移取10.00 mL CYC標準儲備溶液于100 mL 容量瓶中,用水稀釋至刻度。
NaOH 飽和溶液:23 mol·L-1,稱取92.0 g NaOH 于燒杯中,加入100 mL水溶解,冷卻至室溫后真空抽濾,濾液備用。
KMn O4溶液:0.033 5 mol·L-1,稱取1.7 g KMnO4固體于500 mL 水中,蓋上表面皿,加熱至沸騰并保持微沸狀態1 h,冷卻至室溫,溶液保存于棕色試劑瓶中,并在室溫下靜置5 d后,用砂芯漏斗過濾備用[12]。其含量用草酸基準試劑標定。
十二烷基磺酸鈉(SDS)溶液:1.0×10-3mol·L-1,稱取0.014 4 g SDS于燒杯中,用水溶解并定容至50.0 mL。
CYC標準品純度為99%;NaOH 為優級純;其他試劑均為分析純;試驗用水為RO 純凈水。
果凍、話梅、菠蘿啤酒樣品采購于當地超市。
1.2 儀器工作條件
起始電位-0.20 V;掃描速率0.40 V·s-1;靜止時間4 s;掃描次數3 次;汞柱高度45 cm;量程0~4.0×102nA;測試溫度常溫。
1.3 試驗方法
稱取固體樣品果凍約70 g或話梅約15 g,加水約30 mL,用玻棒搗碎后攪拌10 min,濾紙過濾,濾液備用;將20 mL 液體樣品菠蘿啤酒放入50 ℃水浴鍋,保溫20 min除去其中的二氧化碳,冷卻至室溫,備用。
取上述處理好的固(液)體樣品溶液20 mL于50 mL 離心管中,加入10 mL 正已烷,振蕩提取5 min后,以2 000 r·min-1轉速離心10 min,收集上清液于50 mL燒杯中,加入30 mL水,于70℃保溫30 min,除去溶液中的正己烷,即得到待測樣品溶液。在10.0 mL 的比色管中依次加入樣品溶液1.0 mL、KMn O4溶液0.10 mL、少量水、NaOH 飽和溶液0.90 mL和SDS溶液0.75 mL,用水稀釋至刻度,搖勻后放入50 ℃恒溫水浴中保溫20 min,冷卻至室溫后倒入10 mL燒杯中,在儀器工作條件下進行測定。
2 結果與討論
2.1 底液的選擇
2.1.1 KMnO4用量
試驗通過KMn O4峰電流與CYC 含量的負相關性來檢測CYC的,因此KMn O4的濃度需適當過量,使其峰電流足夠大,以保證CYC 能與其完全反應,但是KMn O4的用量過大,又會使CYC 對其消耗量不足,難以造成峰電流的明顯改變,所以KMn O4的用量選擇非常關鍵。
試驗結果顯示:當CYC的質量濃度為0.50 g·L-1時,KMn O4用量分別為0.05,0.10,0.20,0.30,0.40,0.50 mL 時,峰電流分別為6.000×102,5.969×102,6.000×102,4.188×102,5.938×102,3.344×102nA。由此可見,在KMn O4溶液用量為0.05~0.20 mL 時,峰電流響應最好,綜合考慮,試驗選擇KMn O4溶液用量為0.10 mL。
2.1.2 NaOH 飽和溶液用量
KMn O4與CYC 的反應只有在強堿性條件下才能進行,但堿性太強不僅會腐蝕試驗器皿,還會使反應不再均勻緩和地進行。試驗考察了CYC 標準溶液的質量濃度分別為0.10 g·L-1(低)和0.50 g·L-1(高)時,不同用量NaOH 飽和溶液對峰電流的影響,結果見圖1。
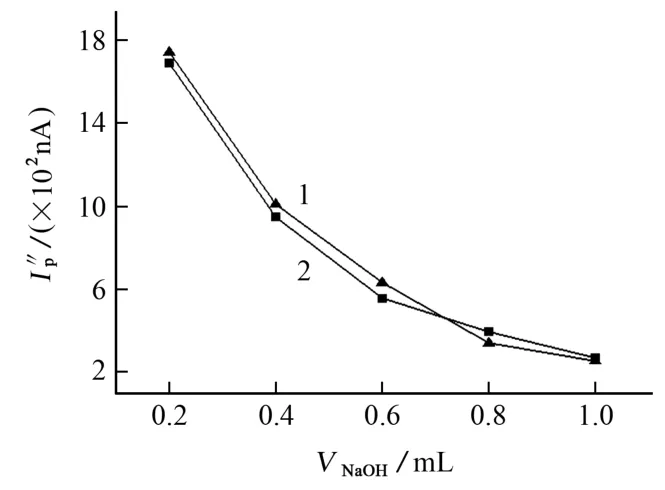
圖1 NaOH 用量對峰電流的影響Fig.1 Effect of the volume of NaOH solution on the peak current
由圖1可知:在高、低質量濃度的CYC 標準溶液中,不同用量的NaOH 飽和溶液對峰電流的影響趨勢一致,峰電流均隨著NaOH 用量的增加而下降。綜合考慮,試驗選擇NaOH 飽和溶液用量為0.90 mL。
2.1.3 表面活性劑的種類和用量
由于表面活性劑可以在溶液中形成膠束,能通過增大待測物在溶液中的溶解度來增大待測物在電極表面的吸附量,對峰電流具有增敏作用。
試驗考察了表面活性劑SDS、十六烷基三甲基溴化銨(CTMAB)和曲拉通(Triton X-100)對峰電流的的影響。結果顯示:SDS對峰電流的影響較明顯。進一步對其用量考察后發現:SDS溶液的用量為0.75 mL時,對峰電流具有較大的增敏作用。試驗選擇SDS溶液的用量為0.75 mL。
2.2 反應溫度和時間的選擇
試驗考察了CYC 標準溶液的質量濃度分別為0.10 g·L-1和0.50 g·L-1時,不同反應溫度不同反應時間對峰電流的影響,結果見圖2。
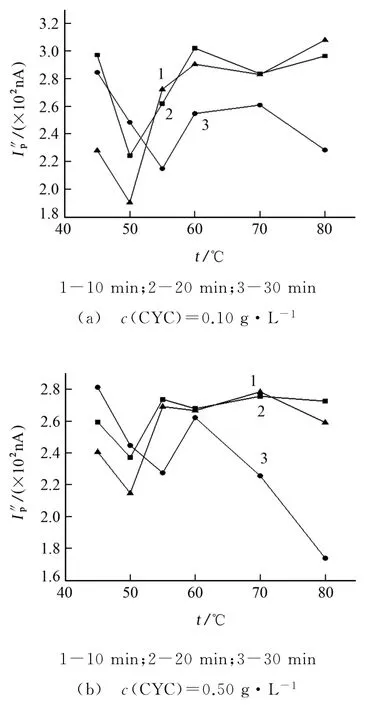
圖2 反應溫度及時間對峰電流的影響Fig.2 Effect of the reaction temperature and time on the peak current
由圖2結果表明:在50 ℃下反應20 min 時,KMn O4的峰電流最低最穩定,反應更完全。為兼顧高、低含量CYC 的檢測,試驗選擇反應溫度為50 ℃,反應時間為20 min。
2.3 儀器工作條件的選擇
試驗考察了CYC 標準溶液的質量濃度分別為0.10 g·L-1和0.50 g·L-1時,不同掃描速率(0.10~1.0 V·s-1)、不同掃描次數(1~8次)、不同靜止時間(1~10 s)、不同起始電位(-0.20~-0.70 V)、不同汞柱高度(30~55 cm)對峰電流的影響,優化后的儀器工作條件見1.2節。
2.4 標準曲線與檢出限
配制質量濃度分別為40,60,80,100,110,120,130,140,150,200,250,300,350,400,450,500,550,600,650,700 mg·L-1的CYC標準溶液系列,在儀器工作條件下測定,以CYC 的質量濃度為橫坐標,KMn O4峰電流為縱坐標繪制標準曲線。CYC的質量濃度在40~700 mg·L-1時與峰電流具有很好的曲線擬合關系,標準曲線的回歸方程為I″p(×102nA)=-0.010 4ρ3+0.142 1ρ2-0.645 1ρ+1.782,相關系數為0.990 9,可以用于食品樣品中的CYC含量分析。
按照儀器工作條件對0.10 g·L-1的CYC標準溶液進行連續10次測定,以峰電流的標準偏差與標準曲線斜率之比計算該方法的檢出限(3s/k)為5.3 mg·L-1,滿足分析要求。
2.5 精密度與穩定性試驗
按照儀器工作條件對0.10 g·L-1和0.50 g·L-1的CYC標準溶液進行6次平行測定,計算測定值的相對標準偏差分別為1.56%,2.29%,說明本方法精密度較高。
對分別含有0.10 g·L-1和0.50 g·L-1的CYC標準溶液的樣品溶液的敞開體系和密閉體系的穩定性進行考察,發現,敞開體系放置時間為15~90 min,密閉體系放置時間為12 h內時,樣品溶液處于穩定狀態,其穩定性較好。
2.6 共存物質的影響
由于食品基質比較復雜,試驗考察了在0.50 g·L-1CYC溶液中添加了食品中可能共存的離子和添加劑后對峰電流的影響,結果見表1。
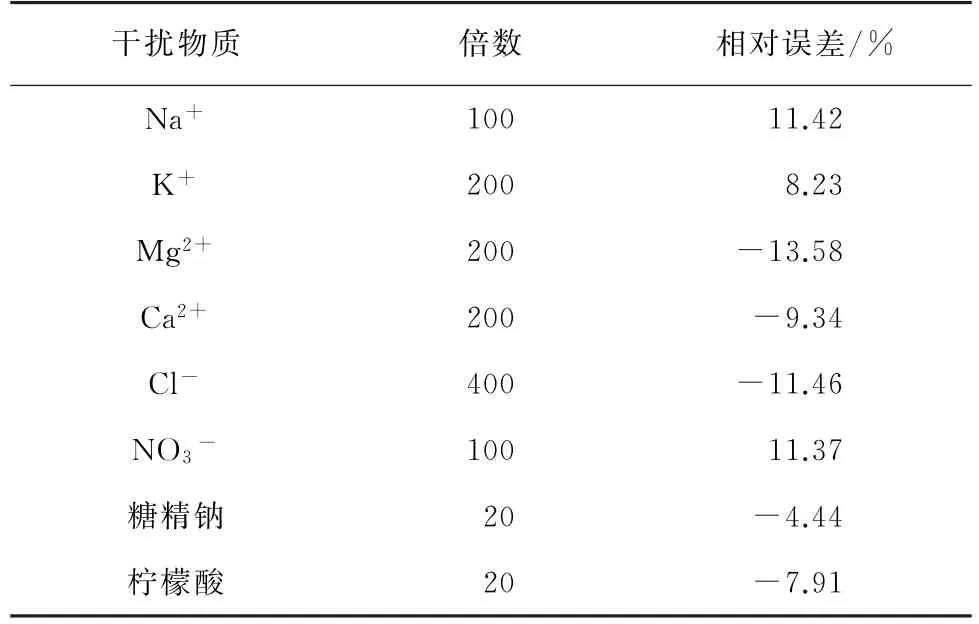
表1 共存物質的干擾Tab.1 Interference of coexisting substances
由表1可知:可能共存的離子和添加劑對試驗結果的測定影響較小;根據我國GB 2760-2014的規定,CYC允許添加量為0.65~8.0 g·kg-1,糖精鈉允許添加量為0.15~5.0 g·kg-1,檸檬酸添加量在10 g·kg-1之內,均不會對CYC 的測定產生干擾。
防腐劑山梨酸鉀、抗壞血酸和水溶性色素如檸檬黃、日落黃、胭脂紅等添加劑因不溶于正己烷而不會在樣品提取溶液中存在,不影響CYC的測定。
2.7 極譜行為研究
為了確定電極反應機理,按照試驗方法配制7種不同混合溶液,并對其進行測定,結果見圖3。
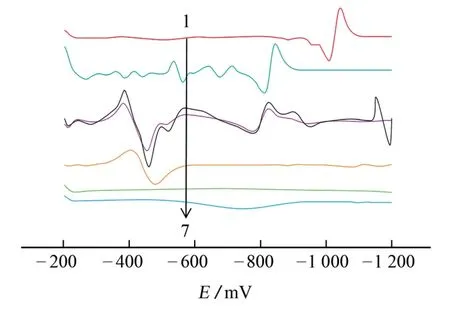
圖3 不同混合溶液的二階導數極譜圖Fig.3 Second-order derivate polarogram of different mixture solutions
由圖3可知:在掃描電壓范圍內,CYC 會產生微弱的峰電流,但是其變化無規律(曲線7);KMn O4在-1.0 V 附近產生一個較強的還原峰(曲線1);NaOH 溶液的還原峰電位在-0.50 V 附近(曲線5);SDS溶液單獨存在時,無還原峰出現(曲線6);CYC-KMnO4產生的還原峰電流與KMn O4的一致,峰電位因CYC 的影響左移至-0.80 V 附近(曲線2);當加入NaOH 溶液后,二者發生氧化還原反應,-0.80 V 處峰電流顯著降低(曲線4);加入SDS后,-0.80 V 處的峰電流有一定程度的增大,說明SDS對峰電流有增敏作用(曲線3),因此,試驗選擇將-0.80 V 處的峰作為定量檢測CYC 含量的極譜峰。
根據以上的結論,推斷電極的反應機理為:MnO4-在滴汞電極上會產生一個靈敏的還原峰,當在堿性溶液中時,其與CYC 發生氧化還原反應,MnO4-被還原為MnO42-,溶液中MnO4-含量降低,其產生的峰電流下降,根據峰電流變化間接測定CYC 的含量。電極反應機理見以下反應式:MnO4-+e-→MnO42-。
2.8 電化學行為研究
根據試驗方法,當CYC標準溶液的質量濃度為0.50 g·L-1時,試驗考察了不同掃描速率對峰電流的影響。結果顯示,在掃描速度為200~1 000 mV·s-1時,測得的峰電流與掃描速率成正比,其線性回歸方程為:I″p(×102nA)=0.003 6ν(mV·s-1)+0.335 3(n=10),相關系數為0.987 4。由此可推斷,電化學反應過程受吸附控制。
2.9 回收試驗
按試驗方法先測定果凍、話梅和菠蘿啤酒樣品中CYC的含量,每種樣品平行測定3次,然后在其中加入已知含量的CYC 標準溶液進行加標回收試驗,結果見表2。
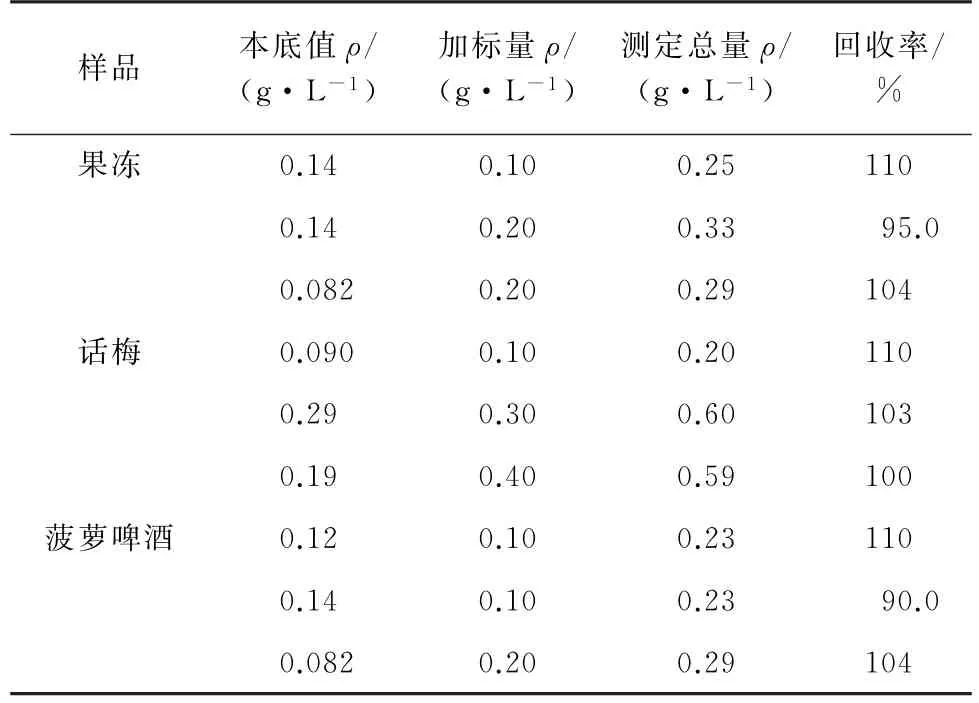
表2 回收試驗結果Tab.2 Results of test for recovery
由表2可知:CYC的回收率為90.0%~110%,說明本方法具有較好的準確度。
2.10 方法比對
用本法與文獻[17]報道的分光光度法對3種樣品進行測定,并對其測定值進行比對,結果見表3。
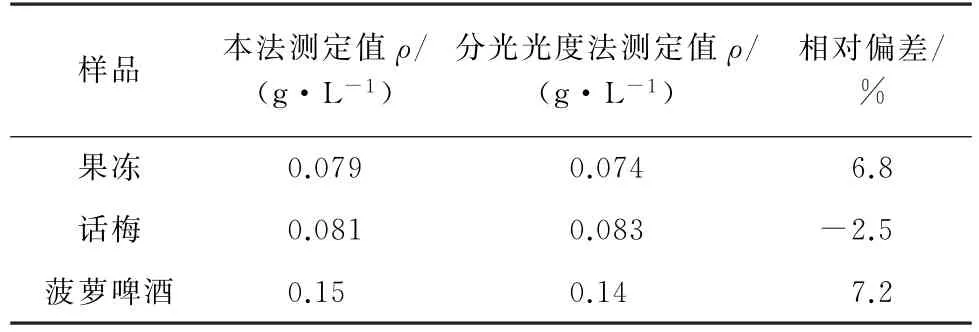
表3 2種方法的結果比對(n=3)Tab.3 Comparison of results obtained by the 2 methods(n=3)
由表3可知:本法與分光光度法[17]的分析結果很接近,相對偏差較小,說明本法具有較高的準確度。
本工作建立了一種簡易的KMn O4氧化-單掃描示波極譜法間接測定食品中CYC的方法,該方法線性范圍寬,檢出限低,適于甜蜜素含量較高的樣品分析。

