傳統酸粥發酵過程中營養成分及風味的變化規律
郭昊翔,滿都拉,任宇婷,郝媛,孫子羽,陳忠軍
(內蒙古農業大學 食品科學與工程學院,內蒙古 呼和浩特,010018)
由于谷物發酵食品易于消化和吸收,世界各國都有其獨特的谷物發酵食品。如在非洲各國以玉米、高粱和小麥主要原料的發酵谷物就有Mawe、Mahewu[1]、Kenkey[2]、Oji[3]、Banku[4]和Togwa[5]等。在亞洲,印度的Idli[7]和菲律賓的Puto[8]主要是以大米為主要原料。在中國,酸粥主要由糜米發酵而成,主要產自內蒙古西部、陜西府谷和山西河曲等西部地區[9]。據《河曲縣志》記載起源于北宋時期,而后酸粥作為黃河畔地區的主要飯食,流傳至今。通過微生物發酵,谷物的口感、營養價值會發生很大的改變。
目前,有關中國傳統酸粥的研究主要集中在微生物組成和營養成分分析上[9]。其中微生物相關研究除傳統分離培養技術外,變性梯度凝膠電泳及高通量測序技術也被運用到酸粥的菌群分析之中[10-11]。但有關酸粥發酵過程中營養成分變化規律以及其微生物之間關系的研究尚未開展。此外,對于傳統發酵酸粥風味的評價依舊依賴于感官評價,但個體差異極易增加感官結果誤差,電子鼻和電子舌具有對味覺物質高選擇性和結果準確等優點,客觀性強、重現性好。目前電子鼻被廣泛應用于具有揮發性氣味的食品進行識別和分類,電子舌也可對多種類型的食品進行評價和檢測[12-13]。
本研究以傳統酸粥為研究對象,通過測定發酵過程中總蛋白、脂肪、VB12、VC、煙酰胺、VB6、生物素、葉酸、VB2和VB5含量,分析自然發酵過程中營養成分變化規律。進一步利用電子舌和電子鼻對傳統酸粥發酵過程中的風味變化進行評價,研究傳統發酵酸粥風味形成規律,為進一步開發傳統發酵酸粥食品奠定基礎。
1 材料與方法
1.1 實驗材料
1.1.1 酸粥樣品的制備
準備滅菌后的250 mL容量的發酵瓶,稱取70.00 g糜米裝入其中,加水至瓶口后封蓋,共制備21個樣品瓶。35 ℃恒溫發酵36 h,發酵開始后每隔6 h取出3個發酵瓶,共7組(0、6、12、18、24、30、36 h)21個樣品。
1.1.2 儀器與設備
Aglilent TechnologiesG7129A液相色譜儀,安捷倫科技有限公司;SA402B電子舌,日本Insent公司;PEN3電子鼻,德國Airsense公司。
1.2 實驗方法
1.2.1 酸粥的理化及營養成分測定
pH值的測定方法為取10 mL發酵液,使用pH計測定。總酸測定采用滴定法[14]。總糖采用DNS法測定[15]。蛋白質含量采用凱氏定氮法[16]。脂肪含量測定采用酸水解法[17](在理化指標測定中,樣品在測定前需充分混勻并進行至少3組平行實驗,以確保實驗結果的準確性)。維生素采用高效液相色譜法測定[18],具體條件如下:液相色譜儀(Agilent TechnologiesG7129A);色譜柱為Agilent Zorbax Eclipse Plus-C18(4.6 mm×150 mm,4 μm);流動相A為25 mmol/L KH2PO4緩沖液(用H3PO4調pH值至2.5);B為乙腈;梯度洗脫條件為起始5 min內100%A液洗脫,隨后20 min內A相體積比由100%線性下降至75%,保持5 min后,恢復至100%A平衡色譜柱10 min;流速1.0 mL/min;柱溫為30 ℃;進樣器溫度為4 ℃;進樣體積20 μL;六通道數據采集波長分別設定為205、 246、 261、 267、 283、 290 nm。
1.2.2 酸粥的電子舌檢測
傳感器和電極在使用前需要活化24 h,甜味電極需要單獨活化。檢測循環次數為其他味4次,甜味5次。取樣品35 mL,去掉第1次不穩定數據求其平均值,做雷達圖進行分析。
1.2.3 酸粥的電子鼻檢測
取樣品5 mL于10 mL的離心管中,并用保鮮膜封閉其頂部,采用頂空抽樣的方法用電子鼻檢測。電子鼻的檢測參數為樣品測定間隔1 s,清洗時間60 s,自動調零時間5 s,樣品準備時間5 s,樣品測定時間100 s,內部空氣流量400 mL/min,進樣流量400 mL/min。選取數值穩定的檢測時間所測得的數據做雷達圖進行分析。
1.2.4 數據分析
利用Microsoft office excel 2017 進行數據分析及繪圖,當2組間P<0.05時認為2組間存在顯著差異,以不同小寫字母表示。
2 結果與分析
2.1 發酵過程中pH值和酸度的變化
酸粥作為傳統發酵食品,可以通過檢測發酵過程中pH值和酸度監測其變化。如圖1所示,經過36 h的監測實驗,傳統酸粥在發酵初期的6 h pH值由pH 6.8顯著下降至4.29(P<0.05),之后pH值無顯著變化(P>0.05)并趨于平緩,12、18、24 h的pH值分別為3.97、 3.851、3.80。另外,傳統酸粥的總酸含量在發酵0~18 h隨時間顯著上升(P<0.05)。0、6、12、18 h總酸含量分別為0.06 g/kg、 8.1 g/kg、 17.7 g/kg、26.76 g/kg,發酵24 h總酸含量上升至29.58 g/kg較18 h變化不顯著(P>0.05),之后發酵24~30 h總酸含量顯著增加至36.42 g/kg(P<0.05),30~36 h酸度停止增長。
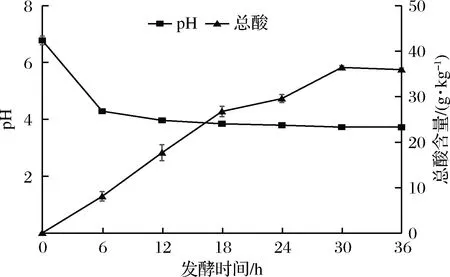
圖1 酸粥發酵過程中pH和酸度的變化
Fig.1 The variation of pH and acidity in the fermentation process of sour porridge
2.2 酸粥發酵過程中總糖、總脂和總蛋白含量的變化
通過檢測糖含量的變化能夠指示發酵進行的程度。如圖2所示,隨著發酵的進行,總糖質量濃度在0~6 h由0.03 mg/mL顯著上升至0.04 mg/mL(P<0.05),隨后6~18 h顯著下降至0.03 mg/mL(P<0.05),36 h時總糖質量濃度為0.03 mg/mL,變化趨于平緩,無顯著性差異(P>0.05)。利用凱氏定氮法測定酸粥發酵過程中各時段的蛋白質含量后發現,發酵0~12 h蛋白質質量分數由0.04%顯著上升至0.48%(P<0.05),12~24 h下降至0.32%但差異不顯著(P>0.05),隨后發酵進行到30 h顯著上升至0.50%(P<0.05), 36 h下降至0.40%。利用酸水解法測定酸粥各發酵階段的總脂肪質量分數,結果發現0~6 h脂肪質量分數下降,6~12 h脂肪質量分數由0.15%顯著上升至0.35%(P<0.05),隨后12~24 h脂肪質量分數顯著下降至0.02%(P<0.05),24~36 h顯著上升至0.17%(P<0.05)。
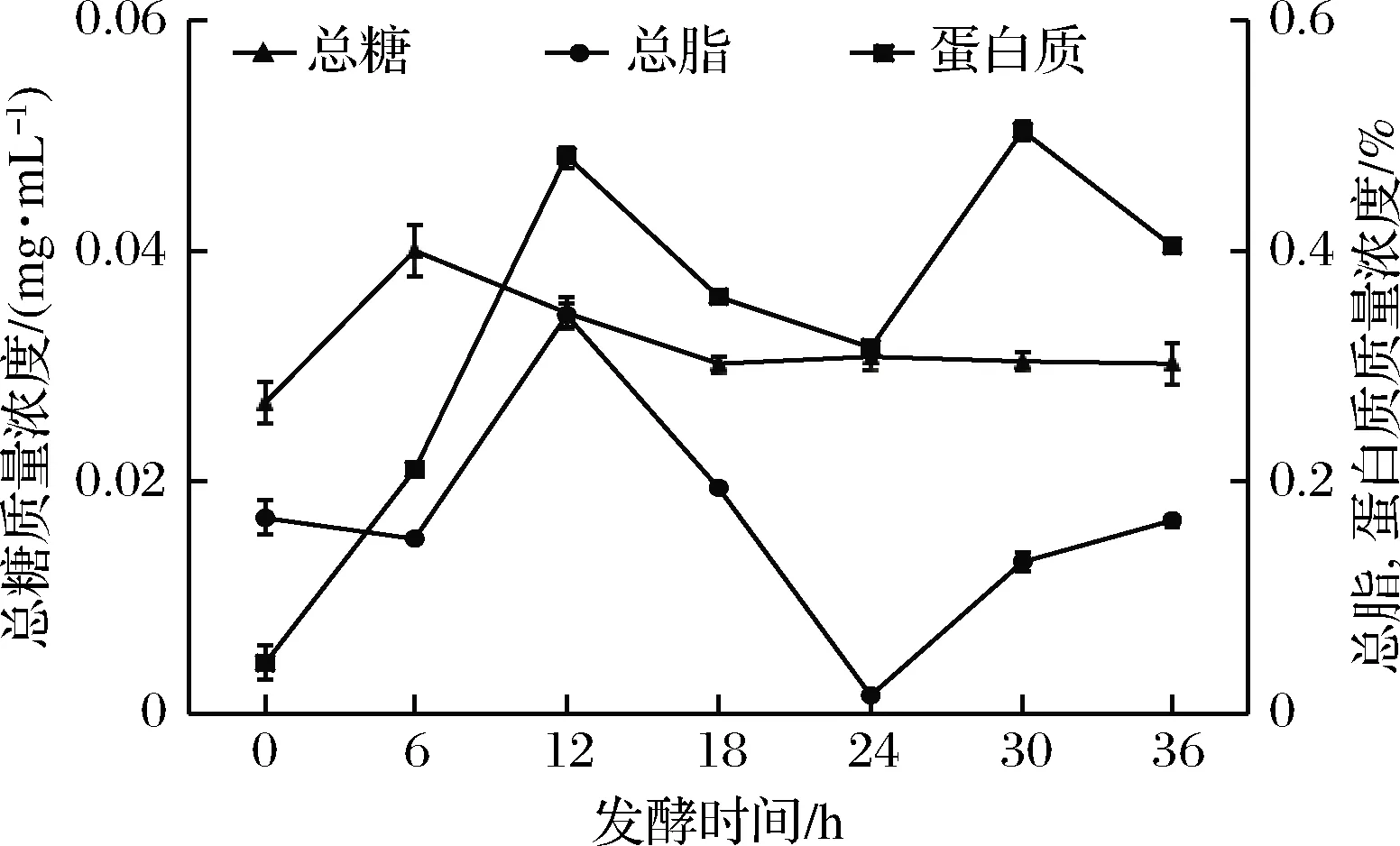
圖2 酸粥發酵過程中還原糖、總脂和總蛋白含量的變化
Fig.2 The variation of total sugar, total fat and total protein in the fermentation process of sour porridge
2.3 酸粥發酵過程中維生素含量的變化
發酵食品能夠提供多種維生素,這在缺少果蔬的地區成為主要的維生素來源。本研究通過測定酸粥發酵過程中各種維生素含量變化后發現,各種維生素變化差異較大,結果如圖3所示。VB12在發酵過程中0~12 h緩慢上升,12~30 h含量上升速度加快,30~36 h顯著下降(P<0.05)(圖3-A),在發酵至30 h時出現最高值,質量濃度為190.14 μg/mL,VB12在發酵后期快速下降的原因可能是pH值的下降,因為VB12在pH值<4的環境下不穩定[31]。VC的含量隨發酵的進行逐漸上升,0~18 h含量顯著上升(P<0.05),發酵至30 h后有所下降(圖3-B),含量最高出現在第30 h質量濃度為78.15 μg/mL。煙酰胺在發酵0~18 h顯著(P<0.05)上升,24~36 h顯著下降(P<0.05)(圖3-C),在發酵至24 h時出現最高值,質量濃度為23.51 μg/mL。VB6的含量在發酵的初期0~6 h無變化,6~18 h上升,18~24 h無變化,24~36 h含量下降但均不顯著(P>0.05)(圖3-D),高含量出現在第24 h,質量濃度為3.57 μg/mL。生物素的含量在發酵的0~6 h下降,6~24 h顯著上升(P<0.05),30~36 h顯著下降(P<0.05)(圖3-E),在第24 h質量濃度最高為1 132.66 μg/mL。葉酸含量在6~18 h顯著上升(P<0.05),18~36 h小幅下降但不顯著(P>0.05)(圖3-F),在第24 h,質量濃度最高為535.47 μg/mL。VB2的含量在酸粥發酵0~6 h上升,6~12 h間下降,隨后12~30 h顯著上升(P<0.05),30~36 h顯著下降(P<0.05)(圖3-G),在發酵至30 h時質量濃度最高為81.62 μg/mL,至36 h時含量降為0 μg/mL,該現象產生的原因可能是VB2無法在大量酸的環境下久存,而發酵過程中大量乳酸的產生導致VB2發生了分解反應,導致其含量在發酵末快速下降[32]。VB5的含量在發酵0~6 h下降,隨后6~18 h顯著上升(P<0.05),之后至36 h呈下降趨勢,但下降不顯著(P>0.05)(圖3-H),在發酵至18 h時出現最高值59.98 μg/mL。
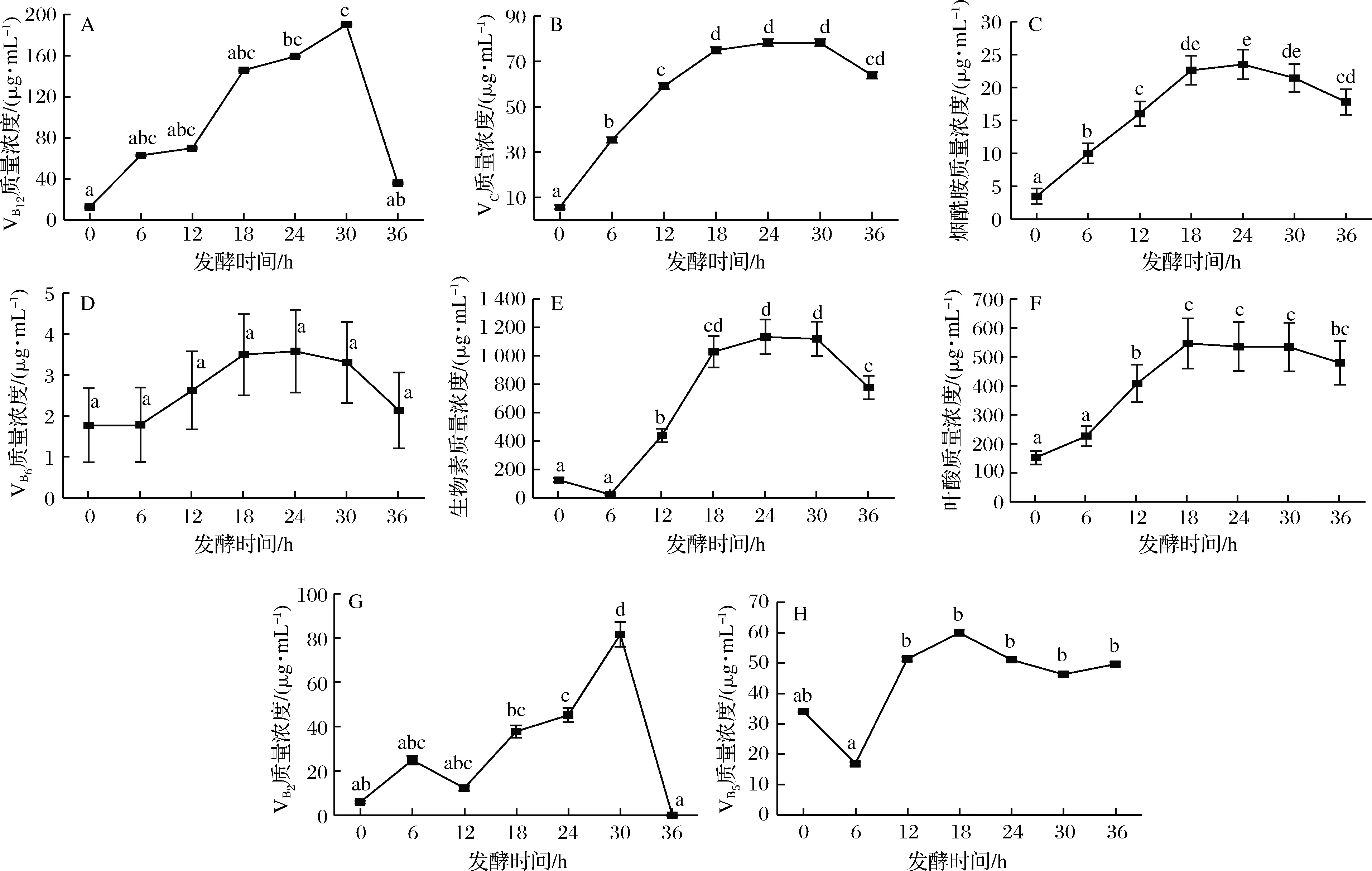
A-VB12;B-VC;C-煙酰胺;D-VB6;E-生物素;F-葉酸;G-VB2;H-VB5
圖3 酸粥發酵過程中維生素含量的變化
Fig.3 The variation of vitamins in the fermentation process of sour porridge
2.4 酸粥發酵過程中營養成分的相關性分析
如圖4所示,為了進一步研究揭示酸粥發酵過程中各種營養成分變化的相關性,利用皮爾遜相關系數及顯著性對其進行分析后發現,發酵過程中酸粥的酸度與蛋白質、VB12、VC、煙酰胺、生物素、葉酸、VB5呈顯著正相關而與pH值呈顯著負相關(P<0.05)。pH值與蛋白質、VB12、VC、煙酰胺、生物素以及葉酸呈顯著負相關(P<0.05)。蛋白質含量與VC、煙酰胺、生物素以及葉酸呈顯著正相關(P<0.05)。VB12與VC、煙酰胺、VB6、生物素、葉酸、VB2呈顯著正相關(P<0.05)。VC與煙酰胺、VB6、生物素、葉酸、VB2、VB5呈顯著正相關(P<0.05)。煙酰胺與VB6、生物素、葉酸、VB2、VB5呈顯著正相關(P<0.05)。VB6與生物素、葉酸呈顯著正相關(P<0.05)。生物素與葉酸、VB2、VB5呈顯著正相關(P<0.05)。葉酸同VB2、VB5呈顯著正相關(P<0.05)。VB5與總糖含量呈顯著負相關(P<0.05)。
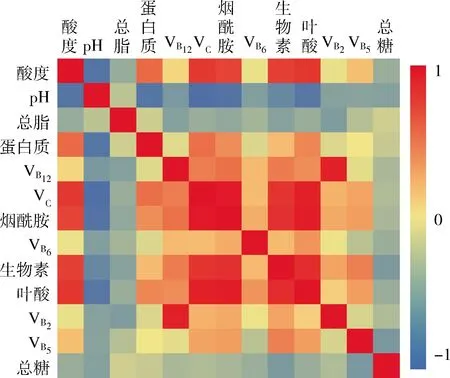
圖4 營養成分與理化指標相關系數矩陣
Fig.4 Correlation coefficient matrix of nutrients and physicochemical parameters
2.5 酸粥風味的電子舌及電子鼻評價
電子舌和電子鼻能夠反映發酵食品不同時期的味道和氣味變化,輔助判斷發酵結束的時間,其檢測性能穩定,可以很好識別味道和氣味。因此,為了考察酸粥發酵各個時期味道和氣味變化,本研究利用電子舌和電子鼻對酸粥發酵過程中味道和氣味的變化進行了研究。從電子舌雷達圖中可知(圖5-A),發酵過程中酸味(sourness)的檢測值呈現上升趨勢,此結果同總酸的測定結果符合,發酵產酸導致酸味的信號值上升。咸味(saltness)和甜味(sweetness)的檢測值在發酵過程中呈現下降趨勢,發酵24 h后趨于穩定,數值均在0~1,咸味物質在發酵第18~24 h迅速下降,檢測值從14.06降到2.16,出現下降趨勢的原因可能是糖類與鹽類在發酵過程中被微生物消耗利用。澀味(astringency)在發酵過程中逐漸上升,苦味(bitterness)在發酵過程中呈現微弱的上升趨勢,在發酵24 h后澀味和苦味均趨于穩定。后味A(aftertaste-A)和后味B(aftertaste-B)數值幾乎不變,后味A變化與澀味變化具有一致性,后味B變化與苦味變化具有一致性。說明發酵酸粥中含有澀味物質和苦味物質。鮮味(umami)呈現下降趨勢,從14.02降到0.89,同樣在發酵24 h后趨于穩定。豐度(richness)在發酵過程中基本保持不變,在0~2,其變化與鮮味變化具有一致性。
從電子鼻的雷達圖中可知(圖5-B),2號傳感器W5S(氮氧化合物)和6號傳感器W1S(烷類)的響應值變化比較明顯,2號傳感器所測得的數據呈現上升趨勢,在第30 h數值最大,說明發酵酸粥產生了氮氧化合物。6號傳感器隨著發酵的進行先降低后升高最后穩定于4~5,這樣的變化可能是由微生物種類的豐度變化引起的。7號傳感器W1W(無機硫化物)的響應值隨著發酵的進行呈現上升趨勢,9號傳感器W2W(有機硫化物)響應值變化與7號傳感器變化趨勢一致,說明在酸粥發酵過程中產生了硫化物,且含量隨時間的延長而增加,但在30 h后其含量有下降。8號傳感器W2S(醇類、醛酮類)與10號傳感器W3S(長鏈烷烴、脂肪族)的響應值變化呈現先下降后上升再下降的趨勢,隨發酵時間的延長產生了醇類、醛酮類以及烷烴物質,在發酵后期可能發生了締合反應生成其他物質,致使其含量下降。1號傳感器W1C(芳香苯類)的響應值基本穩定在1~2,說明酸粥發酵過程中芳香苯類物質一直存在。3號傳感器W3C(氨類,芳香成分)、4號傳感器W6S(氫化物)、 5號傳感器W5C(烯烴、極性分子、芳香成分)的響應值基本不變,說明在酸粥發酵過程中產生芳香成分較少或未產生。綜上所述,在第30 h 后,10個傳感器的響應值均有下降,可以得出發酵30 h是酸粥風味物質積累最多的時間。
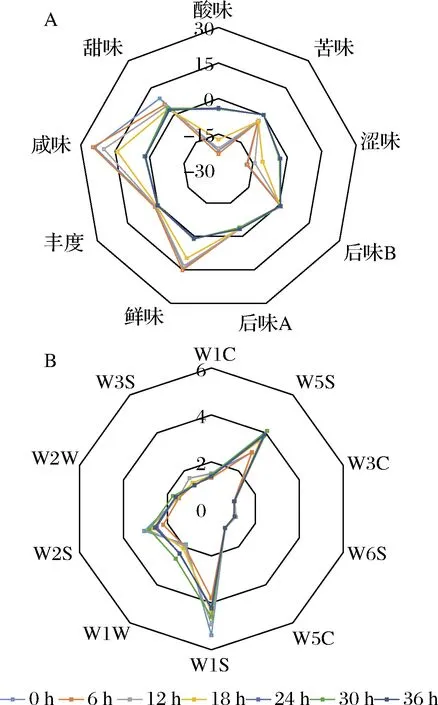
A-電子舌;B-電子鼻
圖5 酸粥電子舌和電子鼻特征值雷達圖
Fig.5 Radar map of the response value of the electronic tongue and electronic nose
2.6 電子鼻及電子舌與理化指標的相關性分析
為了研究揭示酸粥發酵過程中各種理化指標與風味變化的相關性,利用皮爾遜相關系數及顯著性對其進行分析。如圖6所示,發酵過程中酸粥的總脂肪含量與W5C、W3S呈顯著正相關(P<0.05)。蛋白質含量與甜味指數呈顯著負相關(P<0.05)。總糖含量與W1C、W1S、W2S信號呈顯著負相關(P<0.05),與后味B信號呈顯著正相關(P<0.05)。pH值與W6S、W1S、W3S、咸味、甜味信號呈顯著正相關(P<0.05),與W5S、W1W、澀味信號呈顯著負相關(P<0.05)。總酸與W5S、W1W、W2W、酸味、苦味、澀味信號呈顯著正相關(P<0.05),與W6S、W3S、鮮味、豐度、咸味、甜味信號呈顯著正相關(P<0.05)。

圖6 風味與理化指標相關系數矩陣
Fig.6 Correlation coefficient matrix of flavors and physicochemical parameters
3 討論
有研究顯示在酸粥發酵過程中乳酸菌為優勢菌群,在整個發酵過程對酸粥的風味及營養影響較大。酸粥的pH隨發酵逐漸下降,酸度逐漸上升,這與發酵過程中乳酸菌等微生物產生的有機酸有關,其中主要為乳酸,較低的pH值及高的酸度可以抑制有害菌的產生及生長,從而極大延長了酸粥的保存時間[3,19]。
關于總糖含量的變化,在0~6 h上升,可能是糜米中淀粉、麥芽糖等多糖充分溶于發酵液[20],同時發酵初期霉菌的糖化作用使得發酵液的總糖含量上升,之后發酵中期微生物利用糖作為其自身生長的碳源,因此總糖后期呈下降趨勢。酸粥發酵完成后蛋白質的含量高于未發酵原料,提高了酸粥的營養價值。酸粥中脂肪含量隨發酵進行整體呈下降趨勢,可能因為發酵過程中部分脂肪被微生物分解利用,導致樣品中的脂肪含量下降。維生素在新陳代謝過程中發揮著重要的作用,從本研究測定的8種維生素隨發酵時間的變化上看,發酵進行到30 h后不宜繼續發酵,應及時食用或進行冷藏,從而避免營養物質的流失,本實驗中的維生素幾乎全部來自于微生物的代謝。其中VB12在生產技術上存在很大的難度,因此VB12幾乎都是通過微生物發酵來生產的,能夠合成VB12的微生物主要有梭菌屬 (Clostridium)、棒狀桿菌屬 (Corynebacterium)、假單胞菌(Pseudomonas)、根瘤菌屬 (Rhizobium)、鏈霉菌屬(Streptomyces)和鏈球菌屬 (Streptococcus) 等[21],有研究發現酸粥中存在梭菌屬、棒狀桿菌屬和假單胞菌屬等,這可能是VB12的來源菌[11]。VC的含量同樣呈上升趨勢,可能是由于發酵過程中產生了一些代謝VC的微生物,其中主要有乳酸菌(Lactobacillus)、棒狀桿菌、醋酸菌(Aceticbacteria)[22]。煙酰胺的含量在發酵結束時較開始增長了4倍,可能發酵產生煙酰胺的微生物主要有芽孢桿菌(Bacillus)、紅球菌(Rhodococcus)以及小球菌屬(Pediococcus)[23]。酸粥發酵過程導致VB6在酸粥發酵過程中上升的原因可能是酸粥發酵過程中存在可產VB6的黃桿菌(Flavobacterium)、季也蒙畢赤酵母(Meyerozymaguilliermondii)、大腸桿菌(Escherichiacoli)和根瘤菌[24]。生物素在發酵過程中逐漸增加,許多微生物都能從頭合成生物素,其中高產以大腸桿菌(E.coli)與芽孢桿菌屬(Bacillus)為主[25]。葉酸的含量通過發酵大幅上升,導致該現象的原因是乳酸菌的大量繁殖[26]。除此之外,酵母菌(Saccharomycetes)以及雙歧桿菌(Bifidobacterium)在發酵中同樣可以產生大量葉酸[27]。VB2含量在發酵至30 h時達到最高,可能是因為酸粥發酵過程中存在枯草芽孢桿菌(B.subtilis)[28]、解朊假絲酵母(Candidafamata)[29]、釀酒酵母(Saccharomycescerevisiae)[30],這3種菌是VB2的主要生產者,同樣在發酵酸粥中也發現了上述幾種微生物[10]。
4 結論
傳統酸粥的pH值隨發酵逐漸下降。總糖含量在0~6 h上升,后期呈下降趨勢,蛋白質的含量高于未發酵原料,脂肪含量隨發酵進行整體呈下降趨勢。VC、煙酰胺、VB6、生物素、葉酸、VB5、VB12含量在0~30 h隨發酵進行顯著上升,VB12。VB2在發酵末期含量急速下降。風味測定結果表明,酸粥的口味比較均衡,整體呈現酸澀的口味,同時揮發性烷類、無機硫化物、氮氧化合物、醇類、醛酮類較多,電子舌和電子鼻可以很好地反映出發酵不同時期的味道變化,輔助判斷發酵結束的時間,同時其檢測性能穩定,所測定的結果準確,所以其應用于評級酸粥發酵各個時期味道變化是很好的選擇,這為進一步全局優化發酵工藝提高維生素總量及風味的改善奠定了基礎。通過理化與營養成分之間相關性以及風味與理化指標分析發現,pH和總酸與大部分成分之間存在顯著相關性(P<0.05),總的來看酸粥富含多種維生素,且發酵后大多數營養物質含量高于發酵0 h(未發酵)的樣品,發酵過程在0~30 h基本完成了風味及營養物質的累積,在發酵30~36 h反而有部分營養物質的流失,但是風味無明顯改變,因此發酵30 h后對酸粥進行貯藏可以最大限度地保留營養物質。
本文對內蒙古西部地區自然發酵酸粥的理化指標、部分營養成分以及風味進行了研究,發現傳統酸粥營養豐富,通過發酵維生素含量有極大的提升,整體呈酸澀的口味,同時酸粥的低pH和高酸度延長了它的貯藏期。但是作為地方特色食品,目前酸粥的生產大多是以家庭為主,導致制作酸粥的工藝不同,使酸粥的營養成分組成及口味的差異較大。因此為發揮酸粥的最大價值,科學的生產及保藏是進一步開發出產品質量均勻、風味穩定及營養安全的保障。通過工藝的不斷優化和深入,相信酸粥的產品質量會不斷提升,日后成為營養豐富、風味獨到的流行特色食品。

