MRI介導的低頻聚焦超聲聯合納米微泡對提高MSCs治療腦梗死大鼠的效果研究
羅凌云 廖偉鋒
中山大學附屬第三醫院粵東醫院神經內科,廣東梅州 514700
卒中俗稱腦中風,是危害人類最為嚴重的腦血管病之一,具有高發病率、高復發率、高致殘率和高死亡率的特點,已成為我國居民死亡原因之首[1]。靶向移植間充質干細胞(MSCs)為腦梗死的干細胞移植開拓新的領域,具有易于采集、免疫原性低、擴增能力強、成瘤性低等優點。臍帶間充質干細胞(UC-MSCs)已有一些小規模臨床試驗證明MSCs對腦梗死患者是安全和有效的,且采集方便擴增能力強。由于血腦屏障的存在,外周靜脈注射的MSCs向病變腦組織靶向歸巢少,會影響治療效果,而頸動脈注射和立體定向注射MSCs可使更多MSCs遷移至病變腦組織,但存在風險,不利于反復進行[2]。低頻聚焦超聲聯合納米微泡開放血腦屏障是一個血管細胞系統,它可以防止毒性的物質傷害腦組織。微泡的研究及應用拓展和深化了超聲的應用范圍,能顯著降低超聲波產生空化效應所需的能量閾值,減輕組織損傷,增強空化效應,磁共振成像(MRI)增強掃描是迄今最迅速便捷的監測BBB開放的手段[3-4]。我們將探討MRI引導下用低頻聚焦超聲聯合微泡輻照靶向性開放梗死區的血腦屏障,促進靜脈注射的臍帶來源的MSCs進入梗死區域,從而增加神經修復效果。
1 材料與方法
1.1 研究方案
1.1.1 MCAO大鼠模型的建立 清潔級SD大鼠80只,重量260~300g,雌雄各半(北京HFK生物技術有限公司)。用2%戊巴比妥鈉麻醉(40mg/kg) (山東新華制藥股份有限公司,H37020271),背位固定于大鼠手術臺,頸部正中切口2~2.5cm,分離雙側甲狀腺,鈍性分離肌群后暴露右側頸總動脈、頸內動脈及頸外動脈。結扎頸外動脈、頸總動脈,在頸外動脈距頸總動脈分叉部約1~2mm處剪一小口,經該切口將特制栓線插入頸內動脈,阻塞大腦中動脈起始部。60min后拔出線栓,恢復腦血流灌注。大腦中動脈閉塞和再灌注均通過TCD檢查證實。
1.1.2 制備納米微泡 制備帶正電荷的納米微泡,即稱取一定量的HEPC、DSPE-PEG2000、DOTMA(正電荷脂質)完全溶解于氯仿并置于培養皿中,在通風櫥內待氯仿自然揮發形成磷脂薄膜,加入水化液,37℃下搖床上水化60min后移至50mL離心管內,全氟丙烷氣體置換離心管上方空氣后再用超聲破碎儀進行聲振,聲振儀探頭置于氣液交界處。所得液體通過低速、高速離心獲得納米2級脂質微泡造影劑,在注射前新鮮配置。
1.1.3 MSCs的超順磁氧化鐵(SPIO)標記 轉染了EGFP質粒的臍帶來源的MSCs由申報單位的生物治療中心提供。向第4代MSCs培養基內加入SPIO,使鐵的終濃度為 50μg/mL,在 37℃、5%CO2孵箱內培養24h。通過普魯士藍染色判斷SPIO標記是否成功,并用CCK-8法檢測細胞活性。
1.1.4 低頻聚焦超聲聯合微泡注射和MSCs注射 實驗動物隨機分為四組:對照組(MCAO組);超聲微泡組;MSCs組;超聲微泡+MSCs組。每組20只,雌雄各半。各組均在MCAO模型建立后的12h進行處理。進行超聲微泡輻照時使用3.0T MR定位,用3%戊巴比妥鈉肌注麻醉動物,仰臥固定于MRI立體定向治療系統中,MRI掃描器采用臨床標準3.0T信號系統。每次照射前校正系統焦點坐標,根據MRI T2信息調系統焦點至目標區域—右側內囊后肢、右側中央前回。實驗采用三種MRI掃描序列分別為:照射前T2相掃描(TR:2000msec,TE:75msec,2次采集)獲取骨窗信息;實驗中T1相掃描(TR:500msec,TE:15msec,2次采集)實時監測腦組織。并行MRA和動脈自旋標記(ASL)成像。注射MSCs時由尾靜脈推注納米微泡1mL和MSCs懸液(細胞總數分別為1×105個),同時用小動物超聲探頭行超聲照射,照射頻率分別為0.2、0.5和0.8MHz,照射時間分別為 10、30和 60s。非 MSCs治療組則注入生理鹽水1mL。
1.2 觀察指標
1.2.1 治療前后大鼠的神經功能評分 各組治療前及處理后2周和4周再次進行神經功能評估。0分,無能缺損癥狀;1分,不能完全伸展左側前爪;2分,完全不能完全伸展左側前爪;3分,輕度向左側轉圈;4分,嚴重地向左側轉圈;5分,向左側傾倒。評分為1~4分者視為造模成功。
1.2.2 組織學檢測 各組在MRI介導的低頻聚焦超聲聯合納米微泡對提高MSCs治療減少腦梗死病大鼠黑質TH陽性和DAT陽性神經元的凋亡情況;提取總蛋白,用酶聯免疫吸附法(ELISA)檢測營養因子VEGF、NT-3、NGF和BDNF的含量。
1.3 統計學方法
采用SPSS20.0對數據進行處理,計量資料以(x±s)表示,兩樣本均數比較采用獨立樣本t檢驗,多組樣本間采用方差分析,計數資料用構成比(%)表示,組間比較采用χ2檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 治療前后大鼠的神經功能評分比較
四組大鼠治療后的神經功能評分均有所下降,且超聲微泡組、MSCs組、超聲微泡+MSCs組治療2周和4周評分均較對照組更低,超聲微泡+MSCs組治療后神經功能評分最低,差異有統計學意義(P < 0.05),見表 1。

圖1 MRI介導的低頻聚焦超聲聯合納米微泡對提高MSCs治療減少腦梗死病大鼠黑質TH陽性和DAT陽性神經元的凋亡情況
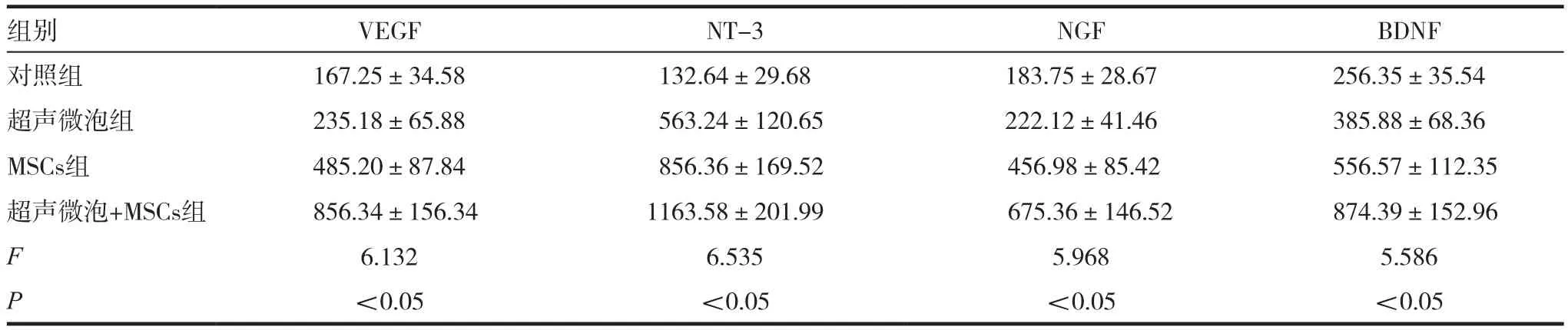
表2 治療后大鼠營養因子VEGF、NT-3、NGF和BDNF的含量比較(x ± s,Pg/mL)
2.2 MRI介導的低頻聚焦超聲聯合納米微泡對提高MSCs治療減少腦梗死病大鼠黑質TH陽性和DAT陽性神經元的凋亡情況
MRI介導的低頻聚焦超聲聯合納米微泡對提高MSCs治療減少腦梗死病大鼠黑質TH陽性和DAT陽性神經元的凋亡,減少了氧化應激對神經元的損傷,見圖1(A為TH,B為DAT)。
2.3 治療后大鼠營養因子VEGF、NT-3、NGF和BDNF的含量比較
四組大鼠治療后大鼠營養因子與對照組比較,顯著升高,超聲微泡+MSCs組升高最高,療效最好,見表2。
3 討論
腦中風是危害最為嚴重的腦血管病之一,據統計,我國現存腦卒中患者750萬,每年新增卒中患者約250萬,約3/4不同程度地喪失了勞動力。目前我們采用靜脈溶栓、血管介入治療等積極措施,并使用抗血小板、調脂藥、清除自由基、促進側枝循環、康復等綜合治療[5-7]。盡管如此,仍有許多腦梗死患者遺留殘疾。因此腦梗死患者的神經修復是目前迫切需要攻克的難題[8-10]。已有較多體外實驗和動物實驗的文獻支持MSCs通過神經再生、促進血管再生、神經保護、免疫調節、促進自噬和促進突觸形成等機制產生保護梗死組織[11-13]。低頻聚焦超聲聯合納米微泡開放血腦屏障(BBB),阻止了所有大分子物質和多于98%的小分子物質進入腦,因此BBB在維護腦穩態的同時也成為治療中難以逾越的屏障[13-15]。微泡能顯著降低超聲波產生空化效應所需的能量閾值,減輕組織損傷,增強空化效應,它在超聲介導下可引起空化作用,在這一過程中產生的能量可引起聲孔效應[13-14,16-17]。為確保聚焦超聲體外無創治療的安全性和有效性,影像學的實時監控和療效評價至關重要。磁共振成像可以增強掃描法檢測BBB可逆性開放的準確性和可靠性較高。人臍帶間充質干細胞在體外培養可表現出神經元的形態,并表達神經細胞標志物如TU-20、Trk A等,同時可分泌粒細胞集落刺激因子(G-CSF)、血管內皮生長因子(VEGF)等因子。MSCs促進梗死組織恢復的機制推測與神經再生、血管形成、神經保護、免疫調節、促進自噬、促進突觸形成和維持代謝平衡等有關,研究者通過頸內動脈注射自體BMSCs的方法使腦梗死患者的臨床評分(NIHSS、mRS)較對照組改善顯著[5,18-19]。
研究發現,MRI介導的低頻聚焦超聲聯合納米微泡對提高MSCs治療腦梗死大鼠可以顯著提高大鼠的神經功能,MRI介導的低頻聚焦超聲聯合納米微泡對提高MSCs治療減少腦梗死病大鼠黑質TH陽性和DAT陽性神經元的凋亡,減少了氧化應激對神經元的損傷,營養因子VEGF、NT-3、NGF和BDNF的含量也顯著增高。
MRI介導的低頻聚焦超聲聯合納米微泡對提高MSCs治療腦梗死大鼠可以促進腦梗死的神經修復以改善預后,減輕社會負擔和經濟負擔,具有重要的臨床價值和社會意義。

