右美托咪定對體外循環大鼠海馬區腦組織TLR4蛋白表達的影響
張媛媛,周 錦,曹惠鵑,張鐵錚,孫瑩杰
0 引言
體外循環(CPB)是與心血管外科手術相關的主要技術,該技術可提高許多心臟病的治愈率。然而,血液與CPB設備內表面的接觸,可激活補體系統,刺激促炎因子釋放,從而誘發炎性反應,對機體造成傷害。目前,CPB后神經系統并發癥已成為關注的焦點,其發生機制復雜,炎癥性腦損害是其中一個方向[1-2],而能有效預防CPB后神經系統損傷的藥物和介入手段仍比較有限。既往研究表明,在中樞神經系統中小膠質細胞的免疫應答是通過TLR4完成的,TLR4是觸發炎癥反應的關鍵[3]。右美托咪定是一種高選擇性的α2腎上腺素受體激動劑,具有鎮靜、抗焦慮以及輕度鎮痛作用,能夠減輕炎性反應,具有獨特的器官保護作用[4-5]。因此,本研究通過建立大鼠無血預充體外循環模型,觀察右美托咪定對體外循環大鼠血清和海馬區腦組織炎性因子水平、海馬區腦組織TLR4和NF-κB蛋白表達的影響,探討右美托咪定對體外循環致大鼠腦損傷的作用及可能機制。
1 材料與方法
1.1 實驗動物與分組 成年雄性SD大鼠30只,2~3月齡,350~400 g,由北部戰區總醫院動物實驗中心提供,且經北部戰區總醫院動物實驗倫理委員會核準通過。大鼠在進行實驗前6 h禁食,自由飲水。30只大鼠按隨機數字表法分成3組,每組10只,假手術組(Sham組):10%水合氯醛300 mg/kg腹腔注射麻醉后,行氣管插管,右頸內靜脈、右股靜脈、左股動脈及尾動脈穿刺置管,不進行體外循環。體外循環組(CPB組):同Sham組氣管插管和動靜脈置管后,行CPB 1 h。右美托咪定+CPB組(DC組):大鼠CPB前15 min內經靜脈泵注右美托咪定5 μg/kg,然后在CPB過程中以5 μg/(kg·h)的速度泵注1 h,其余同CPB組。設定4個時間點:T1 (CPB前)、T2(轉流1 h)、T3(轉流后2 h)、T4(轉流后6 h)。
根據孩子的好勝心理,可以舉行各式各樣的比賽。教師要積極創設條件,讓學生參與到課堂學習的各種比賽之中,這樣,學生學得快樂,學得高效。如教師指導學生朗讀課文時,可以采用個人賽讀、小組賽讀、男女賽讀等形式,比比誰讀得有感情。
1.2 建立大鼠CPB模型 本研究依照Chen等[6]的模型制備方法,建立無血預充大鼠體外循環非停跳模型。
作者的回復——我們感謝P.Molnar對我們工作(Parker et al,2011)的興趣,并客氣地(相當正確地)指出地殼均衡在龍門山造山帶長期物質方量平衡中的潛在作用。然而,他的觀點并沒有影響我們的文章的主要思想,即評估與地震相關的侵蝕過程與構造過程之間的瞬時競爭。而地殼均衡又是另一個原因,除了前面我們提出的,為什么我們描述的這種瞬時不平衡可能不會保持長的時間尺度,即超過多個地震周期和黏彈性響應時間(>1 000年)。確實,我們在我們的文章中提出,長期的巖石抬升不可能是2008年同震位移的簡單函數;它是由構造活動與彎曲均衡變形的組合產生的,但每個分量的相對重要性并不是我們研究的重點。
1.3 標本采集與處理 每組按時間點經保留的右股靜脈采血0.5 ml,室溫下靜置,10 min后離心(3 000 r/min,10 min)。留取上層血清保存在-20 ℃深低溫冰柜中,供ELISA檢測用。將大鼠放置于較大的托盤內,全麻狀態下剪開胸骨,快速且完整分離胸腺,充分顯露心臟。經左心室穿刺置管并連接300~400 ml冰鹽水灌注,同時在大鼠右心耳處剪一創口,起初有紅色血液流出,待流出液轉為無色液體時,斷頭取腦。兩側均由枕骨大孔至眼眶剪開,掀開顱頂骨,剪斷顱底部視神經,游離全腦并置于備好的冰袋上,迅速分離海馬組織,置于凍存管中,保存在-80 ℃冰箱里,ELISA法檢測IL-6、TNF-α水平,Western blot檢測TLR4、NF-kB蛋白表達。
大鼠稱重后,以300 mg/kg劑量腹腔注射10%水合氯醛,待大鼠無翻轉反射后固定于鼠板上,采用透光法進行氣管內插管(16G套管針),連接小動物呼吸機,設定參數。呼吸參數:FiO2=1.0,TV 3 ml/100 g,f=60/min,吸呼比1∶1.5,氣道峰壓9 cmH2O。穿刺部位剃毛,碘伏消毒,右股靜脈處穿刺置管(22G)并連接液體進行補液;尾動脈穿刺(24G)并連接一次性壓力傳感器測量有創動脈血壓;右頸內靜脈穿刺,并將導管尖端置于心房(18G,多側孔以便引流);左股動脈置管(22G)用于CPB過程中血液回輸。大鼠靜脈注射400 IU/kg肝素鈉,活化凝血時間達到400~450 s時,開始CPB。本實驗采用無血預充方法制備CPB模型,因此需配置15 ml緩沖液填充CPB管路。成分:6%羥乙基淀粉12 ml、20%甘露醇1 ml、5%NaHCO32 ml和肝素鈉150 IU/kg。全部CPB系統由以下各部分組成:連接頸內靜脈處的血液輸出管、容量為10 ml的儲血槽、恒流蠕動泵、用于氣體交換的膜式氧合器、連接尾動脈的輸入端。儲血器固定于低于大鼠心臟平面40 cm的位置,以便達到理想的引流量。將新配制的15 ml緩沖液緩慢加至CPB管路中,排空氣泡。打開引流管處的開關,將血液從心房引流至儲血器中,起初轉流量為25~30 ml/(kg·min),緩慢增加達到100~150 ml/(kg·min),此時儲血器中血液平面維持在3~4 ml為宜。CPB開始后將氧氣接口與膜肺相連,關閉小動物呼吸機。轉流期間,依照血氣分析結果調整用藥,使之達到MAP>60 mmHg、pH值7.35~7.45、PaCO235~45 mmHg、堿剩余(BE)-3~3 mmol/L的穩定狀態。轉流達到1 h后,緩慢減小轉流量直至停止,啟動呼吸機,重新恢復機械通氣。保留右股靜脈及尾動脈的套管針,以便輸液和測量血壓。其余管道拔除并結扎血管,縫合切口。嚴密監測大鼠生命體征,必要時回輸管路中血液,應用多巴胺等維持血流動力學穩定。轉流過程中,根據足底反射反應適量追加水合氯醛100 mg/kg。
從回歸方程中,可以看出中國乳制品的進口需求價格彈性系數為0.585,需求的價格彈性小于1,需求缺乏彈性。這說明在其他條件不變的情況下,根據需求的彈性理論,即中國乳制品的價格每上升1%,則相應的乳制品進口量就下降0.585%。由此可以看出,中國乳制品進口的價格對乳制品的進口量雖然有一定影響,但影響程度不大,即價格因素并不是影響乳制品進口的關鍵因素,進口乳制品在中國已經占據較為穩定的市場。
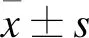
2 結果
2.2 各組大鼠血清IL-6、TNF-α濃度比較 T2~T4時,CPB組和DC組大鼠血清中IL-6、TNF-α濃度高于Sham組(P<0.05),DC組大鼠血清中IL-6、TNF-α濃度低于CPB組(P<0.05)。見表2、表3。
2.1 各組大鼠血清S100-β濃度比較 T2~T4時,CPB組和DC組大鼠血清中S100-β濃度高于Sham組(P<0.05),DC組大鼠血清中S100-β濃度低于CPB組(P<0.05)。見表1。
右美托咪定作用于藍斑核神經元的α2AR,抑制神經沖動發生,阻斷興奮向下游傳導,發揮鎮靜作用;通過調節神經炎癥反應,明顯減輕脊髓損傷后的組織損傷并改善神經系統結局[7-9];通過抗氧化應激和調節炎性反應,能夠明顯減輕糖尿病大鼠短暫的全腦缺血再灌注損傷[10]。
傳統的鉆井施工經驗及模式在施工中根深蒂固,抓住“三個一”精準化鉆井施工模式這一關鍵,推動“五個轉變”,實現鉆井工作的高端化。
2.4 各組大鼠海馬區腦組織TLR4和NF-κB蛋白表達比較 與Sham組比較,CPB組和DC組海馬區腦組織TLR4、NF-κB蛋白表達上調(P<0.05);與CPB組比較,DC組海馬區腦組織TLR4、NF-κB蛋白表達下調(P<0.05)。見圖1~圖4。
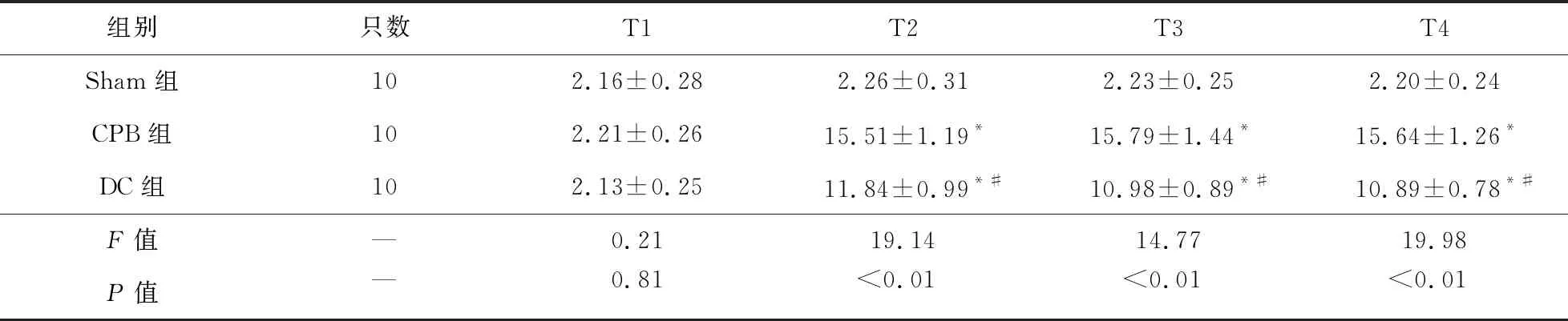
表1 不同時間點各組大鼠血清S100-β濃度比較(pg/ml)
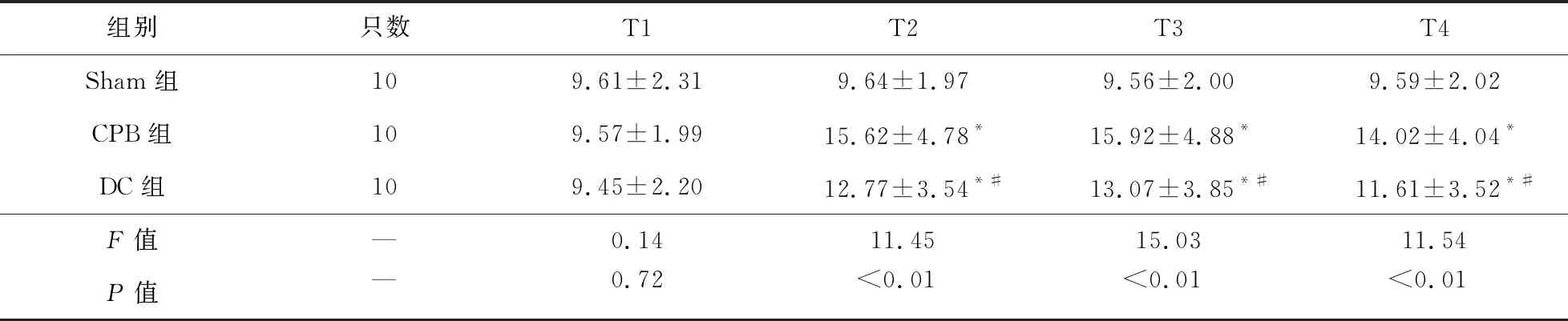
表2 各組大鼠不同時間點血清IL-6濃度比較(pg/ml)
表3 各組大鼠不同時間點血清TNF-α濃度比較(ng/ml)
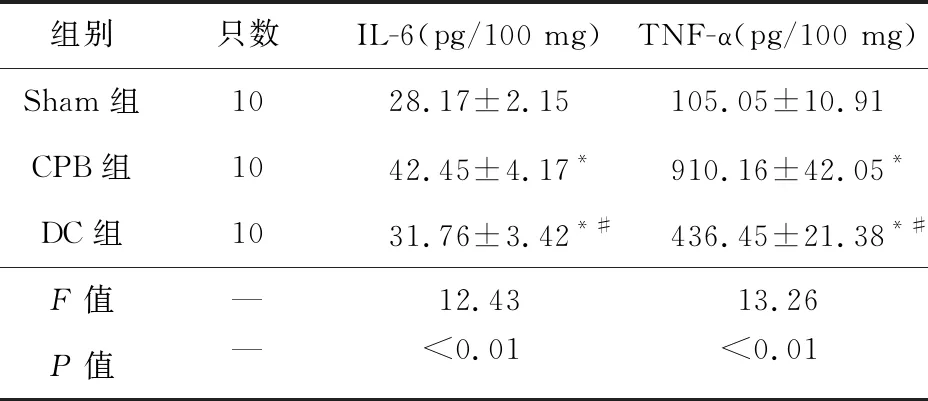
表4 各組大鼠海馬區腦組織IL-6、TNF-α濃度比較

圖1 各組大鼠海馬區TLR4蛋白表達情況

圖2 各組大鼠海馬區TLR4蛋白表達情況
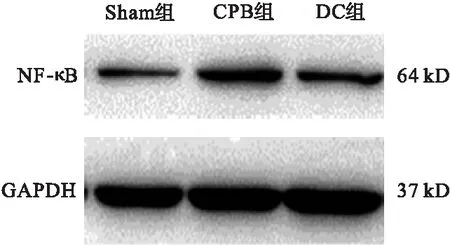
圖3 各組大鼠海馬區NF-κB蛋白表達情況
3 討論
2.3 各組大鼠海馬區腦組織IL-6、TNF-α水平比較 CPB組、DC組海馬區腦組織IL-6、TNF-α水平高于Sham組(P<0.05),DC組海馬區腦組織IL-6、TNF-α水平低于CPB組(P<0.05)。見表4。
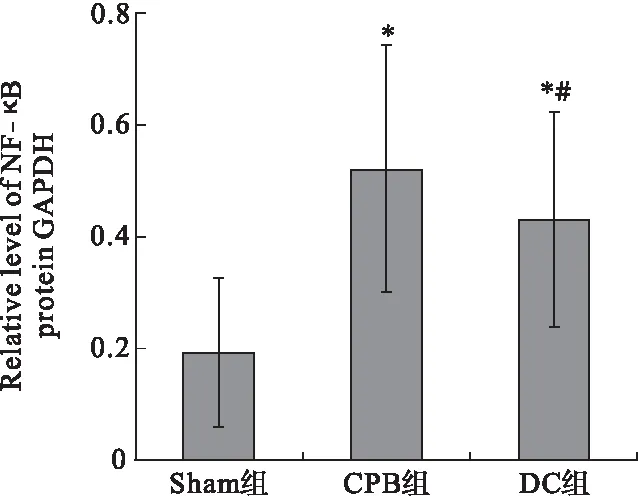
圖4 各組大鼠海馬區NF-κB蛋白表達情況
S100-β作為腦損傷標志物具有高度特異性,對評定早期腦損害有重要價值。Kanbak等[11]對CPB下行冠狀動脈搭橋手術患者研究發現,CPB能明顯增加患者血清中S100-β濃度。本研究發現,CPB開始便可觸發腦內S100-β釋放入血,隨著時間發展有明顯上升趨勢,右美托咪定可顯著降低血中S100-β水平,減輕CPB致腦損傷。
TLR4是最先被人類研究發現的Toll樣受體家族蛋白[12],廣泛存在于人類各器官免疫系統中。在中樞神經系統中,雖然兩種膠質細胞均有TLR4表達,但是僅小膠質細胞表面受體與配體結合才能觸發炎癥反應,釋放TNF-α、IL-6等炎癥因子[13]。除參與炎癥反應外,TLR4還介導多個重要器官的缺血再灌注損傷[14]。
體外循環腦損傷機制尚未明確,主要研究熱點集中于炎癥和缺血再灌注損傷。在整個腦缺血再灌注損傷病程中,腦內防御細胞,如小膠質細胞、星形膠質細胞等釋放大量熱休克蛋白、β淀粉樣蛋白、透明質酸等作用于小膠質細胞表面并與TLR4結合,進一步激活TLR4相關信號傳導通路,產生炎性物質,觸發炎癥反應。Hyakkoku等[15]的研究指出,大腦中動脈閉塞120 min,恢復血供1 d后,相比野生型小鼠,TLR4無功能性突變鼠的腦梗死范圍明顯減小,同時,缺血再灌注后的神經損害得到改善。此外,缺血再灌注后TLR4無功能性突變鼠的NF-κB p65亞基明顯減少,證明TLR4基因敲除在小鼠缺血再灌注模型中發揮神經保護作用。另外,研究大鼠局灶性缺血再灌注模型發現,針刺足三里穴位能夠有效對抗缺血再灌注損傷后炎癥反應,減少TLR4/NF-κB通路下游TNF-α、IL-1β、IL-6的產生[14],由此證明TLR4和NF-κB通路參與腦組織缺血再灌注損傷的發生與發展。本研究表明,體外循環后海馬區腦組織TNF-α和 IL-6水平、TLR4和NF-κB蛋白表達明顯增加,CPB前和CPB過程中靜脈輸注右美托咪定能有效下調海馬區腦組織TNF-α和 IL-6水平、TLR4和NF-κB蛋白表達。有研究在大鼠敗血癥模型中發現,應用α2AR拮抗劑阿替美唑可對抗右美托咪定下調TLR4的作用[16]。因此,我們推測腦內右美托咪定下調TLR4和NF-κB的機制也可能與其激活α2腎上腺素受體有關。該推測有待后續研究給予證實。
綜上所述,右美托咪啶通過抑制TLR4信號轉導通路,減少其下游IL-6、TNF-α水平和NF-κB蛋白表達,從而發揮腦保護作用。

