外源ATP對鹽脅迫下油菜種子萌發(fā)及幼苗生長的影響
梁娟紅,李巧麗,賴 晶,張小花,張騰國
(西北師范大學生命科學學院,甘肅 蘭州 730070)
5’-三磷酸腺苷(adenosine-5’-triphosphate, ATP)作為一種高能化合物,是生物體內(nèi)進行正常物質(zhì)代謝和能量代謝的直接能量來源。已有研究發(fā)現(xiàn),細胞外基質(zhì)中也存在ATP,即胞外ATP(extracellular ATP,eATP),它可以作為一種重要的信使分子,通過特定的細胞信號轉(zhuǎn)導機制參與植物對生物、非生物脅迫的響應過程[1]。Luattge等[2]研究發(fā)現(xiàn)施加ATP能夠促進燕麥葉片維管束鞘細胞對K+的吸收。此外施加ATP還增強了核酸內(nèi)切酶的活性[3]。也有研究表明:增加細胞外ATP濃度會抑制擬南芥根的向重力性,跨膜ATP濃度會破壞生長素極性運輸[4],導致花粉不萌發(fā)以及抑制花粉管生長[5]。另外,外源ATP還參與次生代謝物的積累[6]、細胞凋亡[7]、脅迫抗性[8]等生理過程。但關(guān)于外源ATP對種子萌發(fā)及抗鹽性的影響鮮見報道。

植物液泡為儲存Na+提供了一個比較大的空間,液泡膜中的鈉-氫交換蛋白(NHX)可以將細胞質(zhì)中的Na+螯合到液泡中,降低細胞質(zhì)中Na+濃度,減少過量Na+對植物的毒害[12]。第一個NHX轉(zhuǎn)運體基因是在擬南芥中克隆并命名為AtNHX1[13]。研究發(fā)現(xiàn),NHX也會影響植物體內(nèi)K+的區(qū)室化。過表達AtNHX1基因的番茄在鹽脅迫條件下促進了K+從地下向地上運輸,液泡中K+濃度上升,細胞間Na+/K+降低,從而有效降低鹽脅迫對過表達番茄的鹽害作用[14]。Zhao等[15]在兩種耐鹽性不同的楊樹中研究發(fā)現(xiàn),外源ATP的施用顯著降低了兩種楊樹中鹽誘導的K+外流,觸發(fā)鹽敏感植株中的SOS(鹽超敏感信號轉(zhuǎn)導途徑)信號級聯(lián)反應,并有助于鹽度下Na+穩(wěn)態(tài)的控制。除此之外,在植物響應鹽脅迫過程中SOS信號途徑也發(fā)揮著重要的作用,其中SOS1是參與Na+從細胞質(zhì)向質(zhì)外體轉(zhuǎn)運的關(guān)鍵基因[16],在細胞膜上編碼Na+/H+逆向轉(zhuǎn)運蛋白,在種子萌發(fā)過程中起重要作用,處于鹽脅迫條件下也能幫助植物更好地生長發(fā)育[17]。Jeter等[18]研究發(fā)現(xiàn),在擬南芥中,ATP的外源處理可以激活MAP激酶途徑以及參與乙烯生物合成和信號轉(zhuǎn)導蛋白的轉(zhuǎn)錄物水平。同時,MAP激酶級聯(lián)途徑也參與抗鹽調(diào)控過程。有研究表明,MEKK1-MKK2-MPK4/MPK6級聯(lián)途徑可以參與鹽脅迫下擬南芥的信號響應過程[19],而MKK9-MPK3/MPK6級聯(lián)途徑參與調(diào)節(jié)乙烯的合成并在擬南芥對鹽脅迫的響應中發(fā)揮作用[20]。
隨著冬油菜北移技術(shù)的成功示范,白菜型冬油菜(Brassicacampestris)已成為北方寒旱區(qū)主要的油料作物和生態(tài)作物[21]。但北方土壤廣泛存在不同程度的鹽漬化,嚴重影響了冬油菜的生長發(fā)育和高產(chǎn)潛力的發(fā)揮[22]。因此,本文以白菜型冬油菜‘隴油8號’為材料,研究外源ATP浸種對NaCl脅迫處理下油菜種子萌發(fā)、幼苗生理及相關(guān)基因表達(MAPK3和MAPK6、SOS1和NHX1)的影響,為提高油菜抗鹽性提供理論依據(jù)。
1 材料與方法
1.1 試驗材料處理及培養(yǎng)
挑選籽粒飽滿、大小均一的‘隴油8號’種子(由甘肅農(nóng)業(yè)大學農(nóng)學院提供)用自來水反復沖洗,室溫下浸泡2 h,再進行以下處理。(1)不同濃度的外源ATP溶液浸種處理:將種子分別置于濃度為0、1、10、25、50、100 μmol·L-1的外源ATP溶液中,于(25±1)℃培養(yǎng)箱黑暗浸種12 h;浸種后的種子用0.5%的次氯酸鈉消毒5 min,無菌水沖洗5~6次后接種到1/2 MS固體培養(yǎng)基中,每個培養(yǎng)皿中放置30粒種子,置于(25±1)℃、光照強度為250 μmol·(m2·s)-1、光照周期16 h/8 h(光照/黑暗)的培養(yǎng)箱(RDN型人工氣候箱)中培養(yǎng)。每個處理5個重復。(2)CK:將油菜種子置于1/2 MS固體培養(yǎng)基中,培養(yǎng)條件與(1)處理相同。(3) NaCl單獨處理:將油菜種子置于含200 mmol·L-1NaCl的1/2 MS固體培養(yǎng)基中,培養(yǎng)條件與(1)處理相同。(4)ATP+NaCl復合處理:用25 μmol·L-1外源ATP溶液,按照(1)處理的方法浸種。用上述方法接種于含200 mmol·L-1NaCl的1/2 MS固體培養(yǎng)基中,培養(yǎng)條件與(1)處理相同。
1.2 種子萌發(fā)相關(guān)指標的測定
培養(yǎng)3 d后觀察種子萌發(fā)情況,以胚根凸出種皮長度大于等于種子長度作為發(fā)芽標志,計算發(fā)芽勢。處理7 d后觀察種子發(fā)芽情況,再以上述方法觀察種子的萌發(fā)情況,計算發(fā)芽率。
1.3 生理指標的測定
取培養(yǎng)7 d的油菜幼苗地上部分進行后續(xù)試驗。幼苗根長與株高測定參照田夢雨[23]的方法;過氧化氫(H2O2)含量測定參照Yin等[24]的方法;羥自由基(·OH)含量測定參照Halliwell[25]的方法;丙二醛(MDA)含量測定參照硫代巴比妥酸法[26];相對電導率測定參照電導率儀法[27];游離脯氨酸含量測定參照磺基水楊酸法[28];可溶性糖含量測定參照蒽酮顯色法[29]。
1.4 活性膠電泳及染色
活性膠制備參照Lammli[30]的方法。采用5%的濃縮膠和12%的分離膠。CAT上樣量為6 μL,POD上樣量為9 μL。濃縮膠電壓為80 V,分離膠電壓為120 V,冰浴中穩(wěn)壓電泳約5~6 h。
CAT活性染色參照 Woodbury等[31]的方法;POD同工酶活性膠染色參照黃永芬等[32]的醋酸聯(lián)苯胺方法。
1.5 實時熒光定量PCR
油菜幼苗總RNA的提取采用TaKaRa MiniBEST Plant RNA Extraction Kit試劑盒,參照試劑盒實驗步驟操作。以提取的總RNA為模板,參照反轉(zhuǎn)錄試劑盒合成cDNA。以Actin-F、Actin-R為管家基因引物,MAPK3-F和MAPK3-R為MAPK3引物,MAPK6-F和MAPK6-R為MAPK6引物,SOS1-F和SOS1-R為SOS1引物,NHX1-F和NHX1-R為NHX1引物(表1),按照熒光定量PCR試劑盒SYBR Premix Ex TaqTM(購自TaKaRa公司)的操作步驟用25 μL體系進行擴增檢測。采用2-ΔΔCt方法分析數(shù)據(jù),計算基因的相對表達量。
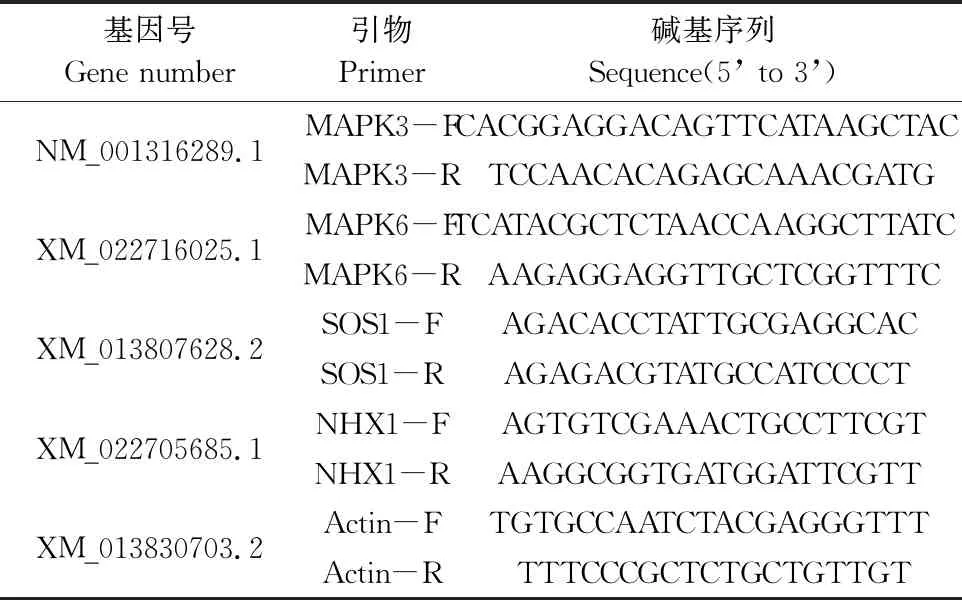
表1 PCR引物序列
1.6 數(shù)據(jù)處理
試驗數(shù)據(jù)使用SPSS 20.0軟件進行統(tǒng)計分析,用Excel 2010軟件作圖。
2 結(jié)果與分析
2.1 不同濃度外源ATP浸種對油菜種子發(fā)芽率和發(fā)芽勢的影響
由表2可知,與CK相比較,發(fā)芽勢和發(fā)芽率均隨外源ATP濃度增大呈先升后降的趨勢。當外源ATP濃度為25 μmol·L-1時,發(fā)芽勢和發(fā)芽率達到最大值,分別比CK提高26.9%和17.2%。結(jié)果表明,外源ATP濃度在一定范圍內(nèi)對種子萌發(fā)具有促進作用,而25 μmol·L-1的外源ATP處理效果最明顯。

表2 不同濃度外源ATP對油菜種子發(fā)芽率和發(fā)芽勢的影響
2.2 外源ATP浸種對NaCl脅迫處理下油菜種子發(fā)芽率和發(fā)芽勢的影響
如表3所示,與CK相比,200 mmol·L-1NaCl脅迫處理顯著抑制了油菜種子萌發(fā),發(fā)芽率、發(fā)芽勢分別下降了13.5%、4.7%;ATP+NaCl復合處理下的種子萌發(fā)情況顯著優(yōu)于NaCl單獨處理,其發(fā)芽率、發(fā)芽勢分別提高了13.7%和15.0%。結(jié)果表明,NaCl脅迫處理顯著抑制了油菜種子萌發(fā),而ATP浸種能顯著緩解NaCl脅迫對油菜種子萌發(fā)的抑制作用。
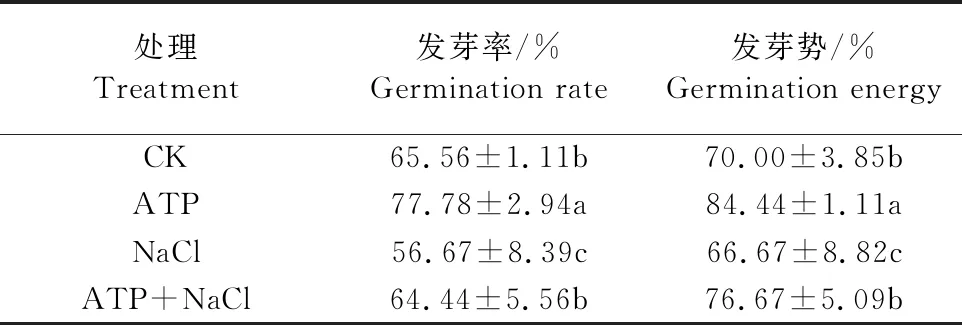
表3 外源ATP 浸種對NaCl脅迫處理下 油菜種子萌發(fā)的影響
2.3 外源ATP浸種對NaCl脅迫處理下油菜幼苗生物量的影響
如表4所示,200 mmol·L-1NaCl脅迫處理下的油菜幼苗根長、株高及鮮重均低于CK且鮮重顯著下降;ATP+NaCl復合處理下的油菜幼苗根長、株高及鮮重相較于NaCl單獨處理分別升高了23.6%、27.3%、28.6%。結(jié)果表明,NaCl脅迫處理能抑制油菜幼苗生長和生物量積累,外源ATP浸種能夠緩解NaCl脅迫處理對油菜幼苗的抑制作用。
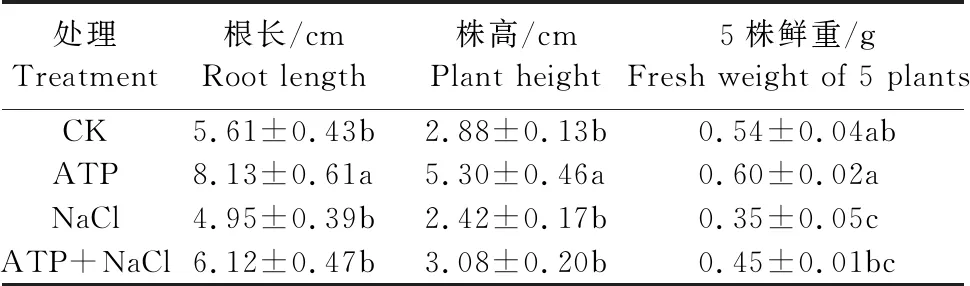
表4 外源ATP浸種對NaCl脅迫處理下 油菜幼苗生物量的影響
2.4 外源ATP浸種對NaCl脅迫處理下油菜幼苗生理特性的影響
2.4.1 外源ATP浸種對NaCl脅迫處理下油菜幼苗H2O2和·OH含量的影響 如圖1顯示,與CK相比,外源ATP浸種、NaCl脅迫處理均顯著誘導油菜幼苗中H2O2(圖1A)和·OH(圖1B)的產(chǎn)生;ATP+NaCl復合處理與NaCl單獨脅迫處理相比,H2O2和·OH的含量分別降低了13.6%和6.3%。結(jié)果表明,NaCl脅迫處理顯著促進了油菜幼苗中ROS的積累,而外源ATP浸種能夠降低NaCl脅迫處理下油菜中活性氧(ROS)含量,緩解鹽脅迫對油菜幼苗的損傷。
2.4.2 外源ATP浸種對NaCl脅迫處理下油菜幼苗CAT和POD活性的影響 由圖2A可知,不同處理下CAT同工酶條帶數(shù)相同,有且僅有一條帶,在外源ATP浸種、NaCl單獨脅迫處理下,油菜幼苗CAT酶帶相對灰度比CK分別高3.0%和16.0%;ATP+NaCl處理下的CAT酶帶相對灰度比NaCl單獨脅迫處理高10.3%。如圖2B所示,4個處理下的POD有5條同工酶帶,但同一酶帶在不同處理下有差異。NaCl脅迫處理下油菜幼苗POD酶帶相對灰度比CK高89.0%;ATP+NaCl處理下POD同工酶條帶相對灰度比NaCl單獨處理高27.0%。結(jié)果表明,外源ATP浸種、NaCl脅迫處理都會提高CAT、POD酶活性水平;外源ATP浸種進一步提高了NaCl脅迫下油菜幼苗中的CAT、POD酶活性,增強了油菜幼苗對體內(nèi)過量ROS的清除能力。
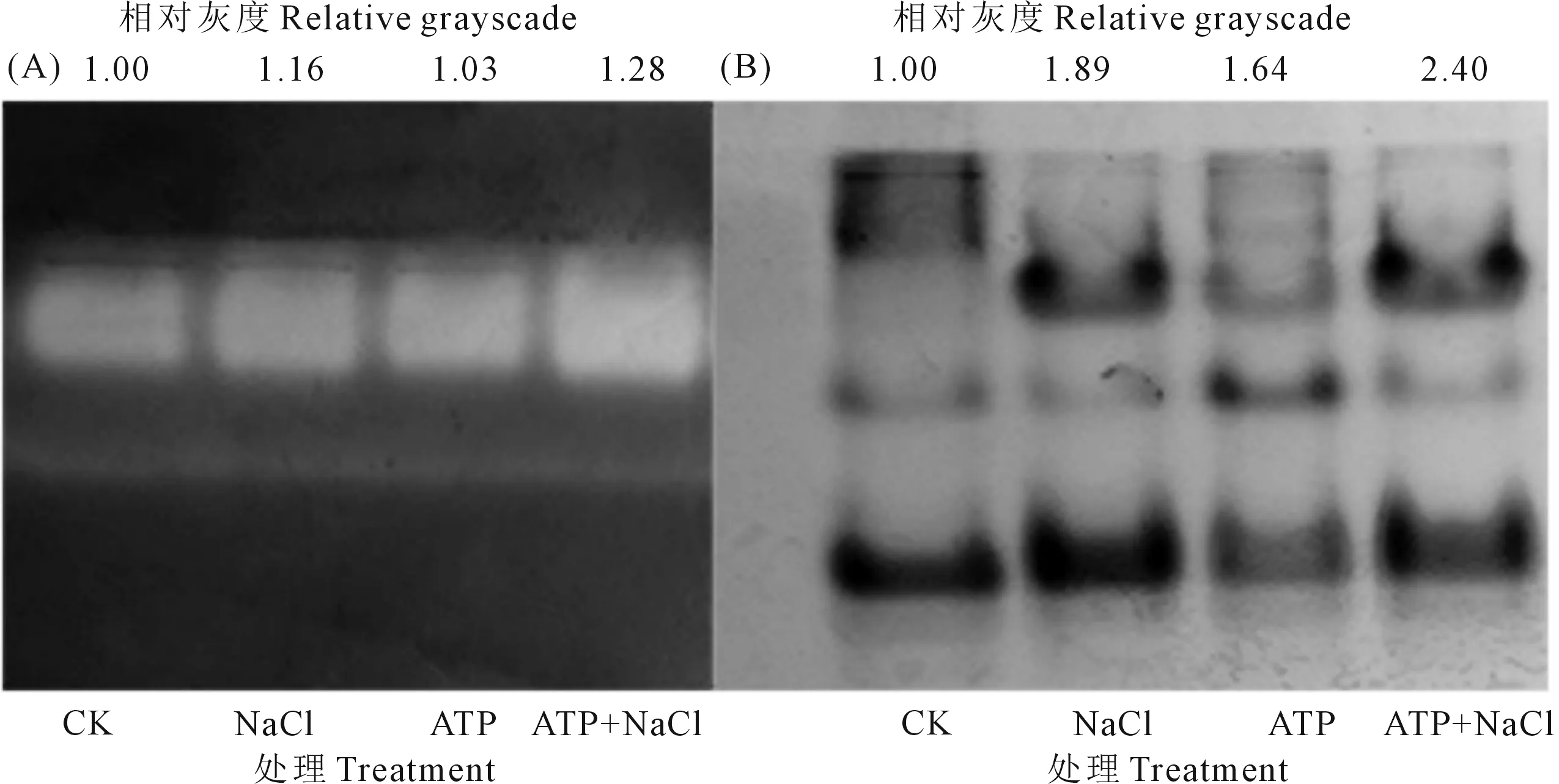
圖2 鹽脅迫處理下外源ATP浸種的油菜幼苗CAT(A)和POD(B)電泳圖及相對灰度分析Fig. 2 Electrophoresis and relative grayscale analysis of antioxidant enzymes in Brassica campestris seedling under NaCl stress by exogenous ATP seed soaking
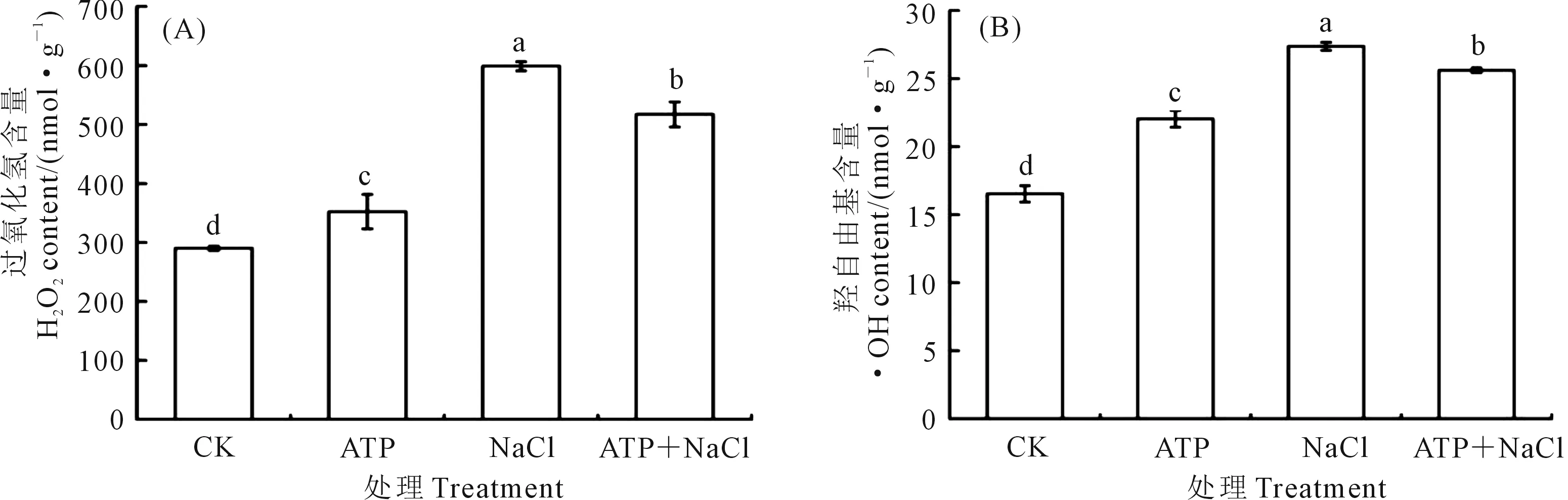
注:不同小寫字母表示處理間差異顯著(P<0.05)。下同。Note: Different lowercase letters in theFigure indicate significant differences among treatments (P<0.05). The same below.圖1 NaCl脅迫處理下外源ATP浸種的油菜幼苗中H2O2 (A)和·OH (B)含量Fig.1 H2O2 (A) and ·OH (B) accumulation of Brassica campestris seedling exposed under NaCl stress by exogenous ATP seed soaking
2.4.3 外源ATP浸種對NaCl脅迫處理下油菜幼苗膜損傷程度的影響 逆境條件下,MDA和相對電導率能夠作為細胞損傷程度的指標。從圖3可以看出,與CK相比,NaCl脅迫顯著增加了油菜中的MDA含量(圖3A)和相對電導率(圖3B),表明NaCl脅迫可以加劇油菜幼苗的膜脂過氧化程度。外源ATP浸種顯著降低了NaCl脅迫處理下的MDA含量和相對電導率,MDA含量降低了27.6%,相對電導率降低了20.5%。結(jié)果表明,外源ATP浸種可以降低NaCl脅迫處理下油菜中的MDA含量和相對電導率,減少膜脂過氧化程度和電解質(zhì)的滲漏,保護細胞膜的完整性,減輕鹽脅迫對油菜的損傷。
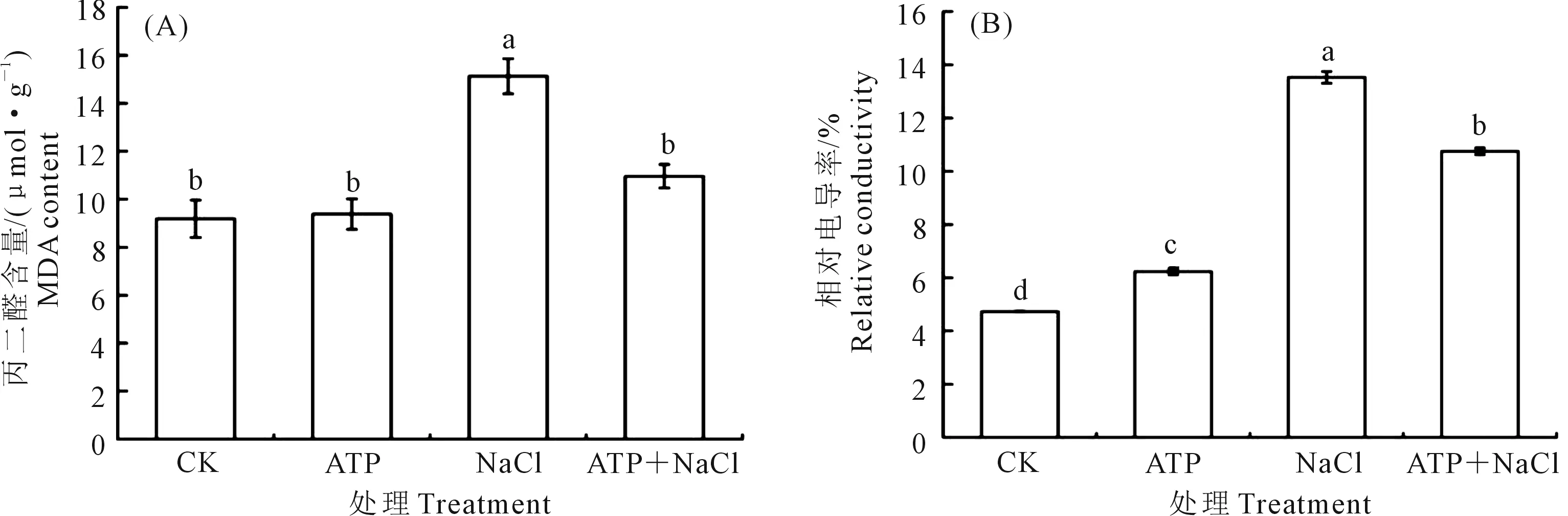
圖3 外源ATP浸種對NaCl脅迫處理下油菜幼苗中丙二醛(A)和相對電導率(B)的影響Fig.3 Effects of seed soaking with exogenous ATP on malondialdehyde (A) and relative conductivity (B) of Brassica campestris seedling under NaCl stress
2.4.4 外源ATP浸種對NaCl脅迫處理下油菜滲透調(diào)節(jié)物質(zhì)的影響 可溶性糖和脯氨酸是細胞內(nèi)重要的滲透調(diào)節(jié)物質(zhì),可保護細胞內(nèi)蛋白分子,穩(wěn)定生物大分子結(jié)構(gòu)。如圖4可見,NaCl脅迫處理、ATP+NaCl復合處理都顯著增加了油菜幼苗中可溶性糖(圖4A)和脯氨酸(圖4B)含量,NaCl脅迫處理下可溶性糖、脯氨酸含量分別達到CK的187.8%和459.5%;ATP+NaCl復合處理下油菜幼苗中可溶性糖和脯氨酸含量分別達到NaCl脅迫處理的15.9%和41.0%。結(jié)果表明,NaCl脅迫處理下外源ATP浸種能顯著增加油菜幼苗中滲透調(diào)節(jié)物質(zhì)積累,增強細胞的持水能力,維持細胞的正常生理代謝,從而增強油菜幼苗的耐鹽性。
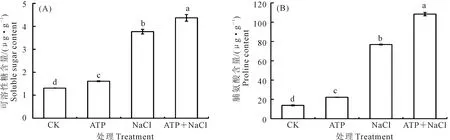
圖4 外源ATP浸種對NaCl脅迫處理下油菜幼苗中可溶性糖(A)和脯氨酸(B)的影響Fig.4 Effects of seed soaking with exogenous ATP on soluble sugar (A) and proline (B) content of Brassica campestris seedling under NaCl stress
2.5 外源ATP浸種對NaCl脅迫處理下油菜幼苗相關(guān)基因表達的影響
2.5.1 外源ATP浸種對NaCl脅迫處理下油菜幼苗MAPK3/MAPK6基因表達的影響 如圖5所示,外源ATP處理下的油菜幼苗中MAPK3(圖5A)和MAPK6(圖5B)基因表達量分別較CK增加16.0%、7.0%。在NaCl單獨脅迫處理下的MAPK3和MAPK6基因表達量分別較CK增加86.0%和69.0%。ATP+NaCl處理下的MAPK3和MAPK6基因表達量分別較NaCl單獨脅迫處理增加75.3%、146.2%。結(jié)果表明,油菜幼苗中MAPK3和MAPK6基因的表達水平受到NaCl脅迫處理的誘導,外源ATP浸種增強了NaCl脅迫處理下油菜幼苗中MAPK3和MAPK6基因的表達。
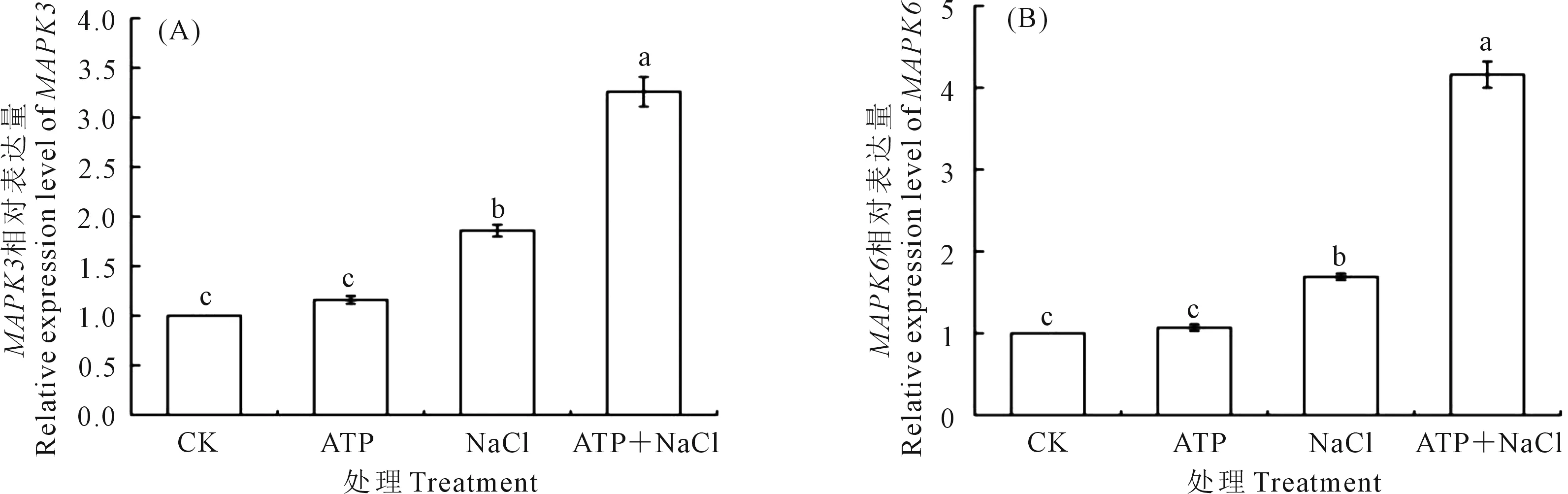
圖5 外源ATP浸種對NaCl脅迫處理下油菜幼苗中MAPK3(A)和MAPK6(B)基因表達的影響Fig.5 Effects of seed soaking with exogenous ATP on the expression of MAPK3 (A) and MAPK6 (B) genes in Brassica campestris seedling under NaCl stress
2.5.2 外源ATP浸種對NaCl脅迫處理下油菜幼苗SOS1/NHX1基因表達的影響 如圖6所示,NaCl脅迫處理下的油菜幼苗中NHX1(圖6A)和SOS1(圖6B)基因表達量上調(diào),分別是CK的1.41倍和1.34倍。與NaCl單獨脅迫處理相比,ATP+NaCl處理下的油菜幼苗中NHX1和SOS1基因表達量分別上升了17.0%和66.4%。結(jié)果表明:油菜幼苗中NHX1和SOS1基因的表達受到NaCl脅迫處理的誘導,外源ATP浸種進一步提高了NaCl脅迫處理下油菜幼苗中NHX1和SOS1基因的表達。
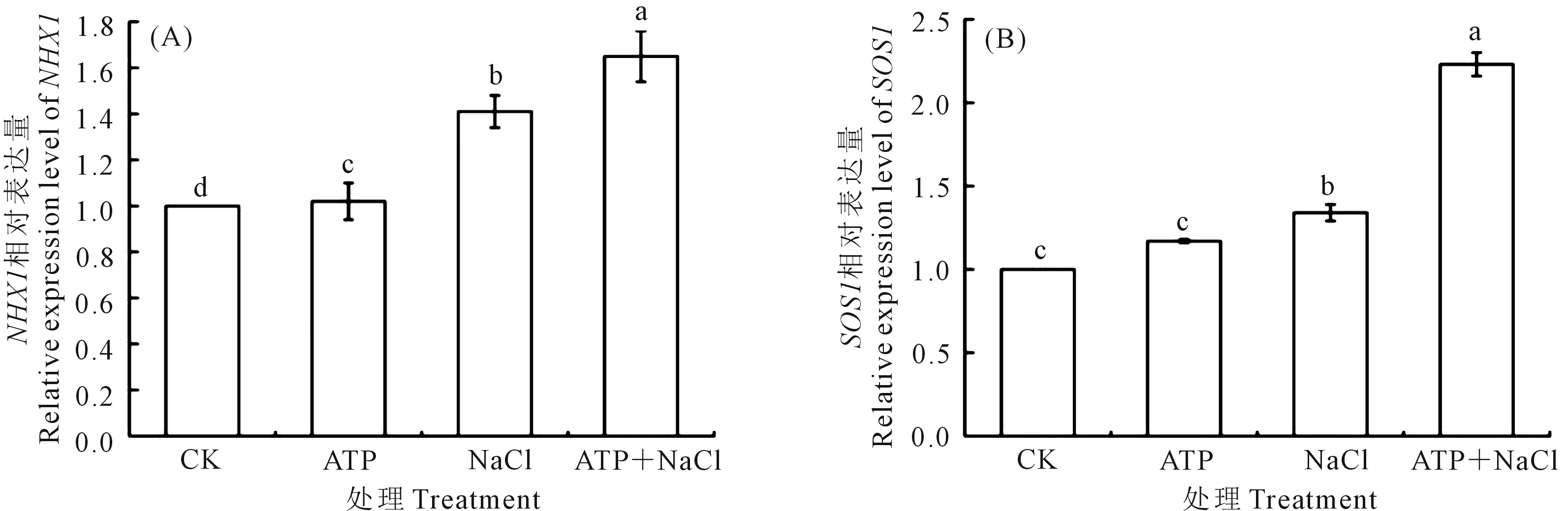
圖6 外源ATP浸種對NaCl脅迫處理下油菜幼苗NHX1(A)和SOS1(B)基因表達的影響Fig.6 Effects of seed soaking with exogenous ATP on the expression of NHX1 (A) and SOS1 (B) genes in Brassica campestris seedling under NaCl stress
3 討論與結(jié)論
鹽脅迫對植物的危害包含離子脅迫和滲透脅迫。斯琴巴特爾等[33]研究玉米(Zeamays)種子萌發(fā)時發(fā)現(xiàn)鹽脅迫抑制了玉米種子的發(fā)芽。孫君艷等[34]研究鹽脅迫對小麥種子萌發(fā)及幼苗生長的影響,發(fā)現(xiàn)高濃度鹽處理對小麥種子萌發(fā)和幼苗生長起抑制作用。Chivasa等[35]研究結(jié)果表明:細胞外ATP可能通過直接或間接的方式與細胞膜外的某種蛋白質(zhì)結(jié)合,從而在脅迫條件下提高細胞生存率。本試驗結(jié)果發(fā)現(xiàn),200 mmol·L-1NaCl處理對油菜種子萌發(fā)有抑制作用,而25 μmol·L-1的外源ATP對油菜種子萌發(fā)有顯著的促進作用,并能夠提高油菜幼苗的生物量積累,外源ATP浸種能緩解NaCl處理對油菜種子萌發(fā)的抑制作用。
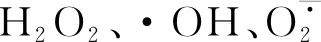
植物在遭受鹽脅迫時會觸發(fā)一系列抗鹽相關(guān)基因的表達,如NHX和SOS基因的表達。液泡型Na+/H+逆向轉(zhuǎn)運蛋白(NHX1)可以將細胞質(zhì)中的Na+逆Na+濃度梯度轉(zhuǎn)運到液泡中進行區(qū)室化,質(zhì)膜型Na+/H+逆向轉(zhuǎn)運蛋白(SOS1)也可以將Na+排到胞外,防止細胞質(zhì)中的細胞器受到Na+的危害。過表達OsNHX1轉(zhuǎn)基因水稻細胞在鹽條件下存活較好,生長速度和總Na+含量顯著高于野生型[38]。本研究發(fā)現(xiàn),油菜幼苗中NHX1、SOS1基因的表達受到鹽脅迫的誘導,而外源ATP浸種提高了鹽脅迫處理下油菜幼苗中NHX1、SOS1基因的表達,NHX1和SOS1轉(zhuǎn)錄水平的提高,預示著外源ATP處理觸發(fā)了NHX基因家族和SOS途徑介導的Na+外排。MAPK信號級聯(lián)途徑在植物應對鹽、干旱、寒冷、炎熱和受傷等信號過程中發(fā)揮著十分重要的作用,主要是MAPK3、MAPK4和MAPK6被快速激活[39]。Teige等[20]研究發(fā)現(xiàn),冷和鹽脅迫激活擬南芥的MKK2,控制冷應答基因(COR)的表達,調(diào)控植物耐冷和耐鹽能力。而且,MKK2上游的MEKK1和下游的MPK4和MPK6都能被各種脅迫所激活。在本研究結(jié)果中,油菜幼苗中MAPK3、MAPK6基因的表達受到鹽脅迫的誘導,而外源ATP浸種提高了鹽脅迫處理下油菜幼苗中MAPK3、MAPK6基因的表達。以上這些研究結(jié)果表明,外源ATP在調(diào)節(jié)植物響應鹽脅迫的過程中,鹽超敏感 (SOS)通路以及MAPK激酶途徑等多種信號傳導途徑之間可能存在交叉對話。
綜上所述,外源ATP浸種通過激活ROS清除系統(tǒng)來有效地清除過量的ROS,降低NaCl脅迫處理下油菜幼苗膜脂過氧化程度,促進滲透調(diào)節(jié)物質(zhì)的積累及抗鹽脅迫相關(guān)基因的表達,有效保證油菜幼苗代謝活動的正常進行,從而提高油菜幼苗的抗鹽性。

