人參皂苷Rb1對A β1-42導致的Tau蛋白異常磷酸化的影響
楊淑達,于浩飛,張蘭春,李 媛,耿藝娟,張榮平,胡煒彥
昆明醫科大學 藥學院暨云南省天然藥物藥理重點實驗室,昆明650500
阿爾茨海默病(Alzheimer’s disease,AD),又叫老年性癡呆,是一種中樞神經系統慢性退行性疾病。Tau蛋白過度磷酸化形成的神經原纖維纏結為其特征性病理改變之一。正常人的大腦中微管相關蛋白(protein Tau)與磷酸化微管相關蛋白(P-Tau)處于相對平衡狀態,但在AD患者,Tau蛋白處于過度磷酸化狀態,參與了神經原纖維纏結(neurofibrillary tangle,NFT)的形成,并且AD病人的癡呆程度與NFT的數目密切相關[1-4]。
人參皂苷是我國傳統的名貴中草藥材——人參中的一類主要的有效成分,約占4%,研究表明:人參皂苷在調節中樞神經系統功能方面,具有增強記憶和認知功能的作用,是研究中藥抗癡呆的熱點之一[5-7]。Rb1、Rg1同屬于人參皂苷的單體之一,國內外文獻對Rb1和Rg1的報道較多,對人參皂苷Rb1在AD微管相關蛋白(Tau)異常磷酸化中的作用有一些報道,但多是針對Aβ25-35誘導的神經元[8-10]或神經干細胞分化過程中[11]Tau蛋白磷酸化的影響,限于細胞水平,對Aβ1-42誘導的組織水平Tau磷酸化的影響卻鮮有報道。本實驗參照國內外有關文獻[12,13],采用Aβ1-42誘導小鼠海馬神經元和離體腦片的方法,建立Tau蛋白過度磷酸化的模型,觀察人參皂苷Rb1對Aβ1-42所致小鼠海馬神經元呵和腦片微管相關蛋白(Tau)異常磷酸化的抑制作用及其可能機制,旨在豐富人參皂苷Rb1抑制β淀粉樣蛋白誘導神經元Tau蛋白過度磷酸化的機制研,為含人參皂苷Rb1藥物在抗癡呆治療中的應用提供實驗基礎。
1 材料
1.1 實驗動物
清潔級C57小鼠,雄性10只,雌性E18天孕鼠5只,鼠齡均為8周,由昆明醫科大學實驗動物學部提供(合格證號:SCXK(滇)-2011004)。
1.2 藥物與試劑
人參皂苷Rb1(云南植物藥業有限公司,批號:20171201,純度98.5%),使用前溶于生理鹽水配成濃度分別為10、50和250 mg/mL的三種溶液。Aβ1-42(Peptide公司,純度98%),使用前溶于生理鹽水中,配制成1mg/mL溶液待用。Tau[pS202](Thermo公司);Tau[pS199]、Tau[pS396]、Erk1/2、p-Erk1/2和β-actin抗體(SIGMA公司);Tau多克隆抗體(DAKO公司);Tuj1抗體(Abcam公司);熒光二抗(Invitrogen公司);DAPI染色液(碧云天公司)。
2 方法
2.1 離體海馬腦片的制備
小鼠用6%水合氯醛麻醉(400 mg/kg),斷頭,冰上迅速切開頭皮,暴露顱骨,取出全腦,置于經95% CO2和5% CO2混合氣體飽和的人工腦脊液冰水混合物中,用振動切片機(WPI,Sarasota,FL,USA)行冠狀切制海馬腦片(厚度350 μm)。海馬腦片置盛有95% CO2和5 % CO2混合氣體飽和的人工腦脊液中孵育培養(溫度32±0.5 ℃)。人工腦脊液成分(mmol/L):(NaCl 126、KCl 2.5、NaH2PO41、CaCl22.5、MgSO41.5、NaHCO326和glucose 10)。
2.2 實驗分組和給藥
將海馬腦片分為模型組、人參皂苷Rb1高、中、低劑量組和試劑空白組,各組腦片分別置盛有95% CO2和5% CO2混合氣體飽和的人工腦脊液中孵育培養(溫度32±0.5 ℃)1 h后,人參皂苷Rb1高、中、低劑量組分別加入濃度為250、50、10 mmol/L的人參皂苷Rb1,加入等體積生理鹽水做試劑空白。繼續培養2 h后,模型組和人參皂苷Rb1高、中、低劑量組分別加入Aβ1-42至其濃度達到1 mmol/L。繼續培養6 h,取出腦片,做后續檢測。
2.3 蛋白表達量測定
2.3.1 蛋白提取
各組腦片取出后,迅速經人工腦脊液清洗后,放入1.5 mL的離心管中,每片加入200 μL的RIPA組織裂解液(已加入蛋白酶及磷酸酶抑制劑)。冰上研磨成組織勻漿,4 ℃離心(15 000 × g,20 min),取上清,測定總蛋白含量。取測定總蛋白濃度后的蛋白提取液樣品,加入等體積的2×上樣緩沖液(125 mmol/L三羥甲基氨基甲烷(Tris)pH 6.8,質量濃度為10 g/L甘氨酸(glycerol),質量溶度為10 g/L的十二烷基磺酸鈉(SDS),質量分數為0.006%溴酚藍,130 mmol/L二硫蘇糖醇(DTT))混勻,在95 ℃沸水中煮5 min,冰上冷卻后,-80 ℃儲存備用。
2.3.2 總蛋白含量測定
蛋白含量按照BCA試劑盒操作進行測定:1)將50體積的BCA reagent與1體積Cu reagent混合,配置成工作溶液(working reagent,WR);2)用超純水將標準品BSA(4 000 μg/mL)稀釋至2 000、1 000、500、250、125、25 μg/mL;3)將25 μL不同濃度的標準品BSA或待測樣品與同體積的WR工作溶液混合;4)37 ℃反應30 min,冷卻至室溫,混勻,加入96孔培養板(設3個復孔)。562 nm下測定的吸光度,繪制標準曲線并計算總蛋白濃度。
2.3.3 蛋白印跡反應
配置5%濃縮膠(30% acrylamide 1 700 μL,1.0 M Tris(pH 6.8)1 250 μL,10% SDS 100 μL,10% AP 100 μL,TEMED 10 μL,dd H2O 6 800 μL)、10%~12%分離膠(30% acrylamide 3 300 μL,1.5 M Tris(pH 8.8)2 500 μL,10% SDS 100 μL,10% AP 100 μL,TEMED 4 μL,ddH2O 4 000 μL)及電泳緩沖液(Tris 15.1 g,glycine 94 g,SDS 5 g,加入800 mL去離子水溶解后定容至1 L),按預定順序將30 μg各蛋白樣品上入泳道上樣;連接電泳裝置與電源,調節電壓進行電泳分離;將凝膠板置于盛有轉膜緩沖液(Tris 5.8 g,glycine 2.9 g,SDS 0.37 g,加入去離子水600 mL溶解,調節PH值至8.3,定容至800 mL后,加入200 mL甲醇)的容器中,安裝轉膜裝置,注滿4 ℃預冷的轉膜緩沖液,調節電壓轉膜;洗膜(室溫,5 min);室溫封閉1 h(封閉液:5%脫脂奶粉用TBST預先配制,并于搖床上震搖均勻);孵一抗(4 ℃,大于8小時);TBST洗膜(室溫,3×5 min);孵二抗(室溫,60 min);TBST洗膜室溫,3×5 min);用ECL顯影液顯影條帶,凝膠成像儀拍照。用anti-β-actin孵育同一張PVDF膜作為內參。用 Quantity One軟件對條帶進行光密度分析,用目的蛋白與內參蛋白(β-actin)的光密度比值代表目的蛋白的相對含量。
2.4 統計學分析
數據結果均以平均數±標準差表示,數據處理采用one-way ANOVA進行方差分析,P<0.05視為具有顯著性統計學差異。
3 結果
3.1 A β1-42誘導對小鼠培養腦片Tau及p-Tau的影響
與空白組比較,模型組Tau蛋白表達無增加(P>0.05),模型組p-Tau表達增加(P<0.01或P<0.05)(見圖1)。

圖1 A β1-42誘導對小鼠培養腦片Tau及p-Tau的影響
3.2 A β1-42誘導對小鼠培養腦片Erk1/2及p-Erk1/2的影響
與空白組比較,模型組Erk1/2蛋白水平無增加(P>0.05),模型組p-Erk1/2蛋白水平明顯增加(P<0.01)(見圖2)。

圖2 A β1-42誘導對小鼠培養腦片Erk1/2及p-Erk1/2的影響
3.3 人參皂苷Rb1對小鼠培養腦片Tau及p-Tau的影響
小鼠腦片經過Rb1培養后,與空白對照相比,Tau蛋白表達量無明顯增加;與模型組相比,人參皂苷Rg1各劑量組Ser199、Ser202、Ser396位點標記 的p-Tau蛋白表達水平均有不同程度減少(P<0.05或P<0.01),人參皂苷Rb1各劑量組之間比較,大劑量組較中、小劑量組更有效降低p-Tau的表達(P<0.05或P<0.01)(見圖3)。
圖3 人參皂苷Rb1對AD模型小鼠腦片Tau及p-Tau的影響
3.4 人參皂苷Rb1對小鼠培養腦片Erk1/2及p-Erk1/2的影響
小鼠腦片經過Rb1培養后,與空白對照相比,Erk1/2蛋白表達量無明顯增加;與模型組相比,人參皂苷Rb1各劑量組p-Erk1/2蛋白表達水平均有不同程度減少(P<0.05或P<0.01),人參皂苷Rb1各劑量組之間比較,大劑量組較中小劑量組更有效降低p-Erk1/2的蛋白水平(P<0.05或P<0.01)(見圖4)。
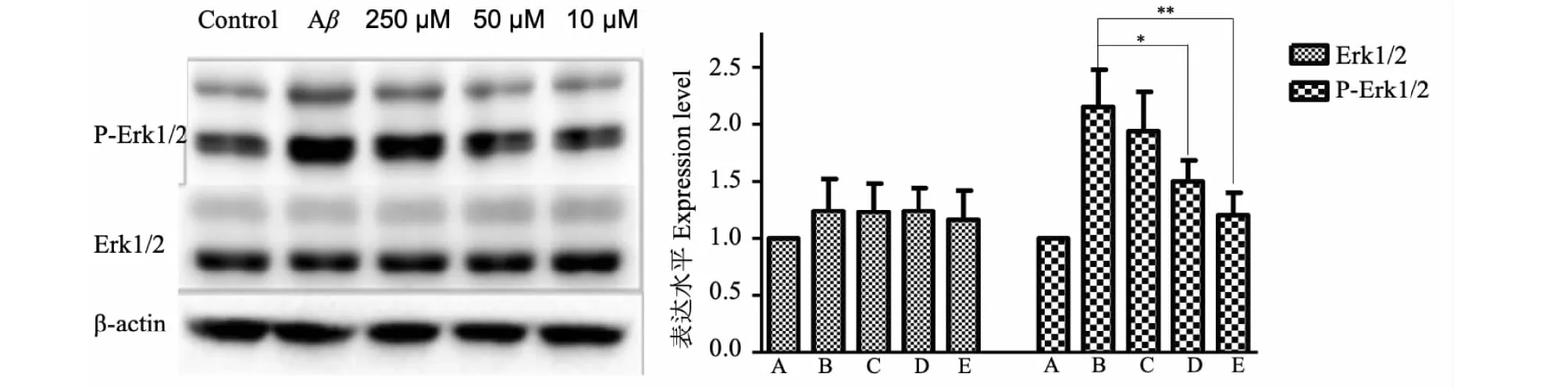
圖4 人參皂苷Rb1對AD模型小鼠腦片p-Erk1/2及Erk1/2的影響
3 討論
老年癡呆(AD)是一種常見的中樞神經系統退行性疾病,嚴重害老年人健康。由于微管相關蛋白(Tau)過度磷酸化而形成的神經纖維結節(NFT)是AD患者腦內典型病理改變之一。正常的微管相關蛋白(Tau)能促進微管蛋白聚合成微管并增強其穩定性,在神經系統形成和軸突信號傳導中起著重要作用,過度磷酸化的Tau喪失了促進微管蛋白聚合的能力,導致神經元微管解體,引起軸漿轉運障礙,神經纖維變性。當Tau蛋白去磷酸化后,可使NFT發生松解,釋放出的Tau又重新恢復其促微管的活力[14-16]。
Aβ1-42是AD患者腦內引起Tau蛋白磷酸化的主要物質,抑制Aβ1-42引起Tau蛋白磷酸化對AD的預防和治療有幫助[17,18]。本實驗研究發現:Aβ1-42可誘導小鼠腦片Tau蛋白在特異性位點(Ser199、Ser202、Ser396)的磷酸化水平增加(與正常組比較差異具有顯著性,P<0.01);而給與不同劑量人參皂苷Rb1處理后,可降低這些特異性位點的Tau蛋白的磷酸化水平(與Aβ1-42組比較差異具有顯著性,P<0.05)。我們的部分研究結果(Tau蛋白Ser396位點)與Zhao等[11]在神經干細胞分化過程中的研究結果一致(人參皂苷Rb1可減輕β-淀粉樣蛋白25-35誘導的神經干細胞分化過程中Tau蛋白過度磷酸化),與他們的實驗不同的是:本實驗以小鼠海馬腦片為研究對象,觀察了三個Tau蛋白的特異性位點,從組織水平說明了人參皂苷Rb1能有效減輕Aβ1-42引起的Tau蛋白不同位點的過度磷酸化,從而減輕NFT的形成;本研究還發現,Aβ1-42引起的Tau蛋白不同特異性位點(Ser199、Ser202、Ser396)磷酸化水平的異常升高隨人參皂苷Rb1劑量的增加而降低,表明人參皂苷Rb1對Tau蛋白不同特異性位點磷酸化的抑制作用具有劑量依賴性。
Tau蛋白的磷酸化受蛋白激酶和蛋白磷酸酯酶的調節,許多蛋白激酶如周期蛋白依賴性激酶(CDK)、糖原合成激酶3β(GSK-3β)、絲裂原激活的蛋白激酶(MAPK)都能促使Tau蛋白磷酸化[19-23]。已有研究表明:人參皂苷Rb1可能可以通過激活PI3K、抑制GSK-3β、影響p25/cdk5等減輕Tau蛋白過度磷酸化善作用[8-10]。我們的研究發現:Aβ1-42可使p-Erk1/2蛋白水平明顯增加(與正常組比較差異具有顯著性,P<0.01),總Erk1/2水平升高未見顯著性差異(P>0.05),說明Aβ1-42可能通過激活Erk1/2,誘導Tau 蛋白在特異性位點發生磷酸化;而我們用人參皂苷Rb1(50 μmol/L 和250 μmol/L)預處理后,p-Erk1/2蛋白水平的異常升高得到明顯改善(與Aβ1-42組比較差異具有顯著性,P<0.05,P<0.01),對總Erk1/2水平的影響未見顯著性差異(P>0.05)。本研究還發現,Aβ1-42引起的p-Erk1/2表達水平的異常升高隨人參皂苷Rb1劑量的增加而降低,表明人參皂苷Rb1對Erk磷酸化的抑制作用具有劑量依賴性。
我們的研究結果表明:Aβ1-42可通過激活Erk誘導Tau蛋白發生異常磷酸化,人參皂苷Rb1則能劑量依賴性的通過抑制Erk1/2的過度激活降低Tau蛋白的磷酸化水平,使其去磷酸化增多而穩定神經元的微管系統,恢復其功能,進而有可能逆轉AD的病理改變,成為用于治療AD的藥物。本研究為人參皂苷Rb1作為AD的治療的潛在藥物研究提供了實驗依據,然而對于其具體的作用機制,尚有待于進一步的研究證明。

