系統性紅斑狼瘡累及消化道CT表現
徐婧梅,劉 丹,廖鴻帆,文 明
(重慶醫科大學附屬第一醫院放射科,重慶 400010)
系統性紅斑狼瘡(systemic lupus erythematosus, SLE)為慢性自身免疫性結締組織病,好發于生育期女性,亞洲為高發地區,可累及全身多個器官或系統,常見腎、心、肺、血液及神經等系統,而消化道受累相對少見。SLE累及消化道臨床表現缺乏特異性,主要為輕-中度腹痛、腹脹、腹瀉和惡心嘔吐,若診斷和治療不及時,易引發腸穿孔、腸壞死等并發癥,嚴重者危及生命[1]。本研究回顧性分析17例經臨床證實的SLE累及消化道患者的CT表現,旨在提高早期診斷水平。
1 資料與方法
1.1 一般資料 回顧性分析2016年1月—2019年3月重慶醫科大學附屬第一醫院臨床診斷的17例SLE累及消化道患者,男1例,女16例,年齡21~60歲,平均(38.8±11.8)歲;臨床表現:腹痛14例,腹脹7例,腹瀉6例,惡心、嘔吐8例,嘔血1例,關節痛1例,肛門停止排氣排便1例。SLE均按照美國風濕病學會(American College of Rheumatology, ACR)1997年SLE分類標準(滿足4條以上)確診;經糖皮質激素或免疫抑制劑沖擊治療后病情好轉,消化道癥狀消失;均有完整腹部CT資料。
1.2 儀器與方法 采用GE LightSpeed VCT 64排螺旋CT機、Siemens雙源CT機,管電壓110~120 kV,管電流250 mA,球管旋轉時間0.6 s,螺距0.984∶1,層厚5 mm,層間距5 mm。囑患者檢查前禁食6~8 h,進入檢查室前飲水500~800 ml,取仰臥位接受檢查。平掃后以高壓注射器經肘靜脈注入對比劑優維顯300 mgI/ml或370 mgI/ml,于平掃相同層面行動態雙期或3期增強掃描,動脈期、靜脈期及延遲期分別為注射對比劑后30 s、60 s及180 s,掃描范圍自膈頂至盆腔底部。將掃描數據上傳至PACS系統進行CT三維圖像后處理,層厚為1 mm,間隔0.4 mm,處理方法包括腸系膜上動脈及靜脈最大密度投影(maximum intensity projection, MIP)及多平面重建(multi planar reformation, MPR)等。
1.3 圖像分析 由2名高年資放射科副主任醫師采用雙盲法閱片,意見不一時經協商決定。在厚層及薄層MPR、MIP圖像上從冠狀位、矢狀位、軸位等多角度進行觀察,包括病變累及部位、消化道壁厚度(將腸壁>3 mm、胃壁>5 mm定義為消化道壁增厚)及腸道擴張(將管腔最明顯擴張區域小腸直徑>3 cm、大腸直徑>5.5 cm定義為腸腔擴張)、特殊征象(如腸壁水腫增厚形成“同心圓征”或“靶征”,腸壁積氣、腸系膜血管炎性改變形成“梳征”等)及其他伴隨征象[如腸系膜脂肪間隙模糊、腸道假性梗阻(intestinal pseudo-obstruction, IPO)、多漿膜腔積液及泌尿系炎性改變等]。
2 結果
17例全部接受平掃,其中15例接受增強掃描。SLE病變累及胃8例(單純胃受累1例),十二指腸2例,空腸9例(單純空腸受累1例),回腸9例(單純回腸受累1例),升結腸9例,橫結腸1例,降結腸6例,乙狀結腸8例,直腸8例,累及全結腸者1例。典型病例圖片見圖1、2。
2.1 消化道受累CT表現 17例中,15例受累消化道壁增厚、腫脹;12例平掃可見“同心圓征”;14例增強掃描出現分層強化,其中11例呈“靶征”,即黏膜層和漿膜層明顯強化,黏膜下水腫未見明顯強化,形似“靶環”樣改變;2例局部腸壁稍腫脹,未見明顯“靶征”表現;13例出現腸腔不同程度擴張伴積氣、積液,腸壁亦見積氣,表現為IPO者4例。
2.2 腸系膜CT表現 15例接受增強掃描患者中,11例可見“梳征”或“柵欄樣”改變,即腸系膜邊緣小血管增粗、增多,呈平行樣密集排列;9例腸系膜脂肪間隙模糊;3例腹膜增厚;1例腹膜后淋巴結增大。
2.3 其他伴隨征象 腹腔及盆腔積液15例,胸腔積液12例,心包積液3例;腸系膜上動脈栓塞1例;脾大3例;泌尿系改變5例(包括輸尿管炎性狹窄、膀胱壁增厚及雙腎或輸尿管積水等);腸脂垂炎3例。
3 討論
消化道受累并未納入ACR診斷SLE標準[2],與SLE患者可能合并感染性疾病導致胃腸道癥狀或藥物所致胃腸道不良反應等有關;但SLE處于活動期時,約30%~50%患者會出現消化系統癥狀[3],多以急性腹痛為首發癥狀,以腹脹為最常見體征,腸系膜血管炎(lupus mesenteric vasculitis, LMV)是最常見病因,成人約占18.5%,為急性腹痛狼瘡患者中最嚴重且可能致命的胃腸道并發癥之一[4]。因此,早期診斷SLE累及消化道十分重要。
3.1 SLE累及消化道的可能原因 目前對于SLE累及消化系統病因說法不一,文獻[5]報道中提及的可能病因包括LMV和繼發于狼瘡本身的漿膜炎,以及應用藥物不良反應等。其中LMV最常見,且致死風險較高,循環免疫復合物沉積在小動脈、毛細血管和靜脈中,導致腸道小血管炎癥及管腔內血栓形成,出現血供障礙、壞死性血管炎等,表現為消化道壁缺血、出血、潰瘍、壞死,甚至腸穿孔等一系列并發癥[6];病理檢查顯示小血管內炎性細胞浸潤和組織壞死[7],常見于SLE活動期,且與活動分數不成正比。漿膜炎被認為是漿膜層和漿膜下層血管受累而發生的纖維素樣壞死、血管壁白細胞碎裂、纖維蛋白性血栓形成,而黏膜下水腫則為血管及血管周圍纖維蛋白樣沉積[3]。
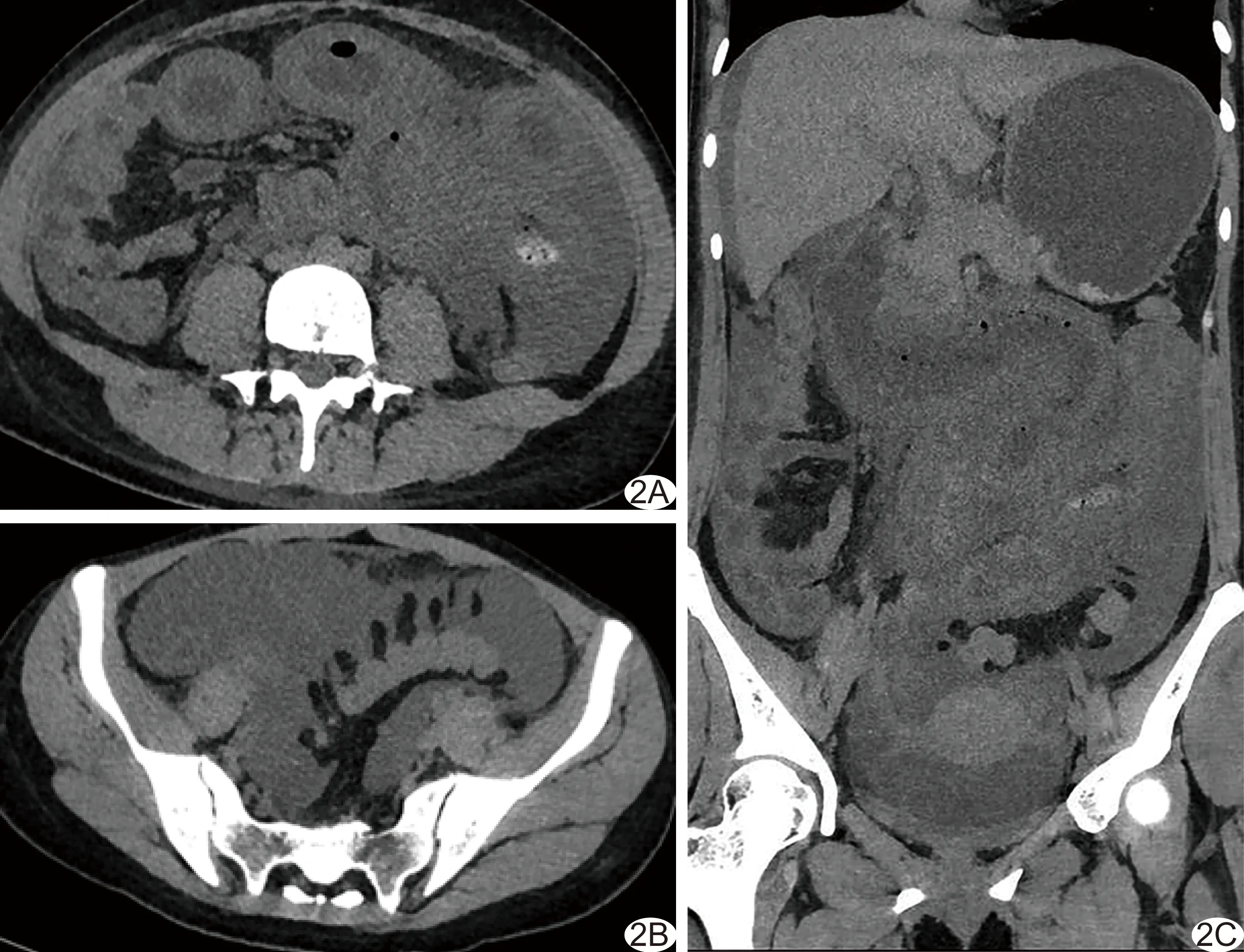
圖2 患者女,27歲,SLE,因關節痛、胸悶、氣促入院,入院前腹部增強CT未見明顯異常,12天后再行腹部CT平掃 A、B.軸位CT圖像示“同心圓征”; 盆腔大量積液,出現腸脂垂炎; C.冠狀位MPR示腸壁廣泛積氣,腸道擴張、積液,腸系膜脂肪間隙模糊,腹盆腔大量積液
3.2 SLE累及消化道及腸系膜CT表現 本研究中17例均存在不同程度消化道異常CT表現,15例見管壁增厚水腫,部分平掃即呈“同心圓征”,增強后“靶征”樣強化,并出現腸壁積氣、腸腔明顯擴張的IPO表現。腸道壁水腫、增厚可能與腸道蛋白質過量丟失而致低蛋白血癥有關,其機制包括血管炎導致腸道血管通透性增加、補體轉換或細胞因子介導的腸道壁損傷和血管舒張、腸淋巴管擴張[8]。研究[9]表明,LMV、IPO及泌尿系炎性改變常并存,可能與血管炎引起急性內臟平滑肌缺血性損傷而致運動障礙相關。本組3例出現LMV、IPO及泌尿系炎性改變共存。文獻[10]報道,如腸壁厚度超過8 mm,可能導致LMV治愈后復發,需給予高劑量免疫抑制劑(如環磷酰胺)治療,故CT提示腸壁增厚對臨床治療有提示作用。
腸系膜異常主要表現為腸系膜血管因炎性反應增粗,沿系膜緣小血管聚集、平行排列而呈現“梳狀”或“柵欄樣”改變,以及腸系膜脂肪間隙模糊、腹膜增厚等。本組腸系膜小血管“梳征”改變占73.33%(11/15),為SLE累及消化系統的特征性表現之一。
SLE可累及消化系統的任何部位[11]。KO等[12]發現受累腸管主要以空腸、回腸為主。本組升結腸受累者亦較多,乙狀結腸及直腸稍次之,可能與SLE累及消化道時最先影響腸系膜上動脈支配區域有關;直腸則因側支循環較豐富而較少受累。
3.3 其他表現 本組5例并存泌尿系炎性改變,包括炎癥導致腎輸尿管積水、輸尿管或膀胱壁增厚等,可能與LMV經常與泌尿系異常共存相關[13],也可能是IPO并發癥之一(其中3例為LMV、IPO及泌尿系炎性改變共存)。本組僅1例腹膜后淋巴結腫大,提示SLE累及消化道對淋巴系統影響較小。
3.4 鑒別診斷 SLE累及消化道時,腹部CT征象與炎癥性腸病如克羅恩病(Crohn disease, CD)、潰瘍性結腸炎(ulcerative colitis, UC)等存在重疊,與CD相鑒別更困難。
CD多見于男性,可累及全消化道,多累及回盲部,呈節段性或局灶性分布;臨床表現為腹痛、腹脹等,以間歇性腹痛常見,多見右下腹痛及腹部包塊,腹瀉可表現為黏液糊狀或便血,還可有發熱、消瘦等全身癥狀。影像學可表現為“靶征”及“梳征”等,常以腸道系膜側增厚為主,即偏心性增厚[14];病變后期可見腸壁節段性僵硬、腸腔狹窄,而SLE累及消化道多表現為腸壁均勻且多灶性增厚,且腸腔多擴張。CD偶可見局部腸壁破潰,形成竇道或瘺管,腸系膜根部多出現淋巴結腫大(短徑≥5 mm);而SLE累及消化道患者淋巴結腫大較少見。結合實驗室檢查及臨床表現有利于鑒別診斷。
UC為多發于直腸和乙狀結腸的慢性非特異性炎癥,臨床表現多為腹瀉及黏液膿血便,可伴有腹痛及里急后重等,病變進展特點為多從遠端結腸逆行向近端發展,腸壁增厚呈均勻彌漫性,慢性期可有結腸袋消失、腸管僵直、變窄。UC也可見“梳征”,但病變部位多較低,結合特征性臨床表現較易與SLE累及消化道鑒別。
總之,當SLE患者出現急性腹痛癥狀,CT顯示腸系膜血管“梳征”或“柵欄征”、腸壁水腫、IPO并伴大量腹腔積液、累及泌尿系等征象時,多提示SLE累及消化系統、甚至發生LMV;即使臨床未確診SLE,上述CT征象也可對臨床尋找病因起到一定提示作用,有利于避免因不明原因急性腹痛等致行開腹手術[15]。

